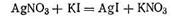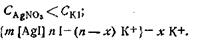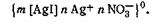Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Мицеллярная теория строения коллоидной частицы.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Всякий лиофобный (гидрофобный) коллоидный раствор состоит из двух частей: мицелл и интермицеллярной жидкости. Мицеллы — это отдельные коллоидные частицы, которые в совокупности составляют дисперсную фазу золя, а интермицеллярная жидкость — это дисперсионная среда того же золя, включающая помимо растворителя все другие растворенные в нем вещества (электролиты и неэлектролиты), которые не входят в состав мицелл. Коллоидная мицелла имеет значительно более сложное строение, чем обычные молекулы. В ней различают две основные части: внутреннюю — нейтральную, обычно называемую ядром, и внешнюю — ионогенную, в свою очередь состоящую из двух слоев (двух ионных сфер). Ядро составляет основную массу коллоидной мицеллы и представляет собой комплекс, состоящий из атомов (в случае гидрозолей металлов или неметаллов) или нейтральных молекул [в золях гидроксида железа (III) или иодида серебра]. Общее число входящих в состав ядра атомов или молекул огромно (от нескольких сот до миллионов) и зависит от степени дисперсности золя и от размеров самих атомов или молекул. В процессе образования гидрофобного золя рост ядра в той или иной стадии может быть приостановлен созданием так называемого адсорбционного слоя из ионов стабилизатора. Ионная сфера вокруг ядра коллоидной мицеллы состоит из двух слоев (или двух сфер)— адсорбционного и диффузного. Адсорбционный слой слагается из слоя потенциалопределяющих ионов, адсорбированных на поверхности ядра и сообщающих ему свой заряд, и части противоионов, проникших за плоскость скольжения и наиболее прочно связанных электростатическими силами притяжения. Вместе с ядром эта ионная атмосфера образует как бы отдельный гигантских размеров многозарядный ион — катион или анион, называемый гранулой. Диффузный слой, расположенный за плоскостью скольжения, в отличие от адсорбционного не имеет в дисперсионной фазе резко очерченной границы. Этот слой состоит из противоионов, общее число которых равняется в среднем разности между всем числом потенциалопределяющих ионов и числом противоионов, находящихся в адсорбционном слое. Гранула вместе с диффузным слоем противоионов составляет коллоидную частицу — мицеллу. Мицелла всегда электронейтральна. Необходимо отметить, что противоионами могут служить любые ноны тех электролитов, которые участвуют в реакциях при образовании данного золя или же присутствуют как посторонние примеси
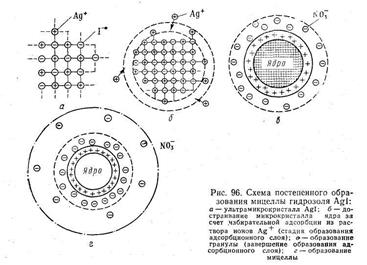
Согласно теории строения коллоидной мицеллы ядро в данном случае будет состоять из нейтральных молекул AgI. В зависимости от относительной концентрации реагирующих веществ может быть три случая. 1. Концентрация нитрата серебра больше концентрации иодида калия. При этом в системе, помимо нерастворимого комплекса Agl, имеются ионы Ag+, K+ и NO3-. В процессе роста ядра коллоидной мицеллы достраивание решетки AgI идет только за счет ионов Ag+, которые прочно входят в его структуру, сообщают ему электрический заряд и потому называются потенциалопределяющими. Полученный в результате адсорбции ионов Ag+ электрический заряд определяет термодинамический потенциал. Положительно заряженное ядро притягивает оставшиеся в растворе противоионы NО3-. Часть противоионов при этом входит в состав адсорбционного слоя, оставшаяся часть — в состав диффузного слоя. На рис. 6.11 изображена схема постепенного образования мицеллы гидрозоля AgI. 2. Концентрация нитрата серебра меньше концентрации иодида калия. В этом случае поверхность ядра адсорбирует только анион I–, который входит в его структуру и определяет знак заряда. 3. Концентрации нитрата серебра и иодида калия равны. В этом случае золь находится в так называемом изоэлектрическом состоянии, т. е. в состоянии, при котором электрокинетический потенциал (дзета-потенциал) равен нулю. В этом случае противоионы диффузного слоя перешли в адсорбционный слой, а потому гранула лишена заряда. Строение мицелл в коллоидной химии принято выражать особыми мицеллярными формулами. Так, в обобщенном и упрощенном виде строение любой мицеллы гидрофобного золя можно передать следующими формулами: {m[ядро]nК+(n—х)А-}+хА- — положительно заряженная мицелла; {m[ядро]nА-(n—х)К+}-хК+— отрицательно заряженная мицелла, где К+ — катионы; А–—анионы; n — число потенциалопределяющих ионов; х — число ионов, находящихся в диффузном слое; m — число нейтральных атомов или молекул в ядре. В этих формулах в квадратные скобки заключено ядро, а в фигурные— заряженный комплекс (гранула). Мицеллярная формула иодида серебра для случая, когда CAgNO3>CK1, имеет вид
Для случая, когда
Когда концентрации обоих электролитов равны,
Форма коллоидных частиц может быть самой разнообразной. Изучение строения и процесса образования коллоидных частиц с помощью электронного микроскопа позволило установить, что их форма во многом определяется типом кристаллической решетки ядра, которую образуют входящие в него атомы и молекулы. В зависимости от природы вещества решетка может быть как симметричной, так и асимметричной. От формы частиц дисперсной фазы зависят некоторые свойства коллоидных растворов. Так, коллоидные системы асимметрического строения способны образовать внутреннюю сетчатую структуру. Опыты показали, что в случае гидрофобных коллоидов прибавление электролита к коллоидному раствору почти не влияет на термодинамический потенциал, тогда как на электрокинетический потенциал (дзета-потенциал) оказывает сильное влияние. Вязкость гидрофобных золей. Измерение вязкости золей имеет большое значение при изучении природы коллоидных растворов. Вязкость гидрофобных золей, как показали многочисленные исследования, зависит только от концентрации и не зависит от способа их приготовления. Увеличение относительной вязкости гидрофобных золей в связи с возрастанием дзета-потенциала объясняется тем, что при этом возрастает концентрация противоионов, а следовательно, и сольватация (гидратация), что вызывает увеличение объема коллоидных мицелл. Между относительной вязкостью и радиусом коллоидных частиц существует обратная зависимость: при одинаковых концентрациях гидрофобного золя вязкость растворов, содержащих частицы меньших размеров, как правило, бывает больше, чем вязкость растворов, содержащих частицы больших размеров.
|
||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 799; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.195.180 (0.007 с.) |

 ПРИМЕР. Для примера рассмотрим получение гидрозоля иодида серебра методом конденсации. Оно основано на химической реакции
ПРИМЕР. Для примера рассмотрим получение гидрозоля иодида серебра методом конденсации. Оно основано на химической реакции