
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
В цепных реакциях выделяют три стадии: зарождение цепи, ее развитие и обрыв. Зарождение (иницирование) происходит под воздействием светового, радиационного, термического или другого воздействия.Содержание книги
Поиск на нашем сайте Примером неразветвленной цепной реакции может служить H2 + Br2 = 2HBr, иницирование которой определяется термо- и фотодиссоциацией: иницирование:
рост цепи (развитие):
обрыв цепи:
Горение водорода относится к разветвленным цепным реакциям:
По цепному механизму протекают многие реакции горения, полимеризации, окисления, термического разложения. В этой модели показаны различные стадии цепной реакции, которая происходит между водородом и хлором на свету. Реакция начинается с поглощения молекулой хлора достаточно энергичного кванта света, что приводит к распаду молекулы на два отдельных атома (стадия инициирования). Отдельный атом хлора имеет неспаренный электрон, более того, ему не хватает всего одного электрона до конфигурации благородного газа, и потому химически он очень активен (является радикалом). Он в состоянии атаковать молекулу водорода и оторвать один из атомов водорода, образовав с ним молекулу HCl. После этого второй атом водорода остается свободным. У него также имеется один неспаренный электрон, и когда такой атом сталкивается с молекулой хлора, он аналогичным образом отрывает от нее один из атомов хлора. Второй атом хлора остается свободным, что обусловливает повторение описанного процесса. Этот процесс называется стадией роста цепи в цепной реакции. Если же встречаются вместе два свободных атома (в нашей модели так встречаются атом водорода и атом хлора), то они соединяются в молекулу. После этого процесса радикалов не остается, и данная цепочка цепной реакции обрывается. Поэтому данная стадия цепной реакции называется стадией обрыва цепи. Передача энергии для активации вступающих во взаимодействие молекул может осуществляться либо в форме теплоты (т. н. темновые реакции), либо в виде квантов электромагнитного излучения. Реакции, в которых активация частиц является результатом их взаимодействия с квантами электромагнитного излучения видимой области спектра, называют фотохимическими реакциями. При всех фотохимических процессах выполняется закон Гротгуса: Химическое превращение вещества может вызвать только то излучение, которое поглощается этим веществом. Излучение, отражённое веществом, а также прошедшее сквозь него, не вызывают никаких химических превращений. Иногда фотохимические процессы происходят под действием излучения, которое не поглощается реагирующими веществами; однако в таких случаях реакционная смесь должна содержать т.н. сенсибилизаторы. Механизм действия сенсибилизаторов заключается в том, что они поглощают свет, переходя в возбуждённое состояние, а затем при столкновении с молекулами реагентов передают им избыток своей энергии. Сенсибилизатором фотохимических реакций является, например, хлорофилл (см. ниже). Взаимодействие света с веществом может идти по трём возможным направлениям: 1. Возбуждение частиц (переход электронов на вышележащие орбитали): A + hν ––> A* 2. Ионизация частиц за счет отрыва электронов: A + hν ––> A+ + e– 3. Диссоциация молекул с образованием свободных радикалов (гомолитическая) либо ионов (гетеролитическая): AB + hν ––> A• + B• AB + hν ––> A+ + B– Между количеством лучистой энергии, поглощенной молекулами вещества, и количеством фотохимически прореагировавших молекул существует соотношение, выражаемое законом фотохимической эквивалентности Штарка – Эйнштейна: Число молекул, подвергшихся первичному фотохимическому превращению, равно числу поглощенных веществом квантов электромагнитного излучения. Поскольку фотохимическая реакция, как правило, включает в себя и т.н. вторичные процессы (например, в случае цепного механизма), для описания реакции вводится понятие квантовый выход фотохимической реакции: Квантовый выход фотохимической реакции γ есть отношение числа частиц, претерпевших превращение, к числу поглощенных веществом квантов света. Квантовый выход реакции может варьироваться в очень широких пределах: от 10-3(фотохимическое разложение метилбромида) до 106 (цепная реакция водорода с хлором); в общем случае, чем более долгоживущей является активная частица, тем с большим квантовым выходом протекает фотохимическая реакция. Важнейшими фотохимическими реакциями являются реакции фотосинтеза, протекающие в растениях с участием хлорофилла:
Процесс фотосинтеза составляют две стадии: световая, связанная с поглощением фотонов, и значительно более медленная темновая, представляющая собой ряд химических превращений, осуществляемых в отсутствие света. Суммарный процесс фотосинтеза заключается в окислении воды до кислорода и восстановлении диоксида углерода до углеводов: СО2 + Н2О + hν ––> (СН2О) + О2, ΔG° = 477.0 кДж/моль Протекание данного окислительно-восстановительного процесса (связанного с переносом электронов) возможно благодаря наличию в реакционном центре хлорофилла Сhl донора D и акцептора A электронов; перенос электронов происходит в результате фотовозбуждения молекулы хлорофилла: DChlA + hν ––> DChl*A ––> DChl+A– ––> D+ChlA– Возникающие в данном процессе заряженные частицы D+ и A– принимают участие в дальнейших окислительно-восстановительных реакциях темновой стадии фотосинтеза.
22. Влияние температуры на скорость реакции. Правило Вант-Гоффа. Уравнение Аррениуса. Из качественных соображений понятно, что скорость реакций должна увеличиваться с ростом температуры, т.к. при этом возрастает энергия сталкивающихся частиц и повышается вероятность того, что при столкновении произойдет химическое превращение. Для количественного описания температурных эффектов в химической кинетике используют два основных соотношения - правило Вант-Гоффа и уравнение Аррениуса. Правило Вант-Гоффа заключается в том, что при нагревании на 10 оС скорость большинства химических реакций увеличивается в 2
где Гораздо более точным является уравнение Аррениуса, описывающее температурную зависимость константы скорости:
где R - универсальная газовая постоянная; A - предэкспоненциальный множитель, который не зависит от температуры, а определяется только видом реакции; EA - энергия активации, которую можно охарактеризовать как некоторую пороговую энергию: грубо говоря, если энергия сталкивающихся частиц меньше EA, то при столкновении реакция не произойдет, если энергия превышает EA, реакция произойдет. Энергия активации не зависит от температуры. Из качественных соображений понятно, что скорость реакций должна увеличиваться с ростом температуры, т.к. при этом возрастает энергия сталкивающихся частиц и повышается вероятность того, что при столкновении произойдет химическое превращение. Для количественного описания температурных эффектов в химической кинетике используют два основных соотношения - правило Вант-Гоффа и уравнение Аррениуса. Правило Вант-Гоффа заключается в том, что при нагревании на 10 оС скорость большинства химических реакций увеличивается в 2
где Гораздо более точным является уравнение Аррениуса, описывающее температурную зависимость константы скорости:
где R - универсальная газовая постоянная; A - предэкспоненциальный множитель, который не зависит от температуры, а определяется только видом реакции; EA - энергия активации, которую можно охарактеризовать как некоторую пороговую энергию: грубо говоря, если энергия сталкивающихся частиц меньше EA, то при столкновении реакция не произойдет, если энергия превышает EA, реакция произойдет. Энергия активации не зависит от температуры. Графически зависимость k (T) выглядит следующим образом:
При низких температурах химические реакции почти не протекают: k (T) Энергию активации можно определить, измерив константу скорости при двух температурах. Из уравнения (4.2) следует:
Более точно энергию активации определяют по значениям константы скорости при нескольких температурах. Для этого уравнение Аррениуса (4.2) записывают в логарифмической форме
и записывают экспериментальные данные в координатах ln k - 1/ T. Тангенс угла наклона полученной прямой равен - EA / R. Для некоторых реакций предэкспоненциальный множитель слабо зависит от температуры. В этом случае определяют так называемую опытную энергию активации:
Если предэкспоненциальный множитель - постоянный, то опытная энергия активации равна аррениусовской энергии активации: E оп = EA.
23. Теория активных соударений. Энергия активации. Понятие о теории переходного состояния. Энергия активации Еа - это та дополнительная энергия (к средней энергии Е сталкивающихся частиц), которая необходима, чтобы столкновение привело к химической реакции.
Основная задача теорий химической кинетики - предложить способ расчета константы скорости элементарной реакции и ее зависимости от температуры, используя различные представления о строении реагентов и пути реакции. Мы рассмотрим две простейшие теории кинетики - теорию активных столкновений (ТАС) и теорию активированного комплекса (ТАК). Теория активных столкновений (она также называется теорией активных соударений) явилась первой теорией, количественно объяснившей данные кинетических исследований на основе молекулярно-кинетических представлений. Эта теория разработана как для случая бимолекулярных столкновений, так и для тримолекулярных столкновений. Ниже рассматриваются основные результаты, полученные для бимолекулярных столкновений. В основе теории использованы следующие предположения (постулаты теории активных соударений): 1) Первым актом возможного взаимодействия молекул является их столкновение. 2) Столкновение молекул может служить причиной превращения молекул только в том случае, если энергия столкновения превышает или по крайней мере равна некоторой критической величине eа. Столкновения с энергией, равной этой величине или превышающей ее, называются активными. 3) Активные столкновения приводят к благоприятному исходу, то есть к началу химической реакции, если расположение молекул в момент столкновения соответствует данной реакции. Первый постулат теории означает, что теория не рассматривает реакции, протекающие под непрерывным воздействием квантов света или частиц высокой энергии (гамма-квантов, электронов и т.д.). Второй постулат теории предполагает, что для начала химического превращения сталкивающиеся молекулы должны обладать энергией, достаточной для преодоления вполне определенного энергетического барьера. Если энергия столкновения молекул оказывается меньше eа, то происходит упругий удар без каких-либо химических превращений. Теория активных столкновений (она также называется теорией активных соударений) явилась первой теорией, количественно объяснившей данные кинетических исследований на основе молекулярно-кинетических представлений. Эта теория разработана как для случая бимолекулярных столкновений, так и для тримолекулярных столкновений. Ниже рассматриваются основные результаты, полученные для бимолекулярных столкновений. В основе теории использованы следующие предположения (постулаты теории активных соударений): 1) Первым актом возможного взаимодействия молекул является их столкновение. 2) Столкновение молекул может служить причиной превращения молекул только в том случае, если энергия столкновения превышает или по крайней мере равна некоторой критической величине eа. Столкновения с энергией, равной этой величине или превышающей ее, называются активными. 3) Активные столкновения приводят к благоприятному исходу, то есть к началу химической реакции, если расположение молекул в момент столкновения соответствует данной реакции. Первый постулат теории означает, что теория не рассматривает реакции, протекающие под непрерывным воздействием квантов света или частиц высокой энергии (гамма-квантов, электронов и т.д.). Второй постулат теории предполагает, что для начала химического превращения сталкивающиеся молекулы должны обладать энергией, достаточной для преодоления вполне определенного энергетического барьера. Если энергия столкновения молекул оказывается меньше eа, то происходит упругий удар без каких-либо химических превращений. Из третьего постулата следует, что не все активные столкновения эффективны. На рис. 12 - 1 условно показаны возможные положения двух молекул в момент столкновения. Условные благоприятные для реакции положения на рисунке подчеркнуты. Отношение числа положений, благоприятствующих химической реакции, к общему числу возможных положений молекул в момент столкновения называется стерическим фактором. Расчеты показывают, что обычно величина стерического фактора близка к 10−2. Молекулярно-кинетическая теория дает возможность рассчитывать число столкновений с определенной энергией.
1) частицы реагентов при взаимодействии теряют свою кинетическую энергию, которая превращается в потенциальную, и для того чтобы реакция свершилась, необходимо преодолеть некий барьер потенциальной энергии; Время существования активированного комплекса равно периоду колебания одной молекулы (10-13 с), поэтому он не может быть обнаружен экспериментально и, соответственно, его нельзя выделить и изучить. Следовательно, доказать истинность теории переходного состояния можно только с помощью расчетов. И для этой цели ученые задействовали самую передовую на тот момент методику, которая тогда переживала бурный расцвет - квантовую химию. Выделилось даже целое направление в квантовой химии по расчетам энергии переходного состояния.
24. Особенности и классификация каталитических процессов. Гомогенный катализ. Газовый катализ. Катализ в растворах. Кислотно-основной катализ. Классификацию каталитических процессов можно проводить по разным признакам. По фазовому составу компонентов различают гомогенные (если исходные вещества, продукты реакции и катализатор находятся в одной фазе) и гетерогенные (если реакционная смесь и катализатор находятся в разных фазах) каталитические реакции. Многие реакции, протекающие в растворах, являются гомогенными каталитическими реакциями. Гомогенно-каталитические реакции в газовой фазе «в чистом виде» встречаются редко и большинство их связано с протеканием цепных реакций. К гетерогенным каталитическим реакциям относятся процессы, протекающие на поверхности раздела фаз: газ – твёрдое тело, жидкость – твёрдое тело, жидкость – газ. В качестве катализаторов, как правило, выступают твёрдые тела: металлы, оксиды, соли и др. Ферментативный катализ – реакции, катализируемые биокатализаторами, т.е. ферментами, которые синтезируются живыми организмами и отличаются высокой специфичностью. Этот вид катализатора можно отнести к группе гомогенных каталитических реакций. Иногда их относят к микрогетерогенному катализу, когда катализатор находится в коллоидном состоянии. Недостаток такой классификации заключается в том, что в ней не учитывается основная причина каталитического действия: особенности взаимодействия катадизатора с реагирующими веществами, приводящее к изменению механизма реакции в присутствии катализатора. По механизму взаимодействия катализатор – реагент различают: гомолитический механизм катализа – каталитический процесс сопровождается разрывом некоторых электронных пар и образованием новых электронных пар и гетеролитический механизм катализа – каталитический процесс, в котором образование и разрыв двухэлектронной связи протекает без разрушения электронных пар. При таком подходе более очевидно, что природа промежуточного взаимодействия указывает на свойства, которыми должен обладать катализатор. По гомолитическому механизму осуществляются реакции синтеза аммиака, спиртов из CO и H2; гидрирования кратных связей бензола, фенола, анилина; реакции окисления SO2в SO3, NH3 в NO, метанола в формальдегид и т.д. Катализаторами таких реакций являются вещества, способные отдавать неспаренные электроны для образования новых электронных пар. К ним относятся, прежде всего, элементы с незамещенными d - и f - оболочками в виде металлов или их соединений. По гетеролитическому механизму протекают реакции крекинга углеводородов, дегидратации спиртов, гидратации олефинов и т.п. Конечно, и эта классификация в связи с недостатком надежных данных о глубоком механизме каталитического действия не является строгой. Однако хотя бы в общей форме она отражает особенности химической природы катализатора. Особое место в классификации занимает автокатализ – это реакции, в которых катализатор образуется в ходе их протекания. Скорость таких реакций сначала незначительна, затем увеличивается до максимального значения, после чего постепенно уменьшается, как уменьшается концентрация реагирующих веществ. Так, например, протекает реакция омыления уксусно-этилового эфира (гидролиз эфира) в нейтральной среде: CH3COOC2H5 + H2O ® CH3COOH + C2H5OH. Катализатором этой реакции являются ионы H+, которые образуются в результате самой реакции. ГОМОГЕННЫЙ КАТАЛИЗ, ускорение хим. р-ции в присутствии катализатора, к-рый находится в одной фазе с исходными реагентами (субстратами) в газовой фазе или р-ре. При гомогенном катализе, как и при гетерогенном катализе, катализатор в р-ции не расходуется, однако является ее необходимым участником; без катализатора р-ция протекает гораздо медленнее или не идет вовсе.
|
|||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 2089; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.013 с.) |





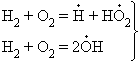

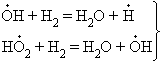





 4 раза. Математически это означает, что скорость реакции зависит от температуры степенным образом:
4 раза. Математически это означает, что скорость реакции зависит от температуры степенным образом: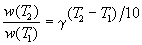 , (4.1)
, (4.1) - температурный коэффициент скорости (
- температурный коэффициент скорости ( 4). Правило Вант-Гоффа является весьма грубым и применимо только в очень ограниченном интервале температур.
4). Правило Вант-Гоффа является весьма грубым и применимо только в очень ограниченном интервале температур. , (4.2)
, (4.2)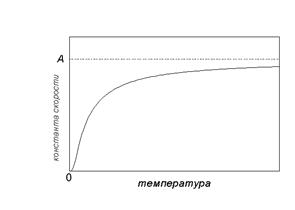
 0. При очень высоких температурах константа скорости стремится к предельному значению: k (T)
0. При очень высоких температурах константа скорости стремится к предельному значению: k (T) 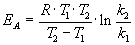 . (4.3)
. (4.3)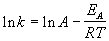
 . (4.4)
. (4.4)



