
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реальные растворы. Отклонения от закона РауляСодержание книги
Поиск на нашем сайте
Закон Рауля не выполняется для реальных растворов. Парциальные давления (или летучести) этих растворов больше или меньше давлений (или летучестей) паров идеальных растворов. Отклонения от закона Рауля в первом случае называются положительными (общее давление пара больше аддитивной величины), а во втором случае – отрицательными (общее давление пара меньше аддитивной величины). Если отклонения от закона идеальных растворов велики, то кривая общего давления пара проходит через максимум или минимум. Чем ближе между собой давления насыщенного пара чистых жидкостей, тем меньшие отклонения от закона Рауля вызывают появление экстремума на кривой общего давления. Положительные и отрицательные отклонения реальных растворов от закона Рауля обусловлены разными факторами. Если разнородные молекулы в растворе взаимно притягиваются с меньшей силой, чем однородные, то это облегчает переход молекул из жидкой фазы в газовую (по сравнению с чистыми жидкостями) и будут наблюдаться положительные отклонения от закона Рауля. Усиление взаимного притяжения разнородных молекул в растворе (сольватация, образование водородной связи, образование химического соединения) затрудняет переход молекулы в газовую фазу и поэтому будут наблюдаться отрицательные отклонения от закона Рауля. Процессы взаимного удаления однородных молекул при образовании раствора сопровождаются поглощением теплоты, поэтому в первом случае теплота смешения чистых компонентов будет положительной. Во втором случае, при более сильных взаимодействиях разнородных молекул, теплота смешения компонентов будет отрицательной. Таким образом, знак отклонения от закона Рауля и знак теплоты смешения совпадают.
Факторы, вызывающие положительные и отрицательные отклонения, могут действовать в растворе одновременно, поэтому наблюдаемые отклонения часто являются результатом наложения противоположных по знаку отклонений. Одновременное действие противоположных факторов особенно наглядно проявляется в растворах, в которых знак отклонений от закона Рауля – Генри изменяется с изменением концентрации. Из сказанного вытекает, что отсутствие отклонения от закона Рауля или равенство нулю теплоты смешения при образовании раствора одного какого-либо состава не являются признаками того, что данные компоненты образуют идеальные растворы.
Газообразная фаза, находящаяся в равновесии с жидким раствором (насыщенный пар), содержит, в общем случае, все компоненты раствора, и давление насыщенного пара, которое также часто называют упругостью пара, является суммой парциальных давлений компонентов3. Однако часто отдельные компоненты нелетучи при данной температуре и практически отсутствуют в газообразной фазе. Суммарное давление насыщенного пара (полное или общее давление) и парциальные давления являются функциями температуры и состава раствора. При постоянной температуре состояние бинарного раствора компонентов А и В определяется одной переменной – концентрацией одного из компонентов. Состав насыщенного пара определяется мольными долями компонентов в паровой фазе х' 1 и х' 2 ,. По определению парциальных величин (уравнение Дальтона):
|
||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 1223; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.75.217 (0.009 с.) |

 рр
А В
рр
А В

 и
и 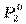 . Общее давление пара при любом значении х равно сумме парциальных давлений компонентов: P = P 1 + P 2.
. Общее давление пара при любом значении х равно сумме парциальных давлений компонентов: P = P 1 + P 2. x' 2 =
x' 2 = 



