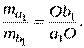Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Равновесие жидкость – жидкостьСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Растворимость жидкостей в жидкостях зависит от природы растворителя и растворённого вещества, температуры, присутствия в растворе посторонних веществ. Существуют растворы с неограниченной взаимной растворимостью, ограниченной взаимной растворимостью и с практически полной взаимной нерастворимостью жидкостей. Рассмотрим системы с ограниченной взаимной растворимостью жидкостей. Ограниченная взаимная растворимость двух жидкостей наблюдается в системах со значительным отклонением от идеальности. При этом их равновесная смесь состоит из двух отдельных жидких слоёв, представляющих собой различные фазы, отличающиеся по составу. В случае ограниченной взаимной растворимости жидкостей эти жидкие слои не являются чистыми жидкостями, а представляют собой растворы с преимущественным содержанием одного из компонентов. Состав равновесных жидких слоёв незначительно зависит от внешнего давления и определяется главным образом температурой. С ростом температуры растворимость одного компонента в другом может, как возрастать, так и уменьшаться. Температура, при достижении которой наступает неограниченная взаимная растворимость, называется критической температурой растворимости. В зависимости от того, при повышении или понижении температуры наступает неограниченная растворимость, говорят о верхней или нижней критической температуре растворимости. Для изображения зависимости взаимной растворимости жидкостей от температуры при постоянном давлении строят диаграммы состояния в координатах температура – состав (диаграммы растворимости). Такая диаграмма состояния для системы с верхней критической температурой растворения приведена на рис. 8.5. Кривая aKb, выражающая зависимость состава равновесных слоёв(т. е. с наибольшей возможной концентрацией)от температуры, называется кривой расслоения. Кривая расслоения делит диаграмму на две области: гомогенную, лежащую над кривой расслоения, и гетерогенную, находящуюся под кривой расслоения. Фигуративные точки в Рассмотрим постепенное добавление компонента В в условиях постоянного давления и температуры к системе, заданной фигуративной точкой М (система состава Х 0 при температуре Т 1). При этом фигуративная точка будет перемещаться параллельно оси состава. В начале добавление компонента В к этой системе не приводит к увеличению числа фаз. Система является раствором компонента В в компоненте А. Лишь при достижении концентрации компонента В, превышающей его растворимость при данных условиях (точка а 1, состав Х 1), появляется вторая фаза: насыщенный раствор компонента А в компоненте В (точка b 1, состав Х 6). При дальнейшем добавлении компонента В (до тех пор пока фигуративная точка будет находиться в гетерогенной области)составы отдельных равновесных фаз остаются постоянными, а изменяется только их количественное соотношение. Наконец, в точке b 1, когда смесь будет иметь общий состав Х6, система вновь станет однофазной и будет представлять собой насыщенный раствор компонента А в компоненте В. При ещё большем добавлении компонента В можно получить в пределе чистый компонент В. Теперь рассмотрим влияние температуры на растворимость компонентов А и В друг в друге. Система состава Х 3, изображённая на диаграмме точкой О (рис. 8.5), при температуре Т 1распадается на две равновесные жидкие фазы а 1и b 1состава Х 1и Х 6. С ростом температуры растворимость компонента В в компоненте А и компонента А в компоненте В возрастает, а составы слоёв приближаются друг к другу. Так при температуре Т 2(фигуративная точка О’) система будет распадаться на фазы состава Х 2и Х 5(точки а 2и b 2). При температуре Т 3состав насыщенного раствора компонента В в компоненте А станет равен общему составу системы Х 3(точка а 3) и при дальнейшем повышении температуры система этого состава станет однофазной. При критической температуре растворения ТК оба жидких раствора тождественны по составу и выше этой температуры наступает неограниченная растворимость. Система становится однофазной при любых концентрациях. Положение критической точки К на диаграмме можно определить по приближённому правилу В. Ф. Алексеева (правило прямолинейного диаметра): если состав системы выражен в массовых процентах, то середины коннод, соединяющих составы равновесных жидких фаз при разных температурах, лежат на одной прямой, пересекающей кривую расслоения в точке, отвечающей критической температуре растворимости (прямая KD на рис. 8.5).Для большинства систем линия KD не перпендикулярна оси состава. По диаграмме растворимости также как и по другим диаграммам состояния можно определить не только состав равновесных жидких фаз, но и их количественное соотношение. В соответствии с правилом рычага для системы, характеризующейся фигуративной точкой О
К системам с верхней критической температурой растворения относятся системы: вода – анилин, вода – фенол, вода – нитробензол. Примерами систем с нижней критической температурой являются системы: вода – триэтиламин, вода – γ-коллоидин, вода – 2,4,6,-триметилпиридин. Иногда взаимная растворимость жидкостей увеличивается как с повышением, так и с понижением температуры (системы одновременно с верхней и нижней критической температурой растворения). Примером таких систем может служить вода – никотин. В некоторых случаях ветви кривой расслоения могут обрываться, а соответствующая критическая температура расслоения не достигается вследствие кристаллизации или кипения одного или обоих компонентов.
|
|||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 583; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.151.211 (0.008 с.) |

 гомогенной области изображают состояние однофазной условно дивариантной системы (К = 2, Ф = 1, Сусл = 2 – 1 + 1 = 2). Фигуративные точки, лежащие внутри гетерогенной области, изображают состояние двухфазной условно моновариантной системы (К = 2, Ф = 2, Сусл = 2 – 2 + 1 = 1).
гомогенной области изображают состояние однофазной условно дивариантной системы (К = 2, Ф = 1, Сусл = 2 – 1 + 1 = 2). Фигуративные точки, лежащие внутри гетерогенной области, изображают состояние двухфазной условно моновариантной системы (К = 2, Ф = 2, Сусл = 2 – 2 + 1 = 1).