
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Поверхностные явления в дисперсных системахСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
ВВЕДЕНИЕ Коллоидная химия в переводе с древнегреческого (κόλλα – клей) – наука о дисперсных системах и поверхностных явлениях. Основоположником этой науки считают Т. Грэма, выполнившего в 60-х годах XIX века первые систематические исследования коллоидных систем (золей). Ему же принадлежит и введение термина «коллоид». Впоследствии коллоидная химия включила в себя результаты, полученные в других областях физики и химии, а уже в конце XIX – начале XX веков сформировалась в самостоятельный раздел химии. Современная коллоидная химия – это физическая химии дисперсных систем и поверхностных явлений на границах раздела фаз. Поверхностные явления играют решающую роль в регулировании прочности строительных материалов, они имеют важнейшее значение в золь-гель-технологии, нанотехнологиях, а также процессах, протекающих при бурении горных пород, нефте- и газодобыче, нефтепереработке. В XXI веке коллоидная химия развивается на стыке физики, химии, биологии (англ. – colloid science означает «коллоидная наука»), поэтому изучение свойств реальных сложных объектов как живой, так и неживой природы невозможно без освоения теоретических положений этой науки и разработанных ею методов исследования дисперсных систем. В данном пособии по курсу "Поверхностные явления и дисперсные системы (коллоидная химия)" рассматриваются методы исследования адсорбции поверхностно-активных веществ (ПАВ) на различных границах раздела, мицеллообразования в растворах ПАВ, свойств пен и эмульсий, седиментации, электрических и реологических свойств дисперсных систем. Способы получения различных дисперсных систем и исследования их свойств студенты осваивают в процессе выполнения лабораторных работ. В каждом разделе практикума перед описанием лабораторной работы имеется теоретическое введение, которое, на наш взгляд, позволит студентам лучше понять закономерности, изучаемые ими в ходе лабораторных работ. В пособии приводится описание современных приборов для выполнения лабораторных работ, предусмотренных в данном курсе. Кроме основных теоретических положений, в каждом разделе данного пособия указываются области практического применения изучаемых явлений в нефтегазовой промышленности. В качестве объектов исследования в лабораторных работах, выполняемых в лабораторном практикуме, студентам предлагается использовать реагенты и вещества, применяемые в нефтепромысловом деле. В конце практикума приводится приложение, которое включает сведения справочного характера, и список учебной литературы, необходимой для более полного усвоения изучаемого курса.
Лабораторная работа №1.1 Ход работы 1. В сосуд 1 наливают пипеткой 10 мл дистиллированной воды, устанавливают капиллярный кончик так, чтобы oн только касался поверхности жидкости. Закрывают краны 5 и 6. Аспиратор 4 должен быть заполнен водой так, как показано на рисунке 1.2. Затем приоткрывают кран 7таким образом, чтобы вода выливалась из аспиратора по каплям. При этом в аспираторе 4 и сосуде 1 создается разрежение. Под действием атмосферного давления через капиллярный кончик стеклянной трубки 2 в сосуд 1 проскакивает пузырек воздуха; в момент отрыва пузырька давление газа в нем достигает максимальной величины, равной 2s/ r 0 (s – поверхностное натяжение жидкости в сосуде 1, r 0 – радиус капиллярного кончика). В процессе образования пузырька воздуха перепад давления, регистрируемый манометром, растет, а в момент отрыва пузырька – резко падает, что позволяет четко фиксировать максимальное значение перепада давления. Степень разрежения в аспираторе 4 и сосуде 1 и, следовательно, скорость проскакивания пузырьков регулируют посредством крана 7 так, чтобы число пузырьков не превышало 1-2 вминуту, иначе результаты измерений могут оказаться неправильными. Показания манометра следует отсчитывать очень тщательно. Для дистиллированной воды измеряют показание манометра D h 0. Для стандартной жидкости делают не менее трех замеров величины перепада давления в коленах манометра и при расчетах по формуле (1.2) используют их среднюю арифметическую величину, которую заносят в таблицу 1.1. Затем таким же образом проводят измерение D hi для растворов ПАВ. Исходный раствор ПАВ известной концентрации выдается лаборантом. 2. Для изучения влияния концентрации ПАВ на величину поверхностного натяжения раствора в сосуд 1 заливают 10 мл исследуемого раствора (с наибольшей концентрацией ПАВ) и измеряют максимальную разность уровней жидкости в манометре D h1 при проскакивании пузырька. 3. Затем из сосуда 1 пипеткой отбирают 5 мл раствора, а к оставшейся порции раствора добавляют 5 мл дистиллированной воды. Получают раствор ПАВ, разбавленный в 2 раза, по сравнению с исходным раствором, и определяют величину D h 2. 4. В дальнейшем повторяют разведение, как описано в п. 3, несколько раз и определяют последовательно: D h 3 - для раствора, разведенного в 4 раза, D h 4 - для раствора, разведенного в 8 раз, D h 5 - в 16 раз и т.д. Полученные величины заносят в таблицу 1.3.
Таблица 1.3 – Результаты измерения зависимости поверхностного натяжения раствора ПАВ (указать какого) от концентрации. Исходная концентрация раствора – (указать единицы измерения)
Обработка результатов эксперимента
Подставляя величины D hi, полученные для растворов ПАВ, в уравнение (1.2), рассчитывают их поверхностное натяжение, внося полученные значения в таблицу 1.2. По полученным результатам строят график зависимости s= f (С). Так как все измерения проводились при постоянной температуре, то полученная кривая носит название изотермы поверхностного натяжения (рисунок 1.3). Экспериментальная кривая s= f (С) и уравнение адсорбции Гиббса
позволяют графическим методом вычислить величину адсорбции Г на границе раздела фаз раствор ПАВ/воздух при различных концентрациях ПАВ в растворе и построить изотерму адсорбции Г = f (С). Для построения изотермы адсорбции к разным точкам изотермы поверхностного натяжения (рисунок 1.3), лучше к точкам наибольшей кривизны, проводят касательные до пересечения с осью ординат (способ проведения касательных приведен в последнем разделе практикума). По построению
Из сопоставления уравнения Гиббса (1.3) с выражением (1.4) получаем
Рисунок 1.3 – Изотерма поверхностного натяжения (а) и изотерма адсорбции (б)
На графике (рисунок 1.3 а) z – отрезок на оси ординат, отсекаемый касательной и прямой, параллельной оси абсцисс. Найдя из графика (рисунок 1.3 а) величину z, выраженную в единицах поверхностного натяжения, для всех выбранных точек по уравнению (1.5) вычисляют соответствующие значения величин адсорбции Г. Полученные значения используют для построения изотермы адсорбции (рисунок 1.3 б). Если кривая Г = f (С) при всех значениях С не имеет точек перегиба, то зависимость адсорбции ПАВ от концентрации раствора можно выразить уравнением Лэнгмюра:
для которого необходимо рассчитать постоянные
Графический способ определения
Введем обозначения
Уравнение (1.13) является уравнением прямой линии в координатах
Зная вычисляют площадь, приходящуюся на одну молекулу в адсорбционном слое (N A – число Авогадро), а из Б. Измерение межфазного натяжения на границе раздела жидкость/жидкость
Цель работы: построить изотерму межфазного натяжения водного раствора ПАВ на границе с жидкостью, несмешивающейся с этим раствором.
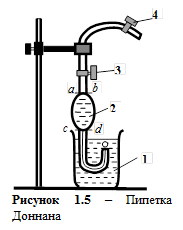
Знание величины межфазного натяжения на границе двух несмешивающихся жидкостей представляет интерес для практики нефтедобывающей промышленности, где имеется постоянный контакт двух таких жидкостей: воды и нефти. Способность воды вытеснять нефть из коллектора, образование и разрушение нефтяных эмульсий и многие другие явления определяются величиной межфазного натяжения. Теоретически величина межфазного натяжения определяется по известному правилу Антонова, согласно которому межфазное натяжение на границе раздела жидкость/жидкость приближенно равно разности между поверхностными натяжениями жидкостей на их границе с воздухом. Для экспериментального определения межфазного натяжения на границе жидкость/жидкость применяют капельную пипетку Доннана (рисунок 1.5). Она представляет собой капилляр 1 диаметром 1-2 мм, нижний конец которого загнут вверх, а верхний переходит в шар 2 емкостью 1-2 мл, снабженный двумя метками. Выше верхней метки имеется кран 3. Сверху на капилляр надевают резиновый шланг с зажимом 4.
Взаимно нерастворимые жидкости А и В наливают в стаканчик (поровну) так, чтобы между ними была четкая граница раздела. Жидкость А, имеющую меньшую плотность и находящуюся сверху, засасывают в шар 2 чуть выше верхней метки a-b и закрывают кран. Пипетку опускают в нижний слой (жидкость B) и регулируют выход капель жидкости А в жидкость В. Образование каждой капли должно протекать довольно медленно (30-40 с), чтобы замедление образования капель в конце опыта после вытекания из пипетки основной массы жидкости не сказывалось на количестве капель. Жидкость А, вытекая в жидкость B, образует N A/B капель, в случае же вытекания того же объема жидкости А в другую жидкость С образуется N A/Cкапель. Чем ниже величина поверхностного натяжения на границе двух несмешивающихся жидкостей, тем большее число капель образуется из одинаковых объемов одной и той же жидкости. Количество образующихся капель связано с величиной межфазного натяжения на границе раздела жидкость/жидкость так, что выполняется соотношение:
где
В качестве жидкости С берут дистиллированную воду, а жидкостью А служит н -октан. В стаканчик наливают примерно до половины воду, а сверху н -октан. Нижний конец пипетки Доннана опускают в стаканчик так, чтобы он находился немного выше границы раздела октан/вода; открывают кран 3 и грушей засасывают октан выше верхней метки, но не выше крана 3. Закрывают кран, а на резиновый шланг надевают зажим и закрывают его до отказа. Затем опускают пипетку так, чтобы нижний конец капилляра находился в воде. Открывают кран, и, постепенно ослабляя зажим, регулируют скорость вытекания капель н -октана в воду так, чтобы можно было считать капли (одна капля за 30-40 с). Отсчет числа капель начинают при достижении н -октаном верхней метки и заканчивают при достижении нижней, то есть подсчитывают число капель N A/C в объеме шарика. Затем в другой стаканчик наливают пипеткой 20 мл 1%-го раствора жидкости B (например, мылонафта), а сверху н -октан (жидкость А) и аналогичным способом определяют число капель н -октана, образующихся при его вытекании в жидкость В (раствор мылонафта) – N A/B. Далее начинают разбавлять мылонафт. Пипеткой извлекают 10 мл раствора мылонафта и добавляют 10 мл дистиллированной воды. Получив раствор, разбавленный в 2 раза, определяют число капель н -октана, образующихся при вытекании его в раствор мылонафта. Раствор мылонафта разбавляют в 4, 8, 16 и 32 раза. Полученные экспериментальные данные заносят в таблицу 1.4. Таблица 1.4 -Зависимость величины межфазного натяжения на границе жидкость/жидкость от концентрации ПАВ (указать, какого). Исходная концентрация раствора ПАВ (указать величину)
Лабораторная работа № 1.2 Приборы и реактивы 1. Тензиометр К6. 2. Дистиллированная вода. 3. Изопропиловый спирт (10%-й раствор в воде). Ход работы. Общий вид тензиометра К6 представлен на рисунке 1.6. Подготовка прибора. Перед каждым измерением круглая шкала (1) должна быть установлена на 0 с помощью маховика (2). Уровень плеча (9), поддерживающего кольцо, должен совпадать с нулевым положением – с белым полем ориентира (7). Если это не было сделано, ноль должен быть выставлен с помощью вращения ручки (8). На плоской поверхности прибор выравнивается с помощью винтов (3) и уровнемера.
Рисунок 1.6 – Тензиометр К6: 1. Шкала в мН/м (мДж/м2) 2. Маховик со шкалой 3. Винты для регулирования уровня 4. Поплавковый уровень 5. Винт, мкм 6. Столик для образцов 7. Ориентир 8. Маховик для установки нуля 9. Балансир 10. и 12. Маховики для фиксации распорок 11. Держатель столика
1. Промыть кольцо Дю-Нуи дистиллированной водой и нагреть его на газовой горелке до красного свечения. (ВАЖНО!!! Не касайтесь кольца руками, оно может деформироваться даже при небольшом усилии; не нагревайте до белого свечения, это приводит к разрушению кольца). Установить кольцо на балансире (9). 2. В чистый стаканчик налить 20 см 3 10%-го раствора изопропилового спирта, поставить его на предметный столик и поднять с помощью маховика (12) до уровня кольца (на 1-2 мм не доходя до кольца). Отрегулировать положение сосуда так, чтобы расстояние от кольца до стенок сосуда было одинаково во всех точках, и затянуть винт (10). С помощью маховика (5) поднять столик с сосудом так, чтобы кольцо коснулось жидкости. (ВАЖНО!!! Затягивание маховика (5) может привести к срыву резьбы, что, в свою очередь, может привести к наклону столика). Подождать пока жидкость успокоится. 3. Вращением маховика (2) по часовой стрелке увеличить натяжение нити, то есть увеличить усилие, прикладываемое к кольцу. Это приведет к поднятию плеча (9) и выходу его из белого поля ориентира (7). Затем уровень плеча (9) опять возвратить в нулевую позицию за счет понижения уровня жидкости (при помощи вращения винта 5 влево). Эти чередующиеся операции по увеличению нагрузки и понижению уровня жидкости повторять до тех пор, пока кольцо не оторвется от поверхности жидкости, т.е. до того момента, когда приложенная к кольцу нагрузка превысит силы поверхностного натяжения. Записать показание тензиометра. 4. Затем разбавить 10%-й раствор изопропилового спирта в 2, 4, 8, 16, 32 раза и определить значения поверхностного натяжения (повторить пункты 1-3). Полученные результаты записать в таблицу 1.5. Таблица 1.5 – Результаты измерения поверхностного натяжения растворов изопропилового спирта различной концентрации методом Дю-Нуи. Концентрация исходного раствора (раствор 1) – 10%
Лабораторная работа № 1.3 Приборы и реактивы 1. Тензиометр К6 2. Дистиллированная вода 3. н -октан 4. Мылонафт (0,5% раствор)
Ход работы. Общий вид тензиометра К6 представлен на рисунке 1.6. Подготовка прибора. Перед каждым измерением круглую шкалу (1) установить на 0 с помощью маховика (2). Уровень плеча (9), поддерживающего кольцо, должен совпадать с нулевым положением, т.е. с белым полем ориентира (7). Если это не было сделано, ноль выставить вращением ручки (8). На плоской поверхности прибор выравнять с помощью винтов (3) и уровнемера. 1. Промыть кольцо Дю-Нуи дистиллированной водой и нагреть его на газовой горелке до красного свечения. (ВАЖНО!!! Не касайтесь кольца руками, оно может деформироваться даже при небольшом усилии; не нагревайте до белого свечения, это приводит к разрушению кольца). Установить кольцо на балансире (9). 2. В чистый стаканчик налить 20 см 3 мылонафта (0,5% раствор), поставить его на предметный столик и поднять с помощью маховика (12) до уровня кольца (на 1-2 мм не доходя до кольца). Отрегулировать сосуд так, чтобы расстояние от кольца до стенок сосуда было одинаково во всех точках, и затянуть винт (10). С помощью маховика (5) поднимать столик с сосудом до тех пор, пока кольцо не коснется жидкости. (ВАЖНО!!! Затягивание маховика (5) может привести к срыву резьбы, что, в свою очередь, может привести к наклону столика). 3. Аккуратно долить в сосуд н -октан (≈ 10 см 3), подождать пока жидкость успокоится. 4. Вращая маховик (2) по часовой стрелке, увеличивать натяжение нити, т.е. увеличивать усилие, прикладываемое к кольцу. Это приведет к поднятию плеча (9) и выходу его из белого поля ориентира (7). Затем уровень плеча (9) опять возвратить в нулевую позицию за счет понижения уровня жидкости (при помощи вращения винта 5 влево). Эти чередующиеся операции по увеличению нагрузки и снижению уровня жидкости повторять до тех пор, пока кольцо не оторвется от поверхности жидкости. Это означает, что приложенная к кольцу нагрузка превысила силы межфазного натяжения. Записать показание по шкале тензиометра. 5. Затем разбавить 0,5% раствор мылонафта в 2, 4, 8, 16, 32 раза и определить значения межфазного натяжения (повторить пункты 1-4). Полученные результаты записать в таблицу 1.6.
Таблица 1.6 – Результаты измерения поверхностного натяжения растворов мылонафта. Концентрация исходного раствора (раствор 1) – 0,5%
Обработка результатов Обработка экспериментальных результатов проводится так же, как и в лабораторной работе №1 (стр.15). Лабораторная работа № 1.4 Приборы и реактивы 1. Тензиометр К20 2. Дистиллированная вода 3. Изопропиловый спирт (10%-й раствор) Ход работы. Общий вид тензиометра К20 представлен на рисунке 1.7.
Рисунок 1.7 - Тензиометр К20
1. Опустить платформу для образца вниз. 2. Промыть кольцо Дю-Нуи дистиллированной водой и нагреть его на газовой горелке до красного свечения. (ВАЖНО!!! Не касайтесь кольца руками, оно может деформироваться даже при небольшом усилии; не нагревайте до белого свечения, это приводит к разрушению кольца). Закрепить очищенное кольцо на крючке датчика силы. 3. Налить в чистый сосуд для образцов SV20 20 см 3 изопропилового спирта (10%-й раствор) и поместить его на платформу. 4. В основном меню выбрать метод Дю-Нуи («Du Nouy Ring»). 5. Установить разницу между плотностями воздуха и образца 1 (Density Diff) 6. Поднять столик для образца вверх так, чтобы кольцо оказалось точно над поверхностью жидкости (смотрите зеркальное отражение). Перед следующим шагом подождать, чтобы кольцо не двигалось, а поверхность жидкости успокоилась. 7. Нажать «Tare» для обнуления веса кольца на воздухе. Подождать, пока в правом верхнем углу дисплея вес не станет равным 0,0000 г. 8. Поднять столик так, чтобы кольцо погрузилось в жидкость приблизительно на 1 мм. 9. Нажать «Start» для измерения поверхностного натяжения жидкости. 10. Затем разбавить 10%-й раствор изопропилового спирта в 2, 4, 8, 16, 32 раза и определить значения поверхностного натяжения (повторить пункты 1-9). Полученные результаты записать в таблицу 1.7.
Таблица 1. 7 – Результаты измерения поверхностного натяжения растворов изопропилового спирта. Концентрация исходного раствора (раствор 1) – 10%
Лабораторная работа № 1.5 Приборы и реактивы 1. Тензиометр К20 2. Дистиллированная вода 3. н -октан 4. Мылонафт (0,125% раствор) Ход работы. Общий вид тензиометра К20 представлен на рисунке 1.7. 1. Опустить платформу для образца вниз. 2. Промыть кольцо Дю-Нуи дистиллированной водой и нагреть его на газовой горелке до красного свечения. (ВАЖНО!!! Не касайтесь кольца руками, оно может деформироваться даже при небольшом усилии; не нагревайте до белого свечения - это приводит к разрушению кольца). Закрепить очищенное кольцо на крючке датчика силы. 3. Налить в чистый сосуд для образцов SV20 н -октан и поместить сосуд на платформу. 4. В основном меню выбрать метод Дю-Нуи («Du Nouy Ring»). 5. Установить разницу между плотностями жидкости 0,295 (Density Diff) 6. Поднять столик с образцом вверх так, чтобы кольцо погрузилось в легкую фазу. Перед следующим шагом подождать, чтобы кольцо не двигалось, а поверхность жидкости успокоилась. 7. Нажать «Tare» для обнуления веса кольца в легкой фазе. Подождать, пока в правом верхнем углу дисплея вес не станет равным 0,0000 г. 8. Опустить платформу для образца и удалить сосуд с легкой фазой. Снять кольцо с крючка и очистить его (включая прокаливание до красного свечения). Затем вновь закрепить его на крючке. 9. Налить 20 см 3 0,125%-го раствора мылонафта в чистый сосуд и поместить его на платформу. 10. Поднять столик вверх так, чтобы кольцо погрузилось на 2-3 мм в тяжелую фазу. Подождать, чтобы кольцо не двигалось, а поверхность жидкости успокоилась. 11. Далее аккуратно налить легкую фазу поверх тяжелой. Уровень заполнения зависит от глубины погружения кольца во время предыдущей процедуры обнуления. 12. Нажать «Start» для измерения межфазного натяжения на границе жидкость/жидкость. 13. Затем разбавить 0,125%-й раствор мылонафта в 2, 4, 8, 16, 32 раза и определить значения поверхностного натяжения (повторить пункты 1-12). Полученные результаты записать в таблицу 1.8.
Таблица 1.8 – Результаты измерения поверхностного натяжения растворов мылонафта. Концентрация исходного раствора (раствор 1) – 0,125%
Лабораторная работа № 1.6 Приборы и реактивы 1. Тензиометр К20 2. Дистиллированная вода 3. Изопропиловый спирт (10% раствор) Ход работы. Общий вид тензиометра К20 представлен на рисунке 1.7. 1. Опустить платформу для образца вниз. 2. Промыть пластину Вильгельми дистиллированной водой и нагреть ее на газовой горелке до красного свечения. (ВАЖНО!!! Не касайтесь кольца руками; не нагревайте до белого свечения, это приводит к разрушению пластины). Закрепить очищенную пластину на крючке датчика силы. 3. Налить в чистый сосуд для образцов SV20 20 см 3 изопропилового спирта (10%-й раствор) и поместить последний на платформу. 4. В основном меню выбрать метод Вильгельми («Wilhelmy Plate»). 5. Поднять столик для образца вверх так, чтобы пластина оказалась точно над поверхностью жидкости (смотрите зеркальное отражение). Перед следующим шагом подождать, чтобы пластина не двигалась, а поверхность жидкости успокоилась. 6. Нажать «Tare» для обнуления веса пластины на воздухе. Подождать, пока в правом верхнем углу дисплея вес не станет равным 0,0000 г. 7. Нажать кнопку «Surface detect». На дисплее появиться надпись «Surface detection is on progress …». 8. Повернуть вручную внутреннее кольцо регулятора высоты так, чтобы метка совпала с нулем на шкале. 9. С помощью вращения ручки регулятора высоты поднять столик, пока пластина не будет погружена в жидкость приблизительно на 3 мм (ориентируйтесь по шкале). 10. С помощью привода вернуть столик в нулевое положение (=определенная поверхность). 11. Нажать «Start» для измерения поверхностного натяжения жидкости. 12. Затем разбавить 10% раствор изопропилового спирта в 2, 4, 8, 16, 32 раза и определить значения поверхностного натяжения (повторить пункты 1-11). Полученные результаты записать в таблицу 1.9.
Таблица 1.9 – Результаты измерения поверхностного натяжения растворов изопропилового спирта. Концентрация исходного раствора (раствор 1) – 10%
Лабораторная работа № 1.7 Приборы и реактивы 1. Тензиометр К20. 2. Дистиллированная вода 3. н -октан. 4. Мылонафт (0,125% раствор). Ход работы. Общий вид тензиометра К20 представлен на рисунке 1.7. 1. Опустить платформу для образца вниз. 2. Промыть пластину Вильгельми дистиллированной водой и нагреть ее на газовой горелке до красного свечения (ВАЖНО!!! Не касайтесь кольца руками; не нагревайте до белого свечения, это приводит к разрушению пластины). Закрепить очищенную пластину на крючке датчика силы. 3. Налить в чистый сосуд для образцов SV20 н -октан и поместить его на платформу. 4. В основном меню выберать метод Вильгельми («Wilhelmy Plate»). 5. Поднять столик для образца вверх так, чтобы пластина полностью погрузилась в легкую фазу. Перед следующим шагом подождать, чтобы пластина не двигалась, а поверхность жидкости успокоилась. 6. Нажать «Tare» для обнуления веса пластины в легкой фазе. Подождать, пока в правом верхнем углу дисплея вес не станет равным 0,0000 г. 7. Опустить платформу для образца и удалить легкую фазу. Снять пластину с крючка и очистить ее (включая прокаливание до красного свечения). Затем вновь закрепить ее на крючке. 8. Налить в чистый сосуд 20 см 3 мылонафта (0,125%-й раствор) и поместить его на платформу. 9. Поднять столик вверх так, чтобы пластина была точно над поверхностью тяжелой фазы. Подождать, чтобы пластина не двигалась, а поверхность жидкости успокоилась. 10. Нажать кнопку «Surface detect». На дисплее появиться надпись «Surface detection is on progress …». 11. Повернуть вручную внутреннее кольцо регулятора высоты так, чтобы метка совпала с нулем на шкале. 12. С помощью вращения ручки регулятора высоты поднять столик так, чтобы пластина погрузилась в жидкость приблизительно на 3 мм (ориентируйтесь по шкале). 13. Далее аккуратно налить н -октан поверх тяжелой фазы. Уровень заполнения зависит от глубины погружения пластины во время предыдущей процедуры обнуления. 14. С помощью привода вернуть столик в нулевое положение (=определенная поверхность). 15. Нажать «Start» для измерения межфазного натяжения на границе между жидкостями. 16. Затем разбавить 0,125%-й раствор мылонафта в 2, 4, 8, 16, 32 раза и определить значения межфазного натяжения (повторить пункты 1-15). Полученные результаты записать в таблицу 1.10.
Таблица 1.10 - Результаты измерения поверхностного натяжения растворов мылонафта. Концентрация исходного раствора (раствор 1) – 0,125%
МИЦЕЛЛООБРАЗОВАНИЕ В РАСТВОРАХ ПАВ Лиофильные коллоидные системы. К лиофильным коллоидным системам относят ультрамикрогетерогенные термодинамически устойчивые системы Их существование возможно только при достаточно малых значениях межфазного натяжения на границе раздела фаз, когда рост поверхностной энергии, обусловленной увеличением поверхности раздела при диспергировании, компенсируется приростом энтропии системы. Образование лиофильных коллоидных систем происходит либо вблизи критической температуры смешения фаз, либо в растворах мицеллообразующих поверхностно-активных веществ, а также в некоторых системах с дисперсной фазой, образованной высокомолекулярными веществами, в том числе природными. Условия образования лиофильных коллоидных систем. Термодинамическое рассмотрение процесса образования дисперсных систем при диспергировании макроскопических фаз, проведенное П.А. Ребиндером и Е.Д. Щукиным, основано на сопоставлении поверхностной энергии образующихся при диспергировании частиц D FS и роста энтропии системы D S. Пусть при диспергиро D FS = pd2 n 1s12 (2.1) где s12 – удельная свободная поверхностная энергия (поверхностное натяжение) границы раздела фаз 1 и 2 (вообще говоря, s12 может зависеть от размера частиц дисперсной фазы). В простейшем случае несжимаемой дисперсной фазы n 1
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 485; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.145.41 (0.02 с.) |

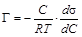 (1.8)
(1.8)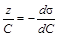 , откуда
, откуда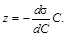 (1.9)
(1.9)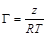 . (1.10)
. (1.10)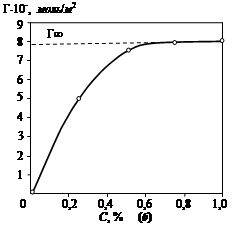

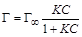 , (1.11)
, (1.11) (предельная адсорбция) и K (характеризует сродство адсорбируемого вещества к поверхности адсорбента).
(предельная адсорбция) и K (характеризует сродство адсорбируемого вещества к поверхности адсорбента).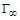 и K можно рассчитать, подставив известные значения Г и С в уравнение Лэнгмюра и решив систему двух уравнений с двумя неизвестными, или определить графически.
и K можно рассчитать, подставив известные значения Г и С в уравнение Лэнгмюра и решив систему двух уравнений с двумя неизвестными, или определить графически.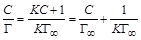 . (1.12)
. (1.12)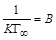 ,
,  , тогда уравнение (1.12) можно представить в виде:
, тогда уравнение (1.12) можно представить в виде: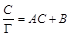 . (1.13)
. (1.13) – С.
– С. Откладывая по оси абсцисс известные концентраций растворов, a пооси ординат – соответствующие им вычисленные значения С /Г, получают прямую, из тангенса угла наклона которой вычисляют величину
Откладывая по оси абсцисс известные концентраций растворов, a пооси ординат – соответствующие им вычисленные значения С /Г, получают прямую, из тангенса угла наклона которой вычисляют величину 
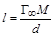 .
. Ход выполнения работы
Ход выполнения работы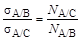 , (1.14)
, (1.14) и
и  - величина межфазного натяжения жидкости А на границе раздела с жидкостями B и С, соответственно. Если межфазное натяжение на границе раздела жидкостей А и С
- величина межфазного натяжения жидкости А на границе раздела с жидкостями B и С, соответственно. Если межфазное натяжение на границе раздела жидкостей А и С 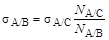 . (1.15)
. (1.15)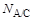
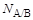


 вании некоторого объема V 1фазы 1 образуется n 1 сферических частиц дисперсной фазы с диаметром d. Тогда увеличение поверхностной энергии системы равно:
вании некоторого объема V 1фазы 1 образуется n 1 сферических частиц дисперсной фазы с диаметром d. Тогда увеличение поверхностной энергии системы равно:


