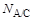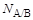Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Изучение поверхностного натяжения растворов на границах раздела газ/жидкость и жидкость/жидкостьСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
А. Измерение поверхностного натяжения раствора ПАВ на границе с воздухом.
В работе используется простой и достаточно точный метод определения величины поверхностного натяжения на границе газ/жидкость – метод максимального давления проскакивания пузырька газа через капилляр, касающийся поверхности жидкости. Метод был предложен П.А. Ребиндером. Схема прибора, основанного на этом методе, представлена на рисунке 1.2. В сосуд 1 заливают исследуемую жидкость. Через пробку сосуда 1 проходит стеклянная трубка 2 с капиллярным кончиком. Для создания разрежения в сосуде 1 используют водный аспиратор 4. Величина разрежения измеряется по разности уровней в жидкостном манометре 3, в котором манометрической жидкостью служит толуол. Этот прибор позволяет определять поверхностное натяжение на границе раздела жидкость/газ с точностью 0,2¸0,5%. Поверхностное натяжение на границе раздела жидкость/газ прямо пропорционально давлению, соответствующему медленному и равномерному проскакиванию пузырьков газа (воздуха) через капиллярный кончик, который должен лишь касаться поверхности исследуемой жидкости. Глубину погружения капилляра устанавливают вертикальным перемещением капиллярной трубки. Равномерное проскакивание пузырьков воздуха достигается регулированием с помощью крана 7 скорости истечения воды из аспиратора 4. Максимальное давление проскакивания пузырька воздуха зависит от радиуса капилляра. Для того чтобы не определять радиус капилляра, измерения проводят относительно стандартной (эталонной) жидкости, для которой известно точное значение поверхностного натяжения при температуре опыта. Величину поверхностного натяжения исследуемого раствора sвычисляют по уравнению:
где i =1, 2,… n (i – номер исследуемого раствора); D h 0 – разность уровней толуола в коленах манометра для стандартной жидкости; D hi – разность уровней толуола в коленах манометра для i -го исследуемого раствора.
В качестве стандартной жидкости берут дистиллированную воду, точное значение поверхностного натяжения которой известно для широкого диапазона температур. При температуре 20°С для воды s0= 72,75 мДж / м 2 (72,75 эрг / см 2). Таким образом, работа сводится к определению показаний манометра (D h 0)для стандартной жидкости (дистиллированной воды) и исследуемого раствора (D hi). Ход работы 1. В сосуд 1 наливают пипеткой 10 мл дистиллированной воды, устанавливают капиллярный кончик так, чтобы oн только касался поверхности жидкости. Закрывают краны 5 и 6. Аспиратор 4 должен быть заполнен водой так, как показано на рисунке 1.2. Затем приоткрывают кран 7таким образом, чтобы вода выливалась из аспиратора по каплям. При этом в аспираторе 4 и сосуде 1 создается разрежение. Под действием атмосферного давления через капиллярный кончик стеклянной трубки 2 в сосуд 1 проскакивает пузырек воздуха; в момент отрыва пузырька давление газа в нем достигает максимальной величины, равной 2s/ r 0 (s – поверхностное натяжение жидкости в сосуде 1, r 0 – радиус капиллярного кончика). В процессе образования пузырька воздуха перепад давления, регистрируемый манометром, растет, а в момент отрыва пузырька – резко падает, что позволяет четко фиксировать максимальное значение перепада давления. Степень разрежения в аспираторе 4 и сосуде 1 и, следовательно, скорость проскакивания пузырьков регулируют посредством крана 7 так, чтобы число пузырьков не превышало 1-2 вминуту, иначе результаты измерений могут оказаться неправильными. Показания манометра следует отсчитывать очень тщательно. Для дистиллированной воды измеряют показание манометра D h 0. Для стандартной жидкости делают не менее трех замеров величины перепада давления в коленах манометра и при расчетах по формуле (1.2) используют их среднюю арифметическую величину, которую заносят в таблицу 1.1. Затем таким же образом проводят измерение D hi для растворов ПАВ. Исходный раствор ПАВ известной концентрации выдается лаборантом. 2. Для изучения влияния концентрации ПАВ на величину поверхностного натяжения раствора в сосуд 1 заливают 10 мл исследуемого раствора (с наибольшей концентрацией ПАВ) и измеряют максимальную разность уровней жидкости в манометре D h1 при проскакивании пузырька.
3. Затем из сосуда 1 пипеткой отбирают 5 мл раствора, а к оставшейся порции раствора добавляют 5 мл дистиллированной воды. Получают раствор ПАВ, разбавленный в 2 раза, по сравнению с исходным раствором, и определяют величину D h 2. 4. В дальнейшем повторяют разведение, как описано в п. 3, несколько раз и определяют последовательно: D h 3 - для раствора, разведенного в 4 раза, D h 4 - для раствора, разведенного в 8 раз, D h 5 - в 16 раз и т.д. Полученные величины заносят в таблицу 1.3.
Таблица 1.3 – Результаты измерения зависимости поверхностного натяжения раствора ПАВ (указать какого) от концентрации. Исходная концентрация раствора – (указать единицы измерения)
Обработка результатов эксперимента
Подставляя величины D hi, полученные для растворов ПАВ, в уравнение (1.2), рассчитывают их поверхностное натяжение, внося полученные значения в таблицу 1.2. По полученным результатам строят график зависимости s= f (С). Так как все измерения проводились при постоянной температуре, то полученная кривая носит название изотермы поверхностного натяжения (рисунок 1.3). Экспериментальная кривая s= f (С) и уравнение адсорбции Гиббса
позволяют графическим методом вычислить величину адсорбции Г на границе раздела фаз раствор ПАВ/воздух при различных концентрациях ПАВ в растворе и построить изотерму адсорбции Г = f (С). Для построения изотермы адсорбции к разным точкам изотермы поверхностного натяжения (рисунок 1.3), лучше к точкам наибольшей кривизны, проводят касательные до пересечения с осью ординат (способ проведения касательных приведен в последнем разделе практикума). По построению
Из сопоставления уравнения Гиббса (1.3) с выражением (1.4) получаем
Рисунок 1.3 – Изотерма поверхностного натяжения (а) и изотерма адсорбции (б)
На графике (рисунок 1.3 а) z – отрезок на оси ординат, отсекаемый касательной и прямой, параллельной оси абсцисс. Найдя из графика (рисунок 1.3 а) величину z, выраженную в единицах поверхностного натяжения, для всех выбранных точек по уравнению (1.5) вычисляют соответствующие значения величин адсорбции Г. Полученные значения используют для построения изотермы адсорбции (рисунок 1.3 б). Если кривая Г = f (С) при всех значениях С не имеет точек перегиба, то зависимость адсорбции ПАВ от концентрации раствора можно выразить уравнением Лэнгмюра:
для которого необходимо рассчитать постоянные
Графический способ определения
Введем обозначения
Уравнение (1.13) является уравнением прямой линии в координатах
Зная вычисляют площадь, приходящуюся на одну молекулу в адсорбционном слое (N A – число Авогадро), а из Б. Измерение межфазного натяжения на границе раздела жидкость/жидкость
Цель работы: построить изотерму межфазного натяжения водного раствора ПАВ на границе с жидкостью, несмешивающейся с этим раствором.
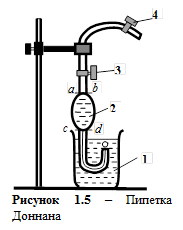
Знание величины межфазного натяжения на границе двух несмешивающихся жидкостей представляет интерес для практики нефтедобывающей промышленности, где имеется постоянный контакт двух таких жидкостей: воды и нефти. Способность воды вытеснять нефть из коллектора, образование и разрушение нефтяных эмульсий и многие другие явления определяются величиной межфазного натяжения. Теоретически величина межфазного натяжения определяется по известному правилу Антонова, согласно которому межфазное натяжение на границе раздела жидкость/жидкость приближенно равно разности между поверхностными натяжениями жидкостей на их границе с воздухом. Для экспериментального определения межфазного натяжения на границе жидкость/жидкость применяют капельную пипетку Доннана (рисунок 1.5). Она представляет собой капилляр 1 диаметром 1-2 мм, нижний конец которого загнут вверх, а верхний переходит в шар 2 емкостью 1-2 мл, снабженный двумя метками. Выше верхней метки имеется кран 3. Сверху на капилляр надевают резиновый шланг с зажимом 4.
Взаимно нерастворимые жидкости А и В наливают в стаканчик (поровну) так, чтобы между ними была четкая граница раздела. Жидкость А, имеющую меньшую плотность и находящуюся сверху, засасывают в шар 2 чуть выше верхней метки a-b и закрывают кран. Пипетку опускают в нижний слой (жидкость B) и регулируют выход капель жидкости А в жидкость В. Образование каждой капли должно протекать довольно медленно (30-40 с), чтобы замедление образования капель в конце опыта после вытекания из пипетки основной массы жидкости не сказывалось на количестве капель.
Жидкость А, вытекая в жидкость B, образует N A/B капель, в случае же вытекания того же объема жидкости А в другую жидкость С образуется N A/Cкапель. Чем ниже величина поверхностного натяжения на границе двух несмешивающихся жидкостей, тем большее число капель образуется из одинаковых объемов одной и той же жидкости. Количество образующихся капель связано с величиной межфазного натяжения на границе раздела жидкость/жидкость так, что выполняется соотношение:
где
В качестве жидкости С берут дистиллированную воду, а жидкостью А служит н -октан. В стаканчик наливают примерно до половины воду, а сверху н -октан. Нижний конец пипетки Доннана опускают в стаканчик так, чтобы он находился немного выше границы раздела октан/вода; открывают кран 3 и грушей засасывают октан выше верхней метки, но не выше крана 3. Закрывают кран, а на резиновый шланг надевают зажим и закрывают его до отказа. Затем опускают пипетку так, чтобы нижний конец капилляра находился в воде. Открывают кран, и, постепенно ослабляя зажим, регулируют скорость вытекания капель н -октана в воду так, чтобы можно было считать капли (одна капля за 30-40 с). Отсчет числа капель начинают при достижении н -октаном верхней метки и заканчивают при достижении нижней, то есть подсчитывают число капель N A/C в объеме шарика. Затем в другой стаканчик наливают пипеткой 20 мл 1%-го раствора жидкости B (например, мылонафта), а сверху н -октан (жидкость А) и аналогичным способом определяют число капель н -октана, образующихся при его вытекании в жидкость В (раствор мылонафта) – N A/B. Далее начинают разбавлять мылонафт. Пипеткой извлекают 10 мл раствора мылонафта и добавляют 10 мл дистиллированной воды. Получив раствор, разбавленный в 2 раза, определяют число капель н -октана, образующихся при вытекании его в раствор мылонафта. Раствор мылонафта разбавляют в 4, 8, 16 и 32 раза. Полученные экспериментальные данные заносят в таблицу 1.4. Таблица 1.4 -Зависимость величины межфазного натяжения на границе жидкость/жидкость от концентрации ПАВ (указать, какого). Исходная концентрация раствора ПАВ (указать величину)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 693; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.12.185 (0.011 с.) |

 Цель работы: построить изотерму поверхностного натяжения водного раствора ПАВ и изотерму адсорбции ПАВ на границе раздела раствор ПАВ/воздух. Определить параметры адсорбционного слоя (предельную адсорбцию Γ¥, толщину адсорбционного слоя l и площадь S 0, приходящуюся на 1 молекулу ПАВ в адсорбционном слое).
Цель работы: построить изотерму поверхностного натяжения водного раствора ПАВ и изотерму адсорбции ПАВ на границе раздела раствор ПАВ/воздух. Определить параметры адсорбционного слоя (предельную адсорбцию Γ¥, толщину адсорбционного слоя l и площадь S 0, приходящуюся на 1 молекулу ПАВ в адсорбционном слое).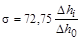 , (1.7)
, (1.7)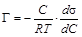 (1.8)
(1.8)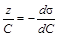 , откуда
, откуда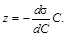 (1.9)
(1.9)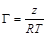 . (1.10)
. (1.10)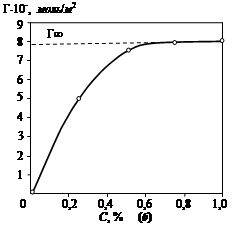

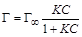 , (1.11)
, (1.11) (предельная адсорбция) и K (характеризует сродство адсорбируемого вещества к поверхности адсорбента).
(предельная адсорбция) и K (характеризует сродство адсорбируемого вещества к поверхности адсорбента).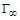 и K можно рассчитать, подставив известные значения Г и С в уравнение Лэнгмюра и решив систему двух уравнений с двумя неизвестными, или определить графически.
и K можно рассчитать, подставив известные значения Г и С в уравнение Лэнгмюра и решив систему двух уравнений с двумя неизвестными, или определить графически.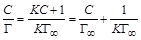 . (1.12)
. (1.12)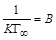 ,
,  , тогда уравнение (1.12) можно представить в виде:
, тогда уравнение (1.12) можно представить в виде: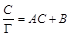 . (1.13)
. (1.13) – С.
– С. Откладывая по оси абсцисс известные концентраций растворов, a пооси ординат – соответствующие им вычисленные значения С /Г, получают прямую, из тангенса угла наклона которой вычисляют величину
Откладывая по оси абсцисс известные концентраций растворов, a пооси ординат – соответствующие им вычисленные значения С /Г, получают прямую, из тангенса угла наклона которой вычисляют величину 
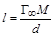 .
. Ход выполнения работы
Ход выполнения работы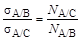 , (1.14)
, (1.14) и
и  - величина межфазного натяжения жидкости А на границе раздела с жидкостями B и С, соответственно. Если межфазное натяжение на границе раздела жидкостей А и С
- величина межфазного натяжения жидкости А на границе раздела с жидкостями B и С, соответственно. Если межфазное натяжение на границе раздела жидкостей А и С 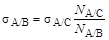 . (1.15)
. (1.15)