
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Исследование влияния строения молекул пав на их поверхностную активность. Определение параметров адсорбционного слояСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Цель работы: получение изотерм поверхностного натяжения и адсорбции для водных растворов алифатических спиртов; определение соотношения поверхностных активностей ПАВ в их гомологическом ряду; расчет толщины адсорбционного слоя и площади, занимаемой одной молекулой ПАВ в насыщенном адсорбционном слое.
Поверхностно-активные свойства ПАВ зависят от числа метиленовых групп в углеводородной цепи, природы и содержания полярных групп. Адсорбционная способность молекул ПАВ характеризуется поверхностной активностью g. Поверхностную активность можно найти графически по экспериментальной изотерме поверхностного натяжения s= f (C). На рисунке 8.2 представлены изотермы поверхностного натяжения для соседних членов гомологического ряда ПАВ. Приведенные кривые показывают, что с удлинением углеводородного радикала гомолога поверхностная активность g повышается. В 1978 г. Дюкло и Траубе установили эмпирическое правило, согласно которому поверхностная активность и адсорбция жирных кислот, спиртов, аминов и других веществ в гомологических рядах на границе раствор/воздух возрастает в 3,2 раза при увеличении длины углеводородной цепи на каждую СН2-группу: gn +1/ gn =const» 3,2, где n – число метиленовых групп в углеводородном радикале. Однако это правило справедливо только для сильно разбавленных растворов и исключает три первых члена гомологического ряда.
Рисунок 8.2 – Изотермы поверхностного натяжения растворов ПАВ с углеводородным радикалом, содержащим n, (n +1) и (п +2) метиленовых групп
Это правило выполняется лишь для водных растворов ПАВ. Для растворов ПАВ в неполярных растворителях поверхностная активность при увеличении длины углеводородного радикала, наоборот, уменьшается (обращение правила Дюкло-Траубе). Лэнгмюр дал теоретическое обоснование эмпирическому правилу Дюкло-Траубе. Адсорбция и ориентация молекул ПАВ на границе раздела фаз жидкость/воздух являются самопроизвольно протекающими процессами, сопровождающимися уменьшением энергии Гиббса (D G). При введении ПАВ в полярную среду (воду) гидрофобные углеводородные цепи ПАВ раздвигают молекулы воды, встраиваясь в ее структуру, для этого требуется совершение работы против сил межмолекулярного взаимодействия. Обратный процесс – выход молекул ПАВ на межфазную поверхность (с ориентацией углеводородных цепей в сторону неполярной среды) идет самопроизвольно с уменьшением D G системы, что соответствует работе адсорбции W адс.. Работа адсорбции зависит от длины углеводородной цепи ПАВ и в расчете на 1 моль вещества, углеводородные части молекул которого состоят из n СН2-звеньев, может быть рассчитана по формуле:
где w – работа адсорбции, отнесенная к одной СН2-группе. Применительно к адсорбции из разбавленных растворов на основе уравнения Генри (G= K Г C, G – гиббсовская адсорбция, K Г – константа Генри) и уравнения изотермы Вант-Гоффа (D G = – RT ln K G) можно получить следующее выражение для константы Генри
Уравнение (8.3) показывает, что значение константы К Gс увеличением числа СН2-групп в молекуле ПАВ растет в кратное число раз. Для двух соседних членов гомологического ряда ПАВ при условии постоянства концентрации и температуры можно записать:
Отсюда
Полученное выражение для соотношения Коэффициент b равен 3,2 только при 20 °С. При повышении температуры его значение уменьшается, приближаясь в пределе к единице. Уменьшение константы b обусловлено возрастанием десорбции молекул ПАВ при повышении температуры и снижением различия между поверхностной активностью гомологов. Измерение поверхностной активности и адсорбции ПАВ позволяет определить параметры адсорбционных слоев: площадь, занимаемую одной молекулой, s0 и толщину поверхностного слоя δ. Величины S o и δ рассчитывают по экспериментально найденным значениям предельной адсорбции А ¥. Предельную адсорбцию G¥определяют по изотермам адсорбции Γ = f (C), для построения которых вычисляют несколько значений d σ /dС. Для веществ с ярко выраженными поверхностно-активными свойствами величину адсорбции А можно принять равной гиббсовской адсорбции Г (в молях на 1 м 2 поверхности). Площадь s 0, приходящуюся на одну молекулу в насыщенном адсорбционном слое, вычисляют по уравнению
Толщину адсорбционных слоев d рассчитывают по формуле
где М – молекулярная масса ПАВ; ρ – плотность ПАВ. Сопоставление вычисленных значений толщины слоя δ с длиной ориентированных молекул дает возможность оценить тип поверхностной пленки, определить ориентацию молекул ПАВ в адсорбционном слое. Ход работы. Для проведения работы необходимы: Установка для измерения поверхностного натяжения. Бюретки. Конические колбы емкостью 50 мл. Фильтровальная бумага. 0,2 М растворы пропилового, бутилового и пентилового спиртов. Готовят 5 водных растворов пропилового, бутилового и пентилового спиртов разбавлением исходных растворов водой в соответствии с данными:
С помощью установки, указанной преподавателем, определяют поверхностное натяжение приготовленных растворов (методику измерений см. в работе 1). Измерение поверхностного натяжения следует проводить быстро, так как может происходить испарение спирта с поверхности раздела фаз. По полученным данным для каждого спирта строят изотермы поверхностного натяжения и по ним находят поверхностную активность g = - (d σ /dC)C® 0, а также значения d σ /dC в нескольких точках изотерм. Пo уравнению (8.1) вычисляют значения Г и строят изотермы адсорбции Г = f (С). Данные расчета g, d σ /dС и Г для исследуемых спиртов записывают в таблицу (см. табл.8. 2). Таблица 8.2 – Экспериментальные и расчетные данные по адсорбции алифатических спиртов
Затем рассчитывают соотношение поверхностных активностей для соседних гомологов:
Лабораторная работа № 8.3
|
||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 863; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.01 с.) |


 ,
, или
или  (8.3)
(8.3) и
и  . ( 8.4)
. ( 8.4) . (8.5)
. (8.5)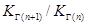 отражает правило Дюкло -Траубе.
отражает правило Дюкло -Траубе. .
. ,
,

 и
и  .
.


