
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дисперсные системы: понятие и классификация.Содержание книги
Поиск на нашем сайте
Жидкости – это вещества в конденсированном агрегатном состоянии, промежуточном между твердым и газообразным. Эти материалы не имеют своей формы, но обладают свойством принимать форму емкости, в которой находятся. Жидкие материалы существуют при давлениях, больших давления в тройной точке на диаграмме состояний, и в интервале между температурой кристаллизации и температурой кипения. Различия между жидкими и газообразными состояниями вещества исчезают в критической точке. Жидкости, подобно твердым веществам, обладают сжимаемостью и большой плотностью и в то же время, подобно газам, не обладают упругостью и текучестью. В жидкостях среднее значение расстояния между молекулами сопоставимо с размерами самих молекул (~0,1 нм = 10-10 м), а силы межмолекулярного взаимодействия значительны. Этим объясняется особое свойство жидкости – поверхностное натяжение – сила, действующая в плоскости, касательной к поверхности жидкости. Ее величина определяется отношением усилия к единице длины контура, ограничивающего эту поверхность. В отличие от «дальнего порядка» в расположении частиц твердых веществ, т.е. статистической упорядоченности взаимного расположения далеко находящихся друг от друга частиц, в жидкостях имеет место «ближний порядок», т.е. статистическая упорядоченность взаимного расположения только ближайших друг к другу молекул или ионов. В среднем для каждой молекулы жидкости число ближайших соседей и их взаимное расположение одинаковы. Так же как и частицы твердых веществ, молекулы жидкости совершают тепловые колебания около положения равновесия. Однако если в твердых веществах эти положения равновесия неизменны, то в жидкостях они время от времени изменяются. По истечении некоторого времени (t) молекула жидкости перемещается в новое положение равновесия на расстояние, примерно равное среднему расстоянию между молекулами. Эти перемещения обусловливают текучесть жидкости. Среднее значение t, называемое средним временем «оседлой жизни» молекул, зависит от природы жидкости (растворы, спирты, расплавы) и очень быстро уменьшается с увеличением температуры:
где t0 ~ 10-12 с – время «оседлой жизни» при абсолютном нуле; К = 1,280662×10-23 Дж×К-1 – постоянная Больцмана; Т – абсолютная температура; W – энергия активации перемещения молекул из одного положения равновесия в другое. Для маловязких жидкостей t ~ 10-11 с. Различают однокомпонентные (чистые) жидкости и растворы. Жидкости, у которых с повышением температуры коэффициенты вязкости (h) и теплопроводности (l) резко уменьшаются, а коэффициенты объемного расширения (aV), сжимаемости (b) и теплоемкости (с) возрастают, называются нормальными. Большинство же жидкостей – ассоциированные жидкости, для которых характерны высокие значения плотности, температуры кипения и плавления и других параметров (вода, спирты, жидкие металлы, растворы солей и др.). Отдельную группу составляют квантовые жидкости (например, жидкий гелий). Они обладают сверхтекучестью. Статистическая теория жидкости ставит своей целью объяснение наблюдаемых особенностей структуры и определение основных свойств, исходя из законов движения и вращения частиц (атомов, молекул, свободных радикалов, ионов). Согласно этой теории чистые жидкости подразделяются на классические и квантовые в соответствии с теми законами, которым подчиняется движение частиц, и на ряд классов в соответствии с видами межчастичных сил, которые действуют в жидкости: – простые (сжиженные газы, жидкие металлы и другие), между частицами которых действуют центральные силы: обменное отталкивание на малых расстояниях и слабое дисперсионное притяжение на больших; – неполярные молекулярные жидкости (N2, Cl2, CS2, C2H6, C6H6 и другие), для частиц которых характерно нецентральное отталкивание и анизотропия взаимного притяжения; – полярные жидкости (SO2, CF3Cl, C6HsBr и другие) со специфическими отличиями нецентральных взаимодействующих сил (диполь-дипольными, диполь-квадрупольными и другие); – ассоциированные жидкости (вода, спирты, амино- и карбоновые кислоты и другие), молекулы которых взаимодействуют с образованием водородных связей; – реагирующие жидкости (NO, NO2, AlCl3, Si, Ge, S и т.п.), обладающие способностью взаимодействовать друг с другом благодаря незамкнутым электронным оболочкам. Для определения структуры жидкостей существует много различных методов. Наибольшие успехи достигнуты статистической теорией в изучении простых жидкостей. Например, методами численного эксперимента установлено, что структура ближнего порядка простых жидкостей при заданной плотности определяется в основном силами межмолекулярного отталкивания. Рассмотрим самую распространенную жидкость на Земле – воду. Вода (оксид водорода, Н2О) – простейшее устойчивое соединение водорода с кислородом, жидкость без запаха, цвета и вкуса. Является самой важной составной частью всего сущего на Земле и в межпланетном пространстве (входит в состав комет, большинства планет солнечной системы и их спутников). Количество воды на поверхности Земли оценивается в 1,39×1018 т, большая ее часть содержится в морях и океанах. Вода входит в состав многих минералов горных пород, присутствует в атмосфере и почве, является обязательным компонентом всех живых организмов. Атомы водорода и кислорода в молекуле воды (рис. 4.1, 4.2) расположены в углах равнобедренного треугольника с длиной связи О-Н равной 0,0957 нм, валентный угол Н-О-Н равен 104,5°. Молекулы воды,
Рис. 4.1. Структура воды
Рис. 4.2. Структура молекулы воды: а – геометрия молекулы H2O (в парообразном состоянии); б – электронные орбиты в молекуле H2O; в – электронная формула молекулы H2O (видны необобществленные электронные пары); г – четыре полюса зарядов в молекуле H2O расположены в вершинах тетраэдра обладая значительным дипольным моментом, сильно взаимодействуют друг с другом и полярными молекулами других веществ. При этом атомы водорода могут образовывать связи с атомами O, N, F, Cl, S и другими, а также образовывать так называемые газовые гидраты с СО2, Сl2, (СН2)2, О и другие. Кристаллическая структура льда представляет трехмерную сетку. В плотных модификациях (рис. 4.3), устойчивых при высоких давлениях, можно выделить две сетки, «вставленных» одна в другую, по сравнению с модификациями, в которых связи искривлены и углы отличаются от тетраэдрических. Только в плотных модификациях достигается высокая плотность упаковки: в их структуре две правильные сетки, построенные из тетраэдров (аналогичные существующим в кубическом низкотемпературном льде, изоструктурном алмазу), вставлены одна в другую.
Рис. 4.3. Кристаллическая структура льда (плотная модификация):
При этом сохраняется система прямолинейных водородных связей, а координационное число по кислороду удваивается и достигает 8. Расположение атомов кислорода во льдах подобно раположению атомов в a-железе и многих других металлах. Увеличение плотности при плавлении (в случае плотных модификаций льда) объясняется искривлением водородных связей и отклонением углов между ними от тетраэдрических (рис. 4.4). Искривление связей увеличивается с ростом температуры и давления, что приводит к возрастанию плотности. С другой стороны, при нагревании средняя длина водородных связей становится больше, в результате чего плотность уменьшается. Совместное действие двух факторов объясняет наличие максиму-ма плотности воды при t = 3,98 °С.
Рис. 4.4. Схема тетраэдрической координации молекулы воды: сплошные линии – ковалентные связи; пунктирные – водородные связи Ориентация молекул во льдах модификаций III, V–VII (рис. 4.5) не определена: оба ближайших к атому кислорода протона образуют с ним ковалентные связи, которые могут быть направлены к любым двум из четырех соседних атомов кислорода в вершинах тетраэдра. Модификации II, VIII и IX ориентационно упорядочены. Лед XIII представляет упорядоченный по размещению протонов вариант льда VII, а лед IX – льда III. Плотности ориентационно упорядоченных модификаций (VIII, IX) близки к плотностям соответствующих неупорядоченных (VII, III). Трехмерная сетка водородных связей, построенная из тетраэдров, существует и в жидкой воде во всем интервале температур (от температуры плавления до критической).
Рис. 4.5. Диаграмма состояния воды
Вода – универсальный растворитель, в ней растворяются многие полярные и диссоциирующие на ионы вещества. Обычно растворимость возрастает с повышением температуры, но иногда температурная зависимость носит более сложный характер. Растворами называют однородные системы переменного состава с равномерным распределением одного или нескольких веществ в среде другого. Обычно, если особо не оговаривается, термин «раствор» относят к жидким системам. Однако растворы бывают жидкими, твердыми и газообразными. О твердых растворах говорилось в предыдущих разделах. К газообразным растворам относят воздух, горючие природные газы и т.д., к жидким – растворы солей в воде, металлов в ртути (амальгамы), нефть и многие другие, которые используются в промышленной практике и в быту. Всякий раствор состоит из растворенного вещества и растворителя, т.е. среды, в которой это вещество равномерно распределено в виде молекул, агрегатов молекул или ионов. Существует понятие строительного раствора – неточное наименование смесей вяжущего вещества, мелкого заполнителя (песка) и воды. При концентрациях растворенного вещества, меньших его растворимости, раствор называют ненасыщенным; раствор, в котором концентрация растворенного вещества превышает его растворимость, называется пересыщенным. Пересыщенные растворы метастабильны: при внесении затравки или перемешивании возможно самопроизвольное выделение избытка пересыщенного компонента, что способствует образованию новой жидкой или твердой фазы. Если компоненты близки по химическому составу, строению, размерам и характеру взаимодействия, то структура раствора принципиально не отличается от строения чистых жидкостей. При наличии специфических взаимодействий (химических превращений, водородных связей и т.д.) растворенные вещества могут образовывать устойчивые комплексы с растворителем как постоянного, так и переменного состава. В ряде случаев взаимодействие молекул растворенного вещества с молекулами растворителя сопровождается обратным процессом – диссоциацией молекул растворенного вещества. При малых концентрациях растворенных веществ в растворе сохраняется структура, характерная для чистого растворителя. С увеличением концентрации структура раствора изменяется. Например, у водных растворов электролитов ионы больших размеров (по сравнению с молекулами воды) разрушают структуру растворителя, а ионы меньших размеров ее упорядочивают. Установление взаимосвязи свойств раствора с характером межмолекулярного взаимодействия или макроскопическими свойствами чистых компонентов составляет проблему теории растворов. Практически в природе и технике мы сталкиваемся только с растворами. Химически чистые вещества представляют собой лишь предельные состояния, которые в действительности не достигаются. Даже чистейшие металлы содержат ничтожные количества примесей (до 10-6 %) и по существу являются твердыми растворами (и не известно, могли бы они существовать в ином состоянии). Образование растворов существенно изменяет условия протекания химических реакций между компонентами: многие процессы протекают исключительно в растворах; водные растворы солей, кислот и оснований широко используются в промышленности и быту; очень важна роль водных растворов во всех биологических процессах; использование неводных растворов связано с применением полимеров, красителей, лаков, приготовление жидкостей с заданными физико-химическими свойствами – эмульсий, паст, порошков и других дисперсных систем. Важную часть во всем многообразии существующих растворов с точки зрения строительного материаловедения занимают дисперсные системы (рис. 4.6), т.е. гетерогенные системы, состоящие из двух или большего числа фаз с сильно развитой поверхностью раздела между ними. Обычно одна из фаз образует непрерывную дисперсионную среду, в объеме которой распределена дисперсная фаза (или несколько дисперсных фаз, или ни одной фазы) в виде мелких кристаллов, твердых аморфных частиц, капель или пузырьков.
Рис. 4.6. Кривые распределения объема (массы) частиц по размерам: 1 — монодисперсная система; 2 — полидисперсная система; δmin, δmax, δ0 — соответственно минимальный, максимальный и вероятнейший размер частиц; f(δ) — функция распределения, доля объема (или массы) дисперсной фазы, которая приходится на частицы с данным интервалом размеров, деленная на величину интервала
Дисперсные системы могут иметь и более сложное строение, например представлять собой двухфазное образование, каждая из фаз которого проникает в объем другой фазы. К таким системам относятся твердые вещества, пронизанные разветвленной сетью каналов-пор, заполненных газом или жидкостью, некоторые микрогетерогенные полимерные композиции и другие. Нередко дисперсионная среда «вырождается» до тончайших слоев (пленок), разделяющих частицы дисперсной фазы. По дисперсности, т.е. по размеру частиц дисперсной фазы или отношению общей площади межфазной поверхности к объему (или массе) дисперсной фазы (удельной поверхности), дисперсные системы условно делят на грубодисперсные и тонко (высоко) дисперсные. Последние часто называют коллоидно-дисперсными или просто коллоидными системами. В грубодисперсных системах частицы имеют размеры от 1 мкм и выше (удельная поверхность – не более 1 м2/г), в коллоидных – от 1 нм до 1 мкм (удельная поверхность достигает сотен м2/г). Дисперсность оценивается по усредненному показателю (среднему размеру частиц, удельной поверхности) или дисперсному составу. Тонкодисперсные материалы характеризуются пористостью – понятием, аналогичным дисперсности. В свободнодисперсных системах сцепление между частицами дисперсной фазы отсутствует, каждая частица кинетически независима и при достаточно малых размерах участвует в интенсивном хаотическом движении. Для структурированных (связнодисперсных) систем характерно наличие неупорядоченной пространственной сети (каркаса), образованной частицами дисперсной фазы. Особую группу составляют высококонцентрированные дисперсные системы, в которых частицы находятся в «стесненных» условиях, как например в периодических коллоидных системах. Механические свойства свободнодисперсных систем определяются главным образом свойствами дисперсионной среды, а связнодисперсных систем – также свойствами и числом контактов между частицами дисперсной фазы. По агрегатному состоянию дисперсионной среды и дисперсной фазы выделяют следующие основные виды дисперсных систем: а) аэродисперсные (газодисперсные) системы с газовой дисперсионной средой – аэрозоли (дымы, пыль, туманы); б) с газовой дисперсной фазой: грубодисперсные – газовые эмульсии и пены; в) системы с жидкой дисперсионной средой и с твердой дисперсной фазой: грубодисперсные – суспензии и пасты, высокодисперсные – золи и гели; г) с жидкой дисперсной фазой: грубодисперсные – эмульсии, высокодисперсные – микроэмульсии и латэксы; д) системы с твердой дисперсионной средой: стеклообразные или кристаллические материалы с включениями мелких твердых частиц, капель жидкости или пузырьков газа, например рубиновые стекла, минералы типа опала, разнообразные микропористые материалы. е) порошки, волокнистые материалы типа войлока. Отдельные группы дисперсных систем составляют многочисленные металлические сплавы, горные породы, сложные композиционные материалы и другие многофазные системы. Образование дисперсных систем возможно двумя путями – диспергированием и конденсированием. Диспергирование – процесс разъединения (измельчения) компонентов со значительными затратами эне-ргии или происходящий самопроизвольно. Конденсирование – путь об-разования дисперсных систем, связанный с зарождением новой фазы. Структурообразование в дисперсных системах – процесс соединения частиц дисперсной фазы и их агрегатов в пространственные каркасы. Происходит в системах с твердой, жидкой или газообразной дисперсионной средой (суспензии, золи, латексы, биологические системы, порошки и т.д.), в концентрированных эмульсиях, в том числе стабилизированных микроэмульсиями пенах. В основе классификации структурированных дисперсных систем (по П.А. Ребиндеру) лежит тип связей – контактов, возникающих между дисперсными частицами. Связи могут быть: –обратимыми по прочности, т.е. самопроизвольно восстанавливающимися после разрушения; –непосредственными, когда имеют место атомные контакты в порошках (сила сцепления – 10-7…10-9 Н); – коагуляционными в суспензиях и эмульсиях, т.е. образующимися в результате сцепления частиц через прослойку жидкой среды (сила сцепления ~10-8…10-12 Н); – прочными, необратимо разрушающимися (фазовые контакты). Последние характерны для дисперсных материалов, представляющих собой системы с обратимыми по прочности связями, полученные в результате фазовых или химических превращений: кристаллизации из насыщенных растворов или расплавов, полимеризации, спекания, пластической деформации и др. Выделяют два основных типа дисперсных структур – коагуляционные и конденсационные (или конденсационно-кристаллизационные). Прочностные свойства конденсационных систем выше, чем коагуляционных. Объясняется это тем, что фазовые контакты в конденсационных дисперсных системах образуются при спекании и прессовании порошков, твердении цементов и бетонов, полуводного гипса и т.д., их прочность намного превосходит прочность коагуляционных контактов. Структурообразование сопровождается появлением сначала агрегатов частиц и повышением вязкости системы, затем вязкость резко возрастает на несколько порядков, что сопровождается формированием сплошной структурной сетки. Количественно структура дисперсной системы характеризуется прочностью, определяемой силой сцепления частиц в контакте, числом контактов в единице объема, дисперсностью и формой частиц. Кинетика структурообразования – основное направление исследований в области физической химии. Основой теории структурообразования в жидких дисперсных системах, объясняющей происхождение причин возникновения тех или иных структур, является понятие лиофильности и лиофобности. Различия между ними обусловлены степенью схожести свойств дисперсионной среды и дисперсной фазы. Лиофильность (от греч. lyo – «растворяю» и phileo – «люблю») – предполагает незначительное различие сил межмолекулярного взаимодействия по обе стороны поверхности, разделяющей фазы, поэтому энергия связи в контактах сопоставима с энергией хаотического движения К Т (К – постоянная Больцмана, Т – абсолютная температура). Лиофобность (от греч. lyo – «растворяю» и phobos – «страх») – связана с существенными различиями в характере межмолекулярного взаимодействия, что приводит к термодинамической неустойчивости дисперсной системы. В этих системах возможны такие процессы, как коагуляция – сближение и объединение частиц, сохраняющих первоначальную форму и размеры, в плотные агрегаты; коалесценция – укрупнение первичных частиц вследствие слияния капель или пузырьков; собирательная рекристаллизация – появление новой кристаллической фазы в кристаллической дисперсной системе; изотермическая перегонка – молекулярный перенос, сопровождающийся переконденсацией вещества дисперсной фазы от мелких частиц к крупным. Нестабилизированные и, следовательно, неустойчивые лиофобные дисперсные системы непрерывно изменяют свой дисперсный состав в сторону укрупнения частиц вплоть до полного расслоения на макрофазы. Однако стабилизированные лиофобные дисперсные системы могут сохранять дисперсность в течение длительного времени. Устойчивость дисперсных систем характеризуется постоянством дисперсности (распределения частиц по размерам) и концентрации дисперсной фазы (числом частиц в единице объема). Наиболее сложна в этом отношении проблема устойчивости аэрозолей и жидких лиофобных систем. Устойчивость их зависит от способности частиц удерживаться поверхностью жидкости или силами сцепления частиц между собой при непосредственном контактировании в жидкости, а порошка или дисперсной пористой структуры – скоростью и равновесной глубиной пропитки жидкостью. При высокой удельной поверхности порошков и пористых частиц устойчивость дисперсной системы может характеризоваться ее способностью адсорбировать пары жидкости и смачиваемостью. Управление стабилизационными показателями осуществляется химическим модифицированием поверхности. Например, «прививкой» к поверхности твердой частицы лиофильных или лиофобных функциональных групп, а также введением в систему поверхностно-активных веществ (ПАВ), изменяющих характер взаимодействия на межфазной поверхности: уменьшающих или увеличивающих избыток энергии на поверхности раздела дисперсная фаза – дисперсионная среда. В зависимости от химической природы ПАВ возможна как частичная или полная лиофилизация, так и частичная или полная лиофобизация систем. Особенно эффективная лиофилизация достигается при образовании на поверхности частиц так называемого структурно-механического барьера – плотных слоев низко- или высокомолекулярных ПАВ, которые имеют лиофильную наружную поверхность и способны противостоять механическому воздействию при приближении частиц друг к другу. Поверхностно-активные вещества нашли широкое применение в различных областях техники и технологии, а также в быту. Они используются как пластификаторы специальных формовочных смесей и микродобавки к жидким растворам. Например, для лучшей перемешиваемости с наименьшим количеством воды в бетонную смесь часто добавляют органические соединения, способные концентрироваться на поверхности раздела фаз, уменьшая силы трения между частицами. Различают гидрофилизующие (водосмачивающие, пластификаторы) – лигносульфонаты (ЛСТ), отходы дрожжевого производства (СДБ) и гидрофобизующие (водоотталкивающие) – кубовые остатки жирных кислот (мылонафт). Коагуляционные свойства дисперсных систем – эмульсий и суспензий, нашедших широкое применение в промышленности и технике, наиболее четко выражены в водной среде в смеси синтетических цепных жирных кислот, различных сложных эфиров, образованных глицерином и карбоновыми кислотами (алкановыми и алкеновыми), и т.д. Жиры, представляющие собой при комнатной температуре жидкие вещества, называются жирными маслами. Они отличаются по структуре и свойствам от минеральных масел (углеводородов). Наиболее часто в жирах встречаются этерифицированные гексадекановая (пальмитиновая) кислота С15Н31-СООН, октадеценовая (стеариновая) кислота С17Н35-СООН и октадиценовая (олеиновая) кислота С17Н33-СООН. Разработаны на основе отходов промышленности ряд суперпластификаторов, позволяющих без увеличения водосодержания и без снижения прочности искусственных каменных материалов (бетонов) переводить малоподвижные смеси в литые. Эти суперпластификаторы марки «С» (С-3, С-4) вводятся в бетонные смеси в количестве 0,5…2%. Гидрофобизующие ПАВ применяют как добавки-интенсификаторы измельчения и регуляторы свойств цементов и бетонов. Их общим свойством является химическое взаимодействие с цементом и продуктами его гидратации с образованием соединений, не смачивающихся водой. Обладают способностью воздухововлечения вследствие микропенообразования. Гидрофилизующие ПАВ применяют для повышения подвижности растворных и бетонных смесей, разжижения сырьевых шламов, снижения влажности и улучшения формовочных свойств керамических масс.
Вопросы для самоконтроля
1. Понятие и структура жидкости. 2. Приведите классификацию жидкостей. 3. Опишите структуру воды и льда. 4. Дайте понятие и классификацию жидких растворов. 5. Понятие, состав, свойства, классификация и применение дисперс-ных систем.
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-28; просмотров: 461; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.156 (0.014 с.) |

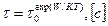 , (4.1)
, (4.1)


 – кислород, ● – водород
– кислород, ● – водород





