Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
II – область разупорядоченного состоянияСодержание книги Поиск на нашем сайте
В то же время перейти раздел между упорядоченным кристаллическим состоянием и одним из неупорядоченных агрегатных состояний практически невозможно без дискретного изменения определенных параметров состояния, например объема, энтальпии или энтропии. Твердым материалам с непериодическим строением долгое время не уделялось должного внимания. И хотя стекло относится к наиболее древним материалам, лишь в последние десятилетия начали развиваться теории, специально посвященные описанию аморфного и стеклообразного состояния. Аморфными (от греч. amorphos – бесформенный; a – отрицательная частица, morphe – форма) называют материалы, у которых нет общего закономерного внутреннего строения, в отличие от кристаллических, а составляющие их частицы расположены беспорядочно, вследствие чего они изотропны, т.е. имеют одинаковые свойства по всем направлениям, не обладают симметрией и не могут самоограняться. Расположение частиц в них такое же, как и в жидкости, поэтому их иногда сравнивают с переохлажденными жидкостями. При нагревании аморфные тела постепенно размягчаются и из твердого состояния переходят в жидкое. Для них характерно отсутствие четко выраженной температуры плавления, в отличие от кристаллических материалов. Наблюдая кривые охлаждения (или нагревания) кристаллических и аморфных материалов (рис. 3.2), можно видеть, что на кривой охлаждения кристаллического вещества (рис. 3.2, а) имеются два резких перегиба (точки а и б), соответствующие началу и концу кристаллизации. В случае же охлаждения аморфного материала наблюдается плавная кривая (рис. 3.2, б). По этому признаку в первую очередь различают кристаллические и аморфные материалы.
Рис. 3.2. Кривые охлаждения кристаллического (а) и аморфного (б) вещества
Аморфное состояние в принципе достигается двумя путями: 1. Измельчением твердых частиц (диспергированием) до определяемого рентгенографически размера кристаллов (примерно 10-6 см и меньше). При этом образуется очень большая внешняя поверхность. Так, если измельчить образец объемом в 1 см3, имеющий форму куба (а значит,поверхность 6 см2), на кубики с длиной ребра в 10-6 см, то поверхность увеличится в миллион раз:
F = 6×10-12×1018 = 6×10-6 [см2]. (3.1)
К этой огромной внешней поверхности в 600 м2 добавится возникающая при диспергировании значительная внутренняя поверхность (внутренние каверны, микротрещины и т.д.) того же порядка величины. Практически диспергирование до аморфного состояния весьма затруднительно. 2. При конденсации частиц из аморфно-дисперсного состояния. При этом образуются фрагменты твердой структуры. Примером является образование сажи при коптящем горении (тлении) углеводородов:
СН4(газ)+ О2(газ) = Ссажа + 2Н2О(пар). (3.2)
Поэтому аморфным часто называют агрегатное состояние, характеризуемое фрагментами структуры твердого вещества и развитой поверхностью. При охлаждении разогретой жидкости часто обнаруживается явление переохлаждения – образование метастабильного состояния жидкости, охлажденной ниже температуры плавления соответствующей твердой фазы. Например, при определенных условиях вода может очень сильно переохладиться. Так, капельки облаков и туманов даже при температуре около – 30 °С могут оставаться в жидком состоянии. Переохлаждение жидкостей возможно при отсутствии зародышей кристаллизации, чему способствуют: 1) тщательное отфильтровывание твердых включений; 2) предварительный нагрев жидкости значительно выше температуры плавления; 3) тщательная защита от попадания пылинок из воздуха. Аморфные материалы бывают природные (янтарь, опал, обсидиан, битумы и т.д.) и искусственные (стекло, пластмасса, клей, желатин, аморфные металлы и сплавы и др.). При быстром охлаждении жидкость можно довести до большого переохлаждения, при котором ее вязкость чрезвычайно сильно возрастает и вещество переходит в стеклообразное состояние. Такими сильно переохлажденными жидкостями можно считать стекла. Расплавы всех веществ выше температуры их плавления (Т пл) находятся обычно в термодинамически равновесном состоянии, в котором любая функция состояния (удельный объем, энтальпия, энтропия) однозначно определяется температурой, давлением и другими параметрами. При Т пл вещества переходят в равновесное твердое состояние – кристаллизуются (рис. 3.3). Однако в определенных условиях при темперах
Рис. 3.3. Температурные интервалы существования аморфного и кристаллического состояния вещества (сплошная линия – равновесное состояние; штрих-пунктирная – неравновесное):
1– стекло; 2 – переохлажденная жидкость; 3 – равновесная жидкость; 4 –кристалл ниже Т пл может быть получено неравновесное состояние переохлажденной жидкости, а при дальнейшем охлаждении ниже точки стеклования Т ст – неравновесное твердое аморфное состояние, иначе называемое стеклообразным состоянием. В этом состоянии материал может быть устойчивым в течение длительного времени (известны, например, вулканические стекла – обсидиан и другие, возраст которых исчисляется миллионами лет). Термодинамические функции стеклообразного состояния определяются не только температурой и давлением, но зависят также от предыстории образца (например, скорости охлаждения). Физические и химические свойства материала в стеклообразном состоянии обычно близки к свойствам кристаллической модификации того же материала, но могут и существенно отличаться. Так, стеклообразный GeO2 растворим в воде и растворах щелочей, реагирует с фтористоводородной и соляной кислотами, тогда как a-модификация GeO2 в воде практически не растворима, очень медленно растворяется в растворах щелочей при нагревании, не реагирует с данными кислотами. Переход из переохлажденного жидкого состояния в стеклообразное происходит обычно в узком температурном интервале и сопровождается резким изменением свойств, в частности увеличением вязкости (на 10…15 порядков), температурного коэффициента расширения (в 10…100 раз), модуля упругости (в 10…100 раз), теплоемкости, плотности и т.д., чем формально напоминает фазовый переход II рода. Однако образование стеклообразного вещества не сопровождается появлением зародышей новой фазы и физические границы раздела фаз (Т ст) не являются термодинамической характеристикой всей системы, а Т ст в зависимости от условий измерения может меняться на несколько десятков градусов. Это обусловлено тем, что в температурном интервале стеклования резко замедляется перестройка структуры ближнего порядка жидкости (имеет место так называемая структурная релаксация), т.е. кинетической природой стеклования. Ниже Т ст структурные превращения в материале прекращаются совсем (при конечном времени наблюдения), частицы (атомы, молекулы, фрагменты молекул) способны лишь к колебательным и мелкомасштабным вращательным движениям, трансляционная подвижность, характерная для жидкого состояния, теряется. Таким образом, различия в свойствах жидкого и твердого аморфного состояния материала определяются характером теплового движения молекул. При охлаждении жидкости подвижность составляющих ее частиц снижается медленно, что проявляется в постепенном росте вязкости жидкости. Интервал температур, в котором происходит переход из жидкого состояния в стеклообразное, называется интервалом стеклования. Температуры верхней и нижней границ интервала стеклования зависят от скорости охлаждения жидкости. Они тем выше, чем больше эта скорость. При скорости охлаждения 3 К/мин эти температуры близки к температурам, при которых вязкость h жидкости равна соответственно 1010 и 1014 Па×с. Интервал стеклования ограничен двумя температурами: со стороны высоких температур – Т f, со стороны низких температур – T g (температура стеклования). Понятия T f и T g введены Тамманом (рис. 3.4). Подстрочные символы «g» и «f» являются первыми буквами в словах стекло (Glas) и жидкость (Flüssigkeit). При температуре T g стекло обладает свойствами твердого упругого тела с хрупким разрушением. Температура T f является границей пластического и жидкого состояний. При температуре T f из стекломассы уже удается вытягивать тонкие нити.
Рис. 3.4. Зависимость свойства Р и его производных в интервале стеклования (по Тамману) Процессы размягчения стекла или затвердевания стекломассы являются однофазными в отличие от плавления кристаллических веществ или кристаллизации расплавов. При размягчении стекла в интервале стеклования отсутствует жидкая фаза. Свойства стекол по характеру изменения в интервале стеклования делят на три группы. К первой группе относятся свойства Р, характеризующие функцию состояния веществ (внутренняя энергия Е, мольный объем V, энтальпия Н, энтропия S) и кинетические свойства (вязкость h, удельное сопротивление r). Свойства первой группы с повышением температуры изменяются постепенно. В интервале стеклования кривая имеет закругленный перегиб (см. рис. 3.4, кривая 1), соответствующий наиболее резкому изменению свойств первой группы. Свойства второй группы представляют собой первую производную по температуре d P /d T от свойств первой группы (коэффициенты термического расширения, теплоемкость). Кривая 2 характеризует температурный ход зависимости свойств второй группы. Можно видеть, что в интервале стеклования первая производная d P /d T имеет точку перегиба T w. Третья группа включает свойства (теплопроводность, диэлектрические потери), которые являются вторыми производными по температуре от функций состояния (кривая 3 на рис. 3.4). Так как верхняя температура интервала стеклования обычно намного ниже температуры ликвидуса, в стеклообразное состояние могут переходить только вещества, склонные к переохлаждению, т.е. способные перейти при охлаждении подликвидусную область температур без появления признаков кристаллизации. Ввиду стабилизации структуры вещество, перешедшее в стеклообразное состояние и находящееся при температуре, существенно более низкой, чем температура нижней границы интервала стеклования, к кристаллизации не способно. Чем быстрее проводится охлаждение, тем больше вероятность, что данная жидкость будет получена в стеклообразном состоянии. Минимальная скорость охлаждения жидкости, которая обеспечивает получение стеклообразного состояния, называется критической скоростью охлаждения.
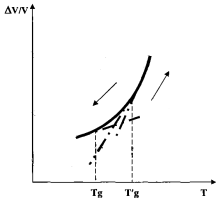
Существуют материалы, которые не удается получить в кристаллическом состоянии. К ним относятся атактические полимеры и статистические сополимеры, в макромолекулах которых последовательность мономерных звеньев перпендикулярна к направлению оси цепи. Считается, что у этих материалов ни при каких условиях не может возникнуть трехмерная периодичная структура и, следовательно, они существуют только в аморфном состоянии. Вопрос о термодинамической природе равновесного твердого аморфного состояния пока остается открытым. Ряд жесткоцепных полимеров с высокой Т ст существуют только в стеклообразном состоянии, так как при нагревании выше Т ст они размягчаются. Рассмотрим подробнее понятие твердого аморфного (стеклообразного) состояния – стекла. В общем смысле слова стекло – это переохлажденная жидкость с исключительно высокой вязкостью, что делает его при комнатной температуре внешне подобным твердому веществу. Стеклу, как и кристаллам, присущи такие свойства, как твердость и способность сохранять форму. В этом состоянии после глубокого переохлаждения жидкости неограниченно снижается подвижность составляющих ее частиц (атомов и молекул) и происходит «замораживание» структуры ближнего порядка жидкости. Стеклообразные вещества в отличие от жидкостей сохраняют свою форму и не способны к необратимой деформации под действием внешних сил (при значительных деформациях). Переход из жидкого в стеклообразное состояние и обратно сопровождается изменением температурных коэффициентов всех свойств вещества. При этом всегда наблюдается характерная петля гистерезиса (рис. 3.5). По пересечению экстраполированных участков температурных зависимостей для жидкого и стеклообразного состояния
Рис. 3.5. Общий характер температурной зависимости удельного объема вещества в интервале стеклования (стрелки показывают направление изменения температуры) Среди неорганических материалов высокую склонность к стеклообразованию проявляют: SiO2, В2О3,GO2, BeF2, халькогениды мышьяка (соединения мышьяка с серой), сульфиды – As2S5, As2S3 (минерал аурипигмент), As4S4 (реальгар), As4S3 (диморфит); с селеном – селениды – As2Se3, As4Se4; с теллуром – теллуриды – As2Te3 и другие. Легко перево- дятся в стеклообразное состояние расплавы различных смесей оксидов в случаях, когда в этих смесях значительное содержание перечисленных выше оксидов, а также Р2О5. Высока склонность к стеклообразованию у смесей галогенидов с органическими соединениями. Полимерные стекла, состоящие из длинных макромолекул с заторможенным внутренним вращением, при «расстекловывании» переходят не в текучее (как низкомолекулярные соединения), а в высокопластичное состояние. Стеклование полимеров – это явление, когда при понижении температуры время изменения характеристик высокопластичных молекул соизмеримо со временем опыта, т.е. перестройка молекул успевает произойти за период стеклования.
Вязкость полимеров в стеклообразном состоянии (олефины, нафтены, парафины, ацетилены и т.д.) составляет 1011…1013 Па×с, а характерный период движения вблизи Tg превышает 102…103 с. При заданном давлении значение Tg полимеров намного выше Tg соответствующих низкомолекулярных мономерных жидкостей. Значение Tg полимеров сильно зависит от давления, скорости охлаждения, частоты периодического воздействия. При добавлении низкомолекулярных примесей (пластификаторов) Tg полимера снижается. Коррозионностойкие аморфные металлические сплавы (металлические стекла) – это металлонаполненные полимеры или пористые металлы, пропитанные полимерными композициями. Наполнителями служат порошки, волокна и ленты (чаще всего Fe, Cu, Ni, Ag, Sn, Al, Be, Pb, Zn, Zr, Cr, Ti, Ta). Металлические порошки (микросферы, чешуйки и частицы неправильной формы) имеют размер 10…105 нм, размер волокон в поперечном направлении составляет 102…2×105 нм. Металлами наполняют полиамиды, ПВХ, полиэтилен, эпоксидные, фенолформальдегидные, полиэфирные и кремнийорганические полимеры. Получают металлические стекла смешиванием металлических наполнителей или их суспензий в воде или в органическом растворителе с порошком, расплавом, суспензией или растворами полимеров. Применяют металлополимеры в антикоррозионных защитах, в качестве клеев, герметиков, защитных лакокрасочных покрытиях, для изготовления вкладышей подшипников, магнитных захватов, экранов для защиты от электромагнитных полей и действия ионизирующих излучений и других целей. Возможные способы получения аморфных материалов. В стекловарении, имеющем более чем четырехтысячелетнюю историю, при варке стекол для различных целей полностью оправдали себя высокотемпературные методы: смеси неорганических веществ переводят в расплав, который затем в процессе охлаждения затвердевает. Вместе с тем и кристаллические твердые вещества при подводе к ним энергии могут быть переведены в аморфное (стеклообразное) состояние, минуя жидкую и газообразную фазы. Обзор необычных методов получения некристаллических материалов с применением специальных машин представлен на рис. 3.6, 3.7. Стекла могут быть получены путем быстрого охлаждения расплавов (1) (как уже упоминалось), из растворов путем высушивания гелей (2). Для получения красного аморфного селена, сульфидов мышьяка, сурьмы, германия, олова и других металлов и их оксидов применяют процесс осаждения из растворов и получения аморфных осадков (3). Аморфный германий, «взрывчатую» сурьму, металлические стекла получают элект-
Рис. 3.6. Способы получения стеклообразных тел из расплавов или растворов, газовой фазы или кристаллического состояния (по Оуэну) ролитическим осаждением при высоких плотностях тока (4). Из газовой среды аморфные материалы получают термическим испарением с последующей конденсацией в высоком вакууме (5), катодным распылением (6), осаждением в тлеющем разряде (7). При получении кварцевого стекла или аморфных твердых пленок SiO2 применяют химическое осаждение из газовой фазы (8) (гидролиз SiCl4 или пиролиз смесей SiCl4O2). Пленки кварцевого стекла или слои SiOx также можно получать окислением поверхности монокристаллов крекремния (9). Из кристаллических материалов стеклообразные получают воздействием ударной волны (10) или интенсивного нейтронного или ионного излучения (11). Аморфные продукты часто образуются в результате химического разложения веществ в твердой фазе (12), например при обезвоживании каолинита. Необходимо отметить, что сильно разупорядоченные аморфные поверхностные слои могут возникать и при механической обработке кристаллических твердых тел, например при шлифовании и полировании. Получение стекол из расплава. Сущность процесса заключается в сохранении при охлаждении гомогенного и изотропного состояния расплава, т.е. в предотвращении кристаллизации и зародышеобразования. Опытным путем установлено, что склонность к возникновению стеклообразного состояния при затвердевании расплавов проявляется тем сильнее, чем выше вязкость жидкой фазы вблизи температур ликвидуса и чем резче вязкость возрастает с понижением температуры. В области температур стеклования осуществляется переход от пластичного бесформенного переохлажденного расплава в твердое стеклообразное состояние, характеризующееся упругим сохранением формы. В термодинамическом смысле уже переохлажденный расплав метастабилен по отношению к
Рис. 3.7. Схема машины для производства ленты с аморфной структурой кристаллическому состоянию. В стекле же метастабильное состояние переохлажденного расплава «замораживается». Скорость охлаждения зависит от количества расплавленной исходной смеси, при этом концентрация центров кристаллизации не должна превышать один центр на 1 см2. Критическая объемная доля центров кристаллизации равна 10-6. Получение аморфных твердых материалов из растворов. Растворенные вещества можно перевести в твердое состояние путем выпаривания растворителя, например таких жидкостей, которые понижают растворимость благодаря изменению полярности растворителя. Реакции осаждения являются также основой катодного и анодного выделения веществ. Если изменения условий происходят настолько быстро, что образуются сильно пересыщенные растворы, то времени на образование и рост зародышей кристаллов оказывается недостаточно и получается материал с аморфной структурой. При этом часто промежуточной стадией является образование коллоидных растворов. Увеличение размеров коллоидных частиц, обусловленное процессами коагуляции, заторможено. В определенных случаях затвердению предшествует образование геля, который далее непрерывно может быть переведен в твердый аморфный материал. Причины, приводящие к выпадению из растворов некристаллических осадков, многочисленны. Наряду с получением аморфных форм вещества путем быстрого добавления осадителя или электролизом токами высокой плотности известно множество химических соединений, которые осаждаются из растворов преимущественно в некристаллическом виде. Гомогенное осаждение гелей – удобный способ получения аморфных материалов, поскольку в этом случае компоненты находятся в тесном контакте, что ведет к образованию промежуточных соединений и смешанных фаз, у которых диффузионные пути отдельных частиц при протекании твердофазных реакций сильно сокращаются, благодаря чему превращения протекают в течение короткого времени и при существенно более низких температурах. Для этого оказывается достаточным нагревание геля до температуры ~800 К (т.е. до области стеклования). Свойства полученных из геля стекол (например, при гидролизе эталонных растворов Si(OC2H5)4, Al(OC4H9)3, NaOCH3 и КОС2Н5) совпадают со свойствами продуктов, полученных из расплавов. Формирование стекла проводят прессованием в области температур стеклования Тg. При этом удается избежать попадания в температурную область, где скорость кристаллизации максимальна или где происходит процесс разделения фаз, и тем самым создать относительно благоприятные условия для получения стеклообразного твердого вещества. Образование аморфных осадков широко распространено в химии водных растворов. Часто выпадение таких осадков рассматривают как помеху процессу фильтрации. Кремневая кислота, многие гидроксиды металлов и большое число основных солей образуют аморфные осадки, не имеющие определенного химического состава. Из-за сильно развитой поверхности аморфных осадков другие находящиеся в растворе ионы адсорбируются или хемосорбируются ими и легко соосаждаются. Это обстоятельство часто мешает разделению веществ в аналитических целях. В то же время известны соединения, например As2S3, As2S5, Sb2S3, Sb2S5, GeS2 и другие, которые при осаждении из водных растворов образуют аморфные формы. Благодаря малой растворимости и строго стехиометрическому составу эти вещества можно использовать для гравиметрического определения мышьяка, сурьмы и германия. As2S5 и Sb2S5, а также MoS3, MoSe3, WSe3, V2S5 до настоящего времени известны лишь в виде аморфных модификаций. Ge2S3 и Ge2Se3 осаждаются из растворов также в виде аморфных осадков. Эти же соединения можно получить в стеклообразном состоянии и из расплавов. Электролитическое осаждение аморфных материалов (рис. 3.8).Этот метод широко распространен при создании защитных антикоррозионных покрытий на поверхности металлов (анодное окисление – анодирование). Он основан на образовании плотно прилегающих, как правило, аморфных, слоев, которые предотвращают протекание других окислительных процессов. Толщина оксидного слоя составляет десятые доли микрометра. Большое практическое значение имеет анодирование алюминия. Аморфные пленки Та2О5 отличаются повышенным светопропусканием (прозрачностью) и устойчивы до температуры 923 К (пока не начинается их кристаллизация).
Рис. 3.8. Схема испарительного модуля для лазерного осаждения пленок: 1 – фокусирующаяся линза; 2 – подложка; 3 – мишень; 4 – держатель мишени; 5 – кварцевый измеритель толщины; 6 – двойной электрический зонд Получение аморфных материалов из газовой среды. Для получения стеклообразных материалов посредством конденсации из паровой фазы на подложку применяют испарение, катодное распыление, разложение в тлеющем разряде и реакции газообразных компонентов, приводящие к образованию твердых продуктов. Химический состав получаемых таким образом стеклообразных фаз часто практически совпадает с составами стекол при образовании их из расплава. При получении аморфных твердых продуктов из паровой фазы решающее значение имеет подавление зародышеобразования, важным здесь является использование охлаждаемой подложки. Чем выше склонность новообразований к кристаллизации, тем при более низких температурах необходимо проводить осаждение из газовой фазы. Таким путем получены аморфные формы таких веществ, которые никаким другим способом получить не удавалось, например Mg, Zr, Ta, Mo, W, Re, Cd. Кроме того, этот метод вызывает повышенный интерес в связи с выращиванием монокристаллов (газовая эпитаксия) и может быть использован для получения аморфных веществ. Среди наиболее известных примеров его применения – получение высокочистого SiO2 гидролизом SiCl4 в пламени гремучего газа и пиролизом SiCl4+O2. Оба названных способа позволяют проводить осаждение практически не содержащих воду форм кварцевого стекла очень высокой степени чистоты. Метод термического испарения в вакууме. Процесс испарения определяется скоростью, с которой происходит разрушение поверхности твердых или жидких компонентов, т.е. определяющим фактором этого процесса является перенос тепловой энергии к месту, где происходит реакция. Конденсацию стараются вести как можно более медленно, поддерживая наиболее высокую температуру, но здесь есть опасность внедрения примесей в осажденные слои (например, из окружающей среды) и обратного испарения уже осажденных слоев. При получении аморфного германия оптимальные скорости термического осаждения достигаются при температуре подложки 470 К. Метод катодного распыления. В этом методе используют газовый разряд в атмосфере инертного газа (чаще всего аргона) при пониженном давлении (10…10-2 Па). Ионы Ar+ ускоряются в электромагнитном поле и с огромной скоростью направляются на катод, который покрыт испаряемым веществом. Под действием потока ионов с его поверхности отрываются атомы и небольшие фрагменты молекул. Оторвавшееся с катода вещество более чем на 99% состоит из нейтральных частиц. Они осаждаются за границей зоны газового разряда, например на подложке. При надлежащем охлаждении можно получить аморфные слои с достаточно однородным составом даже из сложных смесей веществ. Осаждение в тлеющем разряде. Получение аморфных материалов путем разложения определенных газовых веществ или газовых смесей в тлеющем разряде относится к методам плазмохимии, которые нашли применение в промышленности. Таким способом получают плотные аморфные полимеры, металлы Si и Ge (из SiH4 и GeH4). Данные материалы содержат некоторое количество водорода. Получение аморфных материалов из кристаллических веществ. Перевод кристаллических твердых тел в аморфное состояние нетермическими способами основан на сильном воздействии на них внешних сил. При этом атомы могут покидать свои равновесные позиции, например, за счет получения импульса энергии извне. В ходе твердофазных реакций происходит распад структуры исходных веществ без построения новой кристаллической решетки с периодическим расположением атомов. В качестве примера можно привести реакции термического обезвоживания каолинита или получение аморфного сульфоферрита калия при нагревании ярозита (KFe3(OH)6(SO4)2) до 500 К. Способы перевода кристаллов различных материалов в аморфные следующие: с помощью механической обработки, облучением, действием ударной волны, химической обработкой. В качестве примера механического воздействия можно привести процесс получения аморфного кварца в вибрационной мельнице. В этом случае, как и при любом интенсивном механическом воздействии, первоначально возникшая в поверхностных слоях разупорядоченность частиц распространяется в глубь материала и постепенно приводит к полной аморфизации структуры. При облучении твердых тел быстрыми нейтронами нарушается периодичность расположения атомов в узлах кристаллической решетки, но не наблюдается переход твердого тела в изотропное расплавленное состояние. Известен способ перевода кристаллического кварца в аморфное состояние воздействием ударной волны силой в 600 кбар. Передача ударного импульса осуществляется через металлические пластины. Практический интерес представляет метод получения аморфных материалов посредством химической обработки поверхности в потоке газообразного кислорода или водяных паров при высоких температурах. Таким образом, преобразуют поверхностные слои кристаллического кварца в аморфное стекло. Это явление происходит в результате реакции поверхностных SiO2 c О2 или Н2О среды. С помощью физико-химических методов аморфное состояние устанавливают, во-первых, по небольшому числу максимумов на дифрактограмме (как правило, 2…4), для которых характерны большая полуширина и быстрое убывание интенсивности с ростом угла дифракции (2q); во-вторых, по отсутствию в колебательном или электронном спектре расщеплений полос, связанных с симметрией структуры. Попытки создания общепринятых физических моделей аморфного состояния пока к успеху не привели. Впервые научно обоснованную теорию строения стекла предложил Д.И. Менделеев, считавший, что стекло – это некристаллический кремнеземистый сплав оксидов, образующийся при быстром охлаждении расплава. Он установил сходство между стеклом и коллоидным гелем и показал, что стекло не является определенным химическим соединением, а своего рода раствором. Изменяемость составов стекол Д.И. Менделеев объяснял способностью молекул кремнезема полимеризоваться в крупные комплексы SinO2n, образующие каркас в стекле. Он указывал на влияние, оказываемое присутствием отдельных оксидов на форму химической связи в стекле, а следовательно, и на его свойства. Одну из первых попыток в ХХ веке охарактеризовать стеклообразное состояние, выделив присущие ему физико-химические особенности, предпринял Г. Тамман в 1933 г. Рассматривая стеклообразование в связи с проблемой предотвращения кристаллизации и поставив вопрос о причинах отчетливо выраженного торможения процессов кристаллизации в некристаллических конденсированных системах, Тамман разработал специфический подход к термодинамическому и кинетическому описанию стеклообразного состояния и ввел впервые структурные представления о его строении и химических связях. Он исходил из представления о жидкостях и стекле как об абсолютно хаотически построенных веществах и считал, что при охлаждении расплавы непрерывно переходят в твердое стекло, которое представляет собой переохлажденную жидкость и в котором внутренние превращения ниже Tg невозможны. Вся сложность явлений в аморфных веществах в их полном объеме стала ясной после обнаружения микрогетерогенной структуры стекла во многих стеклообразующих системах, имеющих практическое значение. Работы Государственного оптического института доказали возможность кристаллизации стекол и превращений в них примерно на 200 °С ниже Tg. О.К. Ботвинкин допускает существование в расплавах и стеклах усложненных группировок – агрегатов молекул. Он считает, что при температурах выше Tg непрерывно происходят распад и агрегация этих групп. При каждой температуре возникают свои равновесные количества и размеры агрегатов. При охлаждении число агрегатов и степень агрегации растут и образуют каркасную структуру стекла. При Tg молекулы связываются в агрегаты, испытывая лишь колебательные движения. Каждому типу молекул соответствует свой тип агрегатов, а агрегатам – своя Tg и свои типы каркасов. Изменение свойств стекла при Tg связано со структурными изменениями того сорта агрегатов, которые возникли первыми и образовали в стекле пространственную сетку. На термограммах стекла разрушение его каркаса при нагревании отмечается эндотермическим эффектом. Структурно-координационная теория Захариасена признает наличие в стеклах непрерывной сетки с ионами или их группами в фиксированных положениях. Отличие этой сетки от кристаллической решетки – отсутствие закономерной периодичности и симметрии в расположении структурных групп, например тетраэдров [SiO4], внутри которых ближний порядок сохранен. Этим стекло отличается от истинно аморфного вещества. В структуре силикатного стекла ионы Si4+ находятся в центрах тетраэдров, как и в кристаллических силикатах. На рис. 3.9 показана структура стекла из чистого кремнезема. Для простоты даны лишь по 3 иона О2– вокруг иона Si4+.
Рис. 3.9. Сетка из тетраэдров [SiO4] в кремнеземистом стекле Тетраэдры [SiO4]2 связаны друг с другом через общие атомы кислорода. Два соседних тетраэдра имеют лишь одну общую кислородную вершину. Ввиду разных углов у связей Si-O-Si и, следовательно, разной их энергии стекло плавится в температурном интервале. При введении катионов количество ионов О2– увеличивается и для размещения последних связи у общих кислородных вершин разрываются. Ионы Na+ (по Захариасену–Уоррену) размещаются неупорядоченно в полостях структурной сетки среди нескольких ионов О2– , преимущественно односторонне связанных с Si4+ (рис. 3.10). Этим сетка из [SiO4] дробится. Структура стекла при этом ослабляется, в результате чего температура размягчения, вязкость и химическая стойкость стекла снижаются. Такие сетки могут создаваться тетраэдрами [РО4], [АlO4] (в присутствии щелочей), [GeO4] и треугольниками [ВО3]. Надо отметить, что структурно-координационная теория рассматривает стекла как гомогенные вещества, тогда как они являются микрогетерогенными.
Рис. 3.10. Схема строения стекла по Захариасену–Уоррену Н.А. Шишаков в результате электронографических исследований пришел к выводу, что, вопреки структурно-координационной теории, стекла в основном состоят из двухкамерных кремнекислородных слоев с некоторым третьим измерением и присоединенными к ним другими катионами. Слои эти затем объединяются в агрегаты с местной упорядоченностью, образуя вторичную структуру стекла. Согласно кристаллитной теории А.А. Лебедева (1921 г.) структура стекла подобна кристаллической гальке, сплавленной так, что отдельные кристаллы разрушились не полностью, но не образуют новой фазы. Они соединяются промежуточным веществом с существенно более искаженной структурой. Кристаллы сложены из тетраэдров [SiO4] и полиэдров [МеОn], их размеры могут отличаться на 1,5…2,5 нм. Они могут увеличиваться в подходящих температурных условиях и кристаллизоваться. Кристаллиты, хотя и в искаженном виде, представляют собой решетки, имеют определенный состав и являются соединениями, что подтверждает наличие химической неоднородности в стекле. Типы структуры кристаллитов обусловлены не только положением частиц и составом стекла, но и температурой и временем воздействия при термической обработке. Таким образом, «двухкамер
|
||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-28; просмотров: 320; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.23.101.75 (0.017 с.) |







 определяется характеристическая температура интервала стеклования, называемая температурой стеклования Tg. Нередко температурой стеклования называют температуру, определенную по кривой нагревания (на рис. 3.5 – T¢g). Обычно T¢g на 10…15 К превышает Tg.
определяется характеристическая температура интервала стеклования, называемая температурой стеклования Tg. Нередко температурой стеклования называют температуру, определенную по кривой нагревания (на рис. 3.5 – T¢g). Обычно T¢g на 10…15 К превышает Tg.