Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Концепция цепных химических реакций.Содержание книги Поиск на нашем сайте
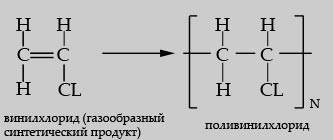
Цепные химические реакции – это процессы, в которых превращение исходных веществ в конечные продукты происходит путем регулярного чередования нескольких элементарных реакций с участием свободных радикалов. Сами же свободные радикалы в этих случаях являются активными центрами цепной реакции. Теории цепных химических реакций различных типов (обычные, разветвленные, вырожденно-разветвленные, с энергетическим разветвлением) были разработаны Семеновым (1896-1986). В общем случае цепная химическая реакция состоит из трех основных стадий – зарождения (инициирования), развития (продолжения) и обрыва (гибели). Зарождение цепи представляет собой образование свободных радикалов из валентно-насыщенных молекул, которое может происходить различными путями: мономолекулярный распад исходных веществ, гетерогенное зарождение цепи на стенках реакционного сосуда, фото- или радиационно-химическое инициирование, введение специальных инициаторов (пероксиды, азонитрилы и т.д.). Реакциями развития (продолжения) цепи называются элементарные реакции цепного процесса, в которых сохраняется свободная валентность активных центров и которые сопровождаются расходованием исходных реагентов и образованием конечных продуктов. Обычно стадии продолжения цепи состоит из двух или более элементарных реакций и может быть четырех типов: 1) реакция свободного радикала или атома с молекулой одного из исходных веществ, приводящая к образованию нового свободного радикала; 2) реакция свободного радикала или атома с молекулой одного из исходных веществ, приводящая к образованию молекулы конечного продукта и нового свободного радикала или атома; 3) мономолекулярное превращение одного свободного радикала цепи в другой; 4) мономолекулярный распад свободного радикала с образованием молекулы продукта реакции и нового свободного радикала или атома. Обрывом цепи является стадия процесса, приводящая к гибели свободной валентности активного центра. Обрыв цепи может иметь линейный характер, когда скорость элементарных реакций обрыва цепи прямо пропорциональна концентрации свободных радикалов (гибель радикалов на стенках реакционного сосуда, взаимодействие с валентно-насыщенными молекулами, например, на молекулах ингибитора). В дальнейшем Семеновым было показано, что в некоторых цепных процессах наряду с элементарными реакциями продолжения цепи, происходят реакции, идущие с увеличением числа активных центров (атомов или радикалов). В целом, концепции теории цепных химических реакций приводят к следующим выводам. 1) Теория цепных химических реакций позволяет качественно и количественно объяснить и прогнозировать поведение весьма широкого круга химических превращений. 2) Теория цепных химических реакций основана на современных физических концепциях о строении вещества и передаче энергии между реагирующими частицами. 3) Скорость всех известных цепных химических реакций зависит от времени (даже при постоянстве концентраций исходных веществ, то соответствует начальным стадиям процесса). 4) Цепные реакции, скорость которых возрастает по экспоненциальному закону, при определенных условиях приводят к взрыву. 5) Характерной особенностью цепных химических реакций является наличие критических явлений, обусловленных изменениями различных физико-химических факторов (температуры, давления, состава реакционной смеси, размера реакционного сосуда, состояния его стенок и т.д.). В частности, такими критическими явлениями являются «нижний» и «верхний» пределы воспламенения, резкое изменение скорости реакции при незначительном изменении концентрации ингибитора и др. 6) Скорости некоторых цепных химических реакций и области воспламенения могут очень сильно зависеть от наличия в реакционной системе весьма незначительных концентраций примесей. 1.3. Высокомолекулярные соединения (ВМС, полимеры) – это сложные углеродосодержащие вещества с большими молекулярными массами, состоящие из большого числа повторяющихся звеньев. Помимо кислот, белков, жиров и углеводов, которые образуются естественными и искусственными путями, в органическом мире значительное место занимают не относящиеся к живому миру полимеры, получаемые в ходе промышленного производства. Молекула полимера – макромолекула, в которой соединилось n молекул мономера (низкомолекулярные вещества), где n - степень полимеризации. Многократно повторяющиеся группы атомов в макромолекуле – структурные звенья. Основные методы синтеза ВМС – полимеризация и поликонденсация. В процессе полимеризации мономеры соединяются друг с другом ковалентными связями, образуя полимер. Поликонденсация - метод синтеза полимеров, основанный на реакциях замещения взаимодействующих между собой мономеров и/или олигомеров и сопровождается выделением побочных низкомолекулярных соединении; Полимеризация низкомолекулярных веществ является одним из типичных представителей цепных химических реакций, каждая из которых состоит из нескольких основных стадий – зарождения, развития (роста) и обрыва цепи. Тип цепной полимеризации определяется природой активных центров (промежуточных частиц), участвующих в каждой стадии процесса. Такими центрами могут быть ионы (катионы или анионы) или свободные радикалы. В первом случае протекает ионная, а во втором – радикальная полимеризация. По типу строения цепных молекул высокомолекулярные соединения классифицируются на линейные, разветвленные и сшитые (или сетчатые). Типичными представителями линейных полимеров являются полиэтилен, полипропилен, поликапроамил («капрон»). К сетчатым полимерам относится натуральный каучук, представляющий собой (в результате процесса вулканизации с участием атомов серы) высокоэластичную сетку. К промышленно значимымполимерам относятся: полиэтилен и полипропилен – мягкие, пластичные, термопластичные, механически прочные материалы, электроизоляторы, химически устойчивые, не растворяются в ацетоне, бензоле, при сильном нагревании разлагаются. Используются для изготовления труб, сосудов, аппаратов, предметов быта; Получение полиэтилена. Сырьем для полиэтилена служит газ этилен. Полиэтилен синтезируют путем полимеризации этилена при высоком и низком давлениях. Полиэтилен – это длинная цепочка атомов углерода, к каждому из которых присоединены два атома водорода. Как правило, полиэтилен выпускают в виде гранул диаметром 2-5 миллиметров (намного реже порошка). ПЭ относится к классу полиолефинов. Существует два основных класса полиэтиленов: полиэтилен высокого давления (низкой плотности) – LDPE и низкого давления (высокой плотности) – HDPE. Полиэтилен низкого давления по сравнению с полиэтиленом высокого давления более механически прочен и термостоек, но менее эластичен и непригоден для изготовления пищевой посуды, так как содержит остатки металлосодержащего катализатора. Его широко применяют для выработки галантерейных изделий. Изделия из полиэтилена отличаются легкостью, прочностью к ударам, красивым внешним видом, не подвержены коррозии. Существенным недостатком полиэтилена является его старение под действием света, тепла, кислорода воздуха, в результате чего повышается его жесткость, хрупкость, понижается растяжимость пленок из полиэтилена. Полиэтилен используется для изготовления расчесок, мыльниц, пуговиц, скатертей, сумок, массажных щеток и других изделий. Полипропилен по внешнему виду и свойствам сходен с полиэтиленом, но отличается повышенной жесткостью, большей механической прочностью и более высокой теплостойкостью (температура его плавления 160-170°). У изделий из полипропилена блестящая поверхность, а пленки из него прозрачнее полиэтиленовых. Горит полипропилен слабо коптящим пламенем с подтеканием полимера и выделением запаха жженой резины. Из полипропилена вырабатывают пряжки для одежды и обуви, пуговицы для белья и верхней одежды, расчески, всевозможные футляры, бритвенные приборы, а также изделия из пленки - скатерти, коврики и др. политетрафторэтилен – механически прочный, по химической устойчивости превосходит все металлы, не горит, диэлектрик, выдерживает температуру до 260 ºС. Используется для изготовления антипригарного покрытия кухонной посуды, известен под коммерческим названием Teflon; поливинилхлорид (ПВХ) – мягкий, эластичный, при охлаждении становится твердым и хрупким, не растворяется в ацетоне и бензоле, горит, образуя хрупкий шарик. Используется для производства искусственной нити, в качестве изоляционного материала;
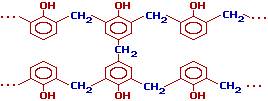
Поливинилхлорид — (ПВХ, pvc) пластмасса белого цвета, термопластичный полимер винилхлорида. Отличается химической стойкостью к щелочам, минеральным маслам, многим кислотам и растворителям. Не горит на воздухе, но обладает малой морозостойкостью (–15°С). Нагревостойкость — +65°С. В нормальных условиях трубы из поливинилхлорида отличаются экологичностью, однако, утилизация поливинилхлорида сопряжена с рядом проблем, одной из которых является выделение высокотоксичных хлорсодержащих веществ при его сжигании. полистирол – твердый, хрупкий, прозрачный материал, горит коптящим пламенем. Применяется для изготовления электроизоляционных материалов, пенопластов, бытовых изделий; бывает вспененный. Из полистирола вырабатывают также пленки и пористые материалы. Полистирольные пленки очень морозостойки и устойчивы к действию солнечного света. Пористый полистирол используется в качестве звуко и теплоизоляционных материалов. полиметилметакрилат – твердый, прозрачный, растворим в бензоле и дихлорэтане. Используется для производства органического стекла и других прозрачных пластмасс; Листовой полиметилметакрилат носит название оргстекло. Полиметилметакрилат легко поддается механической обработке (сверлению, строганию и др.). Полиметилметакрилат в чистом виде, а также в сочетании с красителями и наполнителями широко применяют для изготовления различных товаров широкого потребления, в том числе галантерейных товаров - пуговиц, пудрениц, расчесок, ваз, бус, брошей и др. фенолформальдегидные смолы – твердые, хрупкие, горят с сильным запахом фенола, не растворяются в ацетоне, бензоле, дихлорэтане. Применяются для изготовления фенопластов. Продукты поликонденсации фенола с формальдегидом. Реакция проводится в присутствии кислых (соляная, серная, щавелевая и другие кислоты) или щелочных катализаторов (аммиак, гидроксид натрия, гидроксид бария). При избытке фенола и кислом катализаторе образуется линейный полимер – новолак, цепь которого содержит приблизительно 10 фенольных остатков, соединенных между собой метиленовыми мостиками:
Фенолоформальдегидные полимеры применяются в виде прессовочных композиций с различными наполнителями (фенопласты), а также в производстве лаков и клея.
К эфироцеллюлозным пластмассам относят целлулоид и ацетоллоид (целлон). Это термопластичные, полупрозрачные, бесцветные или окрашенные в различные цвета пластики, гибкие и легкие. Целлулоид - твердый, упругий, прочный пластик, особенно устойчив к ударным нагрузкам. Целлулоид легко окрашивается, в том числе под мрамор, перламутр, черепаху, слоновую кость. Его поверхность хорошо полируется, приобретая красивый глянец. При трении целлулоид легко электризуется. При температуре 60-90°С он легко воспламеняется, горит быстро ярким белым пламенем, издавая запах камфары. Целлулоид способен к самовоспламенению под воздействием солнечных лучей и сильных ударов. Поликарбонат - прозрачный твердый и жесткий полимер, обладает высокой химической и термической стойкостью (плавится при 220-310°С), нечувствителен к ударам, сохраняет гибкость при низких температурах (до -75°С). Горят поликарбонаты лишь при высоких температурах, с копотью, вне пламени гаснут. Поликарбонаты - перспективные материалы для изготовления самых разных изделий. Среди новых конструкционных материалов, необходимых для ускорения технического прогресса во многих отраслях народного хозяйства, видное место занимает полимерная продукция и производство полимерных материалов. Пластмассами называют искусственные материалы, получаемые на основе органических полимерных связующих веществ. В пластмассах дисперсионной средой (матрицей) является полимер, а дисперсной фазой - наполнитель. Полимерная продукция с линейными и разветвленными молекулами (термопласты) являются более пластичными и термопластичными. Они способны многократно размягчаться и затвердевать при нагреве и охлаждении в отличие от полимеров с сетчатыми макромолекулами I (реактопласты), которые после затвердевания не размягчаются под влиянием нагрева. Их нельзя использовать повторно. Концепция лазерной химии. Одним из разделов современной химии является лазерная химия. Она начала развиваться в 60-ые годы ХХ века после открытия лазеров – устройств, преобразующих различные виды энергии (электрическую, световую, химическую, тепловую и др.) в энергию когерентного электромагнитного излучения (это колебания, описываемые гармоническими функциями, например, синусоидальной). Само название «ЛАЗЕР» («LASER») является аббревиатурой слов английской фразы: Light Amplification Stimulated Emission of Radiation (усиление света в результате вынужденного излучения). Принцип работы лазера состоит, во-первых, в переводе квантовой системы – источника лазерного излучения – в возбужденное состояние (в результате интенсивного поглощения энергии атомом вещества) путем воздействия на него источника энергии (накачка лазера), и, во-вторых, испускания этой возбужденной квантовой системой электромагнитного излучения. В зависимости от типа лазера в качестве источника генерируемого излучения используются различные вещества: твердые (стекла, рубины, гранаты), в которые добавляют соединения, содержащие легко возбуждаемые атомы, а также растворы красителей или атомы благородных металлов. Подбирая частоту лазерного излучения, можно менять глубину его проникновения в зону химической реакции. Основное значение при этом имеет высокая однородность (монохроматичность) излучения, позволяющая избирательно активировать определенные молекулы в реакционной смеси. Другими словами, механизм лазерной химии заключается в избирательной активации определенных химических связей лазерным излучением, что, в конечном счете, должно приводить к образованию веществ с заданными свойствами. Таким образом, можно сделать вывод, что лазерная химия является одним из эффективных методов инициирования (или активации) химических процессов. 1.5. Химия экстремальных состояний как направление в химии появилась в середине 19 века благодаря экспериментам К. де Латура. Основным предметом выступают исследования химических процессов в сверхкритических средах. В качестве первой и основной экспериментальной среды выступала вода, затем к ней добавились (по мере определения критической точки) диоксид углерода, ксенон, этанол, этан, этилен, аммиак, оксид одновалентного азота. Значительную роль имеет использование сверхкритических сред для осуществления каталитических реакций, в которых катализатор проявляет наибольшую устойчивость. При взаимодействии реагентов с катализатором происходит ослабление исходных химических связей. Оно возможно при энергетической активизации реагента, которая достигается при тепловом либо радиоактивном воздействии. Вопросами энергетической активизации реагента занимается современная химия экстремальных состояний, которая включает плазмохимию, радиационную химию, химию высоких энергий, высоких давлений и температур. Сверхкритическим флюидом (СКФ) — называют состояние вещества, при котором исчезает различие между жидкой и газовой фазой. Любое вещество, находящееся при температуре и давлении выше критической точки является сверхкритическим флюидом. Свойства вещества в сверхкритическом состоянии промежуточные между его свойствами в газовой и жидкой фазе. Так, СКФ обладает высокой плотностью, близкой к жидкости, и низкой вязкостью, как и газы. Коэффициент диффузии при этом имеет промежуточное между жидкостью и газом значение. Вещества в сверхкритическом состоянии могут применяться в качестве заменителей органических растворителей в лабораторных и промышленных процессах. Наибольший интерес и распространение в связи с определенными свойствами получили сверхкритическая вода и сверхкритический диоксид углерода. Одно из наиболее важных свойств сверхкритического состояния — это способность к растворению веществ. Изменяя температуру или давление флюида можно менять его свойства в широком диапазоне. Так, можно получить флюид, по свойствам близкий либо к жидкости, либо к газу. Растворяющая способность флюида увеличивается с увеличением плотности (при постоянной температуре). Сверхкритическая флюидная экстракция — технологический процесс, заключающийся в переводе одного или нескольких компонентов твердой или жидкой смеси в «сверхкритический газ»-флюид. Производится контактированием смеси разделяемых компонентов с газообразным экстрагентом при температуре и давлении выше критической точки. Наибольшее распространение в качестве экстрагентов (растворителей) получили СО2, этан, этилен, пропан, SF6 и др. Использование в качестве растворителя флюидов в сверхкритическом состоянии позволяет осуществлять углублённую переработку исходного сырья в различных индустриях: нефтехимической, пищевой, парфюмерной, фармацевтической и других отраслях промышленности. Сверхкритическая экстракция — относительно новый процесс; изучение и исследования в этой области активно проводятся с начала 1970-х гг. Основное число работ посвящено извлечению различных веществ сверхкритического СО2 из-за его высокой растворяющей способности, дешевизны, доступности, нетоксичности и невысоких критических параметров (критическая температура 31,3 °С, критическое давление 7,36 МПа). Технология Использование сверхкритических флюидов в процессах экстракции основано на высокой растворяющей способности различных сжатых газов, которая может быть сравнимой с растворяющей способностью жидких органических растворителей, а также на том факте, что растворяющая способность флюида в близкритической области претерпевает значительные изменения при малых изменениях температуры и давления. Это в свою очередь позволяет проводить углублённое фракционирование исходного сырья и регенерацию растворителя без дополнительных энергетических затрат путём дросселирования флюида до давления, при котором растворимость пренебрежимо мала. Сверхкритическую флюидную экстракцию осуществляют, как правило, по схеме двухстадийного непрерывного процесса в аппаратах высокого давления, например в тарельчатых колоннах. На первой стадии сверхкритический газ контактирует с жидкой или твердой смесью, извлекая растворимые компоненты. На второй стадии экстрагент регенерируют путем сброса давления или изменения температуры, что приводит к полному осаждению извлеченных веществ. Затем рабочие параметры газа изменяют до требуемых значений и снова направляют его на первую стадию, организуя циркуляцию экстрагента. Используют для экстрагирования (извлечения) веществ из лекарственных растений, чтобы максимально сохранить их свойства. Например, при изготовлении биологически активных добавок (веществ) (БАД). Важное промышленное значение приобрело использование диоксида углерода в качестве сверхкритической среды. Это обеспечивает экстракцию кофеина, получение фармацевтических препаратов, химическую чистку материалов, нанесение лакокрасочных покрытий и пленок, получение полимеров, сушку аэрогелей, приготовление пеноматериалов. Сверхкритические состояния воды имеют важное экологическое значение при обезвреживании органических отходов, извлечении тяжелых металлов, переработке радиоактивных жидких отходов, разложении синтетических полимеров и диоксинов. Жи́дкие криста́ллы (сокращённо ЖК) — вещества, обладающие одновременно свойствами как жидкостей (текучесть), так и кристаллов (анизотропия). По структуре ЖК представляют собой жидкости, похожие на желе, состоящие из молекул вытянутой формы, определённым образом упорядоченных во всем объёме этой жидкости. Подходящая аналогия для таких жидких кристаллов — длинная коробка с короткими карандашами, которые могут свободно поворачиваться вокруг своей оси, перемещаться вдоль коробки, но никогда не встают поперек. Наиболее характерным свойством ЖК является их способность изменять ориентацию молекул под воздействием электрических полей, что открывает широкие возможности для применения их в промышленности. По типу ЖК обычно разделяют на две большие группы: нематики и смектики. Важнейшее свойство жидких кристаллов — изменять цвет под воздействием температуры — используется для обнаружения невидимых простым глазом тепловых полей. В 1965 г. в США собралась Первая международная конференция, посвящённая жидким кристаллам. В 1968 г. американские учёные создали принципиально новые индикаторы для систем отображения информации. Принцип их действия основан на том, что молекулы жидких кристаллов, поворачиваясь в электрическом поле, по-разному отражают и пропускают свет. Под воздействием напряжения, которое подавали на проводники, впаянные в экран, на нём возникало изображение, состоящее из микроскопических точек. И всё же только после 1973 г., когда группа английских химиков под руководством Джорджа Грея (англ. George William Gray) синтезировала жидкие кристаллы из относительно дешёвого и доступного сырья, эти вещества получили широкое распространение в разнообразных устройствах. У ЖК необычные оптические свойства. Нематики и смектики — оптически одноосные кристаллы. Нематич. жидкие кристаллы (нематики N) характеризуются наличием ориентационного порядка, при котором длинные оси молекул расположены однонаправленно при беспорядочном расположении центров тяжести молекул (рис. 1,в). Холестерич. тип мезофазы (холестерики Сhоl) образуется двумя группами соед.: производными оптически активных стероидов, гл. обр. холестерина (отсюда назв.), и нестероидными соед., принадлежащими к тем же классам соед., к-рые образуют нематич. жидкие кристаллы, но обладающими хиральностью (алкил-, алкокси-, ацилоксизамещенные азометины, производные коричной к-ты, азо- и азоксисоединения и др.). В холестерич. жидких кристаллах молекулы расположены так же, как в нематических, но в каждом слое молекулы повернуты относительно их расположения в соседнем слое на определенный угол. В целом реализуется структура, описываемая спиралью (рис. 2). Холестерики вследствие периодического строения сильно отражают свет в видимой области спектра. Поскольку в нематиках и холестериках носителями свойств является жидкая фаза, то она легко деформируется под влиянием внешнего воздействия, а так как шаг спирали в холестериках очень чувствителен к температуре, то, следовательно, и отражение света резко меняется с температурой, приводя к изменению цвета вещества. Эти явления широко используются в различных приложениях, например, для нахождения горячих точек в микроцепях, локализации переломов и опухолей у человека, визуализации изображения в инфракрасных лучах и др. С помощью жидких кристаллов обнаруживают пары́ вредных химических соединений и опасные для здоровья человека гамма- и ультрафиолетовое излучения. На основе жидких кристаллов созданы измерители давления, детекторы ультразвука. Но самая многообещающая область применения жидкокристаллических веществ — информационная техника. В смектич. жидких кристаллах (их наз. смектиками, обозначают S) молекулы располагаются в слоях. Центры тяжести удлиненных молекул находятся в равноотстоящих друг от друга плоскостях и подвижны в двух измерениях (на смектич. плоскости). Длинные оси молекул могут располагаться как перпендикулярно к плоскости смектич. слоя (ортогональные смектики, рис. 1,а), так и под нек-рым углом к слою (наклонные смектики, рис. 1,б).
Рис. 1. Структура смектических (а и б)и нематических (в) жидких кристаллов (а - ортогональное, б - наклонное расположение молекул). От первых индикаторов, знакомых всем по электронным часам, до цветных телевизоров с жидкокристаллическим экраном размером с почтовую открытку прошло лишь несколько лет. Такие телевизоры дают изображение весьма высокого качества, потребляя ничтожное количество энергии от малогабаритного аккумулятора или батарейки. Пластические кристаллы и аморфные вещества также производит современная химия. Плазмохимия изучает процессы в низкотемпературной плазме. В плазмохимии рассматриваются процессы при температурах от 1000 до 10 000 ºС. Такие процессы характеризуются возбужденным состоянием частиц, столкновениями молекул с заряженными частицами и, что особенно важно, очень высокими скоростями реакций. В плазмохимических процессах скорость перераспределения химических связей очень высока: длительность элементарных актов химических превращений составляет около 10 с. Плазмохимические процессы поэтому очень высокопроизводительны. Метановый плазмотрон с производительностью 75 т ацетилена в сутки имеет сравнительно крохотные размеры – длину 65 см и диаметр 15 см. Такой плазмотрон заменяет огромный завод. При температуре 3000-3500 ºС за одну десятитысячную долю секунды 80% метана превращается в ацетилен. Степень использования энергии достигает 90-95%, а энергозатраты составляют не более 3кВтч на 1 кг ацетилена. В паровом реакторе пиролиза метана энергозатраты вдвое больше. Создается плазмохимическая технология производства мелкодисперсных порошков – основного сырья для порошковой металлургии. Разработаны методы синтеза карбидов, нитридов, карбонитридов таких металлов, как титан, цирконий, ванадий, ниобий и молибден, при энергозатратах не более 1-2 кВтч на 1 кг. Таким образом, химия высоких энергий направлена на существенную экономию энергии. Созданы плазменные сталеплавильные печи, выдающие высококачественный металл. Разработаны методы ионно-плазменной обработки поверхности инструментов, износостойкость которых увеличивается в несколько раз. Плазмохимия позволяет синтезировать такие ранее не известные материалы, как металлобетон, в котором в качестве связывающего вещества используются сталь, чугун, алюминий. Металлобетонные контейнеры для длительного хранения и транспортирования отходов ядерного топлива (ОЯТ). Плазменные технологии расширяют возможности переработки отходов. Радиационная химия – сравнительно молодая отрасль химии экстремальных состояний, ей немного более 40 лет. В настоящее время радиационная химия изучает превращение самых разнообразных веществ под действием ионизирующих излучений. Источниками ионизирующего излучения служат рентгеновские установки, ускорители заряженных частиц, ядерные реакторы, радиоактивные изотопы. В результате радиационно-химических реакций из кислорода образуется озон. Облучение полиэтилена, поливинилхлорида и многих других полимеров приводит к повышению их термостойкости и твердости. Наиболее важными процессами радиационно-химической технологии являются полимеризация, вулканизация, производство композиционных материалов, получение полимербетонов путем пропитки обычного бетона тем или иным мономером с последующим облучением. Такие бетоны имеют в четыре раза более высокую прочность, обладают водонепроницаемостью и высокой коррозийной стойкостью. Полимербетон (пластбетон, пластоцемент) — общее название бетонов, содержащих в своём составе термореактивное органическое связующее (обычно эпоксидную смолу) и большое количество дисперсного наполнителя (талька, аэросила, толчёного кварца, гранитной крошки и др.). Состав может называться пластоцементом если количество наполнителя более 50 %. По сравнению с цементными бетонами, полимерные и полимерцементные бетоны обладают большей прочностью на растяжение, меньшей хрупкостью, лучшей деформируемостью. У них более высокие водонепроницаемость, морозостойкость, сопротивление истиранию, стойкость к действию агрессивных жидкостей и газов. Известно,[1] что наполнение смол дисперсными наполнителями более 5 % резко понижает их прочностные свойства (в зависимости от степени наполнения). Пластоцементы никогда не используются в качестве композитов для деталей, находящихся под нагрузкой. Также цена пластоцементов значительно выше обычных неорганических цементных смесей, что определяет их узкую специализацию. Полимербетон еще называют «искусственный камень» из-за его прочности и внешнего сходства. Применяется полимербетон для герметизации резервуаров, шпатлёвки, грунтовки, при изготовлении наливных полов, для выравнивания неровностей и дефектов в металлических изделиях, в производстве мебели и как строительный материал.
|
||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 116; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.164.100 (0.014 с.) |