
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Обратимые и необратимые по направлению реакции. Понятие о химическом равновесии.Содержание книги
Поиск на нашем сайте Химические реакции часто протекают так, что исходные реагирующие вещества полностью превращаются в продукты реакции. Например, если в соляную кислоту опустить гранулу цинка, то при достаточном количестве кислоты реакция будет продолжаться до полного растворения цинка согласно уравнению: Однако необратимых реакций не так много. Большинство реакций обратимы.
Химическое равновесие имеет динамический характер. Скорость реакции (число частиц, образующихся в единицу времени и единице объема) в прямом направлении равна скорости реакции в обратном направлении. В условиях химического равновесия концентрации (или парциальные давления в случае газов) исходных веществ и продуктов реакции не изменяются во времени и называются равновесными концентрациями (или парциальными давлениями) веществ. В дальнейшем равновесные концентрации будем обозначать символом вещества в квадратных скобках. Например, равновесные концентарции водорода и аммиака будут обозначаться [Н2] и [NH3].Равновесное парциальное давление будем обозначать индексом р. Итак, термодинамическим условием химического равновесия является равенство энергии Гиббса химической реакции нулю, т.е. ∆G = 0 13. Константа химического равновесия и способы ее выражения: Кс, Кр, Ка Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями,концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии сзаконом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции. Для реакции в смеси идеальных газов константа равновесия может быть выражена через равновесные парциальные давлениякомпонентов pi по формуле[1]:
где νi — стехиометрический коэффициент (для исходных веществ принимается отрицательным, для продуктов — положительным). Kp не зависит от общего давления, от исходных количеств веществ или от того, какие участники реакции были взяты в качестве исходных, но зависит от температуры Например, для реакции окисления монооксида углерода:2CO + O2 = 2CO2 константа равновесия может быть рассчитана по уравнению:
В некоторых случаях (в зависимости от способа выражения) константа равновесия может являться функцией не только температуры, но и давления. Так, для реакции в смеси идеальных газов парциальное давление компонента может быть выражено по закону Дальтона через суммарное давление и мольную долю компонента (
Стандартная константа равновесия Стандартная константа равновесия реакции в смеси идеальных газов (когда начальные парциальные давления участников реакции равны их значениям в стандартном состоянии
где Стандартная константа равновесия — безразмерная величина. Она связана с Kp соотношением:
|
||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 580; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.006 с.) |


 Если реакция протекает в идеальном растворе и концентрация компонентов выражена через молярность ci, константа равновесия принимает вид:
Если реакция протекает в идеальном растворе и концентрация компонентов выражена через молярность ci, константа равновесия принимает вид: Для реакций в смеси реальных газов или в реальном растворе вместо парциального давления и концентрации используют соответственно фугитивность fi и активность ai:
Для реакций в смеси реальных газов или в реальном растворе вместо парциального давления и концентрации используют соответственно фугитивность fi и активность ai:

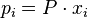 ), тогда легко показать[2], что:
), тогда легко показать[2], что: где Δn — изменение числа молей веществ в ходе реакции. Видно, что Kx зависит от давления. Если число молей продуктов реакции равно числу молей исходных веществ (
где Δn — изменение числа молей веществ в ходе реакции. Видно, что Kx зависит от давления. Если число молей продуктов реакции равно числу молей исходных веществ ( ), то
), то  .
. = 0,1013 МПа или 1 атм) может быть рассчитана по выражению:
= 0,1013 МПа или 1 атм) может быть рассчитана по выражению:
 — относительные парциальные давления компонентов,
— относительные парциальные давления компонентов, 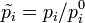 .
.



