
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Окружающая среда - совокупность компонентов природной среды, природных и природно-антропогенных объектов, а также антропогенных объектов (федеральный закон «об охране окружающей среды»,статья 1).Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Введение С точки зрения современной науки геофизическая оболочка Земли представляет собой ноосферу - сферу взаимодействия компонентов биосферы и человеческого общества. В результате с позиций человека и человеческого общества современная среда его обитания (окружающая среда) представляет собой совокупность природных объектов и объектов созданных волей и трудом людей (природно-антропогенных и антропогенных объектов). Таким образом, под «окружающей средой», понимается совокупность естественных и измененных природных условий обитания человека и производственной деятельности общества. В настоящее время в качестве приоритетного направления в снижении уровня воздействия технологических процессов на окружающую среду реализуется второй путь. Предметом данного курса будет изучение закономерностей различных процессов, используемых в промышленности для очистки пылегазовых выбросов и сбросов, обезвреживания и утилизации отходов. Необходимость изучения закономерностей этих процессов заключается в необходимости обеспечения оптимального проектирования технологических установок (аппаратов) для очистки выбросов, сбросов, обезвреживания и утилизации отходов.
Принципы нормирования воздействия на окружающую среду. Загрязнением компонента окружающей среды (атмосферы, воды, почвы, биологических ресурсов) обычно считают привнесение в среду новых, не характерных для нее физических, химических и биологических агентов или превышение естественного среднемноголетнего уровня этих агентов в среде. Загрязнителем могут быть любой физический агент, химическое вещество или биологический вид (в основном — микроорганизмы), попадающие в окружающую среду или образующиеся в ней в количествах, выше естественных. Загрязнением окружающей среды в настоящее время принято называть изменение качества среды, способное вызвать отрицательные последствия для существования природных объектов, природно-антропогенных и антропогенных объектов. Вследствие этого возникает необходимость определения параметров окружающей среды, которые обеспечивали бы устойчивое функционирование всех объектов окружающей среды. По происхождению загрязнения делят на природные, вызванные естественными, часто аномальными, процессами в природе, и антропогенные, связанные с деятельностью человека. Считается, что одинаковые виды загрязнений оказывают одинаковые отрицательные воздействия независимо от их происхождения, поэтому пыль, источником которой является природное явление (например, пыльные бури), должна считаться таким же загрязняющим веществом, как и пыль, выбрасываемая промышленным предприятием, хотя последняя может быть более токсичной в силу своего сложного состава. Загрязнения можно классифицировать следующим образом (таблица 1.1) [1]. Таблица 1.1. Классификация антропогенных видов загрязнений окружающей среды
Продолжение таблицы 1.1
Все перечисленные виды загрязнений взаимосвязаны, и каждый из них может явиться исходным фактором для возникновения других видов загрязнения. В частности, химическое загрязнение атмосферы может способствовать повышению вирусной активности и, следовательно, биологическому загрязнению.
В настоящее время в природоохранном законодательстве Российской Федерации существует понятие «благоприятная окружающая среда». Согласно Федеральному Закону «Об охране окружающей среды»,«благоприятная окружающая среда - окружающая среда, качество которой обеспечивает устойчивое функционирование естественных экологических систем, природных и природно-антропогенных объектов». В соответствие с этим в современном природоохранном законодательстве появляется необходимость установления и применения критериев, характеризующих требования к благоприятной окружающей среде и представляющих собой ограничения, вводимые на концентрации веществ и потоки энергий в окружающей среде (жизненном пространстве для человека и других видов живых организмов населяющих биосферу Земли). В настоящее время в качестве критериев благоприятной окружающей среды в природоохранной практике Российской Федерации применяют природоохранные нормативы, представляющие собойустановленные нормативы качества окружающей среды и нормативы допустимого воздействия на нее, при соблюдении которых обеспечивается устойчивое функционирование естественных экологических систем и сохраняется биологическое разнообразие. Нормативами качества окружающей среды являются нормативы, которые установлены в соответствии с физическими, химическими, биологическими и иными показателями для оценки состояния окружающей среды и при соблюдении которых обеспечивается благоприятная окружающая среда (Федеральный закон «Об охране окружающей среды», статья 1). Нормативы допустимого воздействия на окружающую среду - нормативы, которые установлены в соответствии с показателями воздействия хозяйственной и иной деятельности на окружающую среду и при которых соблюдаются нормативы качества окружающей среды (Федеральный закон «Об охране окружающей среды», статья 22). Научной основой для разработки нормативов качества окружающей среды является закон оптимума экологического фактора. Согласно данного закона, каждый экологический фактор имеет определенные пределы положительного влияния на живые организмы. Как недостаточное, так и избыточное действие фактора отрицательно сказывается на жизнедеятельности живых организмов. Таким образом природоохранные (экологические нормативы) должны определять предельно допустимые уровни изменения качества компонентов окружающей среды под действием антропогенной нагрузки. В настоящее время в качестве основных экологических нормативов качества окружающей среды используются гигиенические нормативы. Гигиенический норматив - установленное исследованиями допустимое максимальное или минимальное количественное или качественное значение показателя, характеризующего тот или иной фактор среды обитания с позиций его безопасности или безвредности для человека (Федеральный закон "О санитарно-эпидемиологическом благополучии населения", статья 1). Экологическими нормативами качества компонентов окружающей среды, характеризующими содержание в них загрязняющих (вредных) веществ являются предельно допустимые концентрации загрязняющих веществ в компонентах окружающей среды (атмосферный воздух, поверхностные и подземные воды, почвы, продукты питания). Предельно допустимые концентрации загрязняющих веществ (ПДК) - нормативы, отражающие предельно допустимое содержание вредных (загрязняющих веществ) при которых отсутствует вредное воздействие на здоровье человека и окружающую среду. В основе разработки предельно допустимых концентраций загрязняющих веществ лежит принцип лимитирующего показателя - нормирование по наиболее чувствительному показателю: • если запах или вкус ощущается при концентрациях, которые не оказывают вредного влияния на организм человека и внешнюю среду, то нормирование осуществляется с учетом порога их восприятия. • если вещество оказывает на окружающую среду вредное действие в меньших концентрациях, чем влияющие на организм человека, то при нормировании исходят из порога действия этого вещества на внешнюю среду.
Для нормирования допустимых физических (энергетических) воздействий применяют нормативы предельно допустимых уровней воздействия (ПДУ). Предельно допустимые уровни воздействия (ПДУ) - нормативы, которые установлены в соответствии с уровнями допустимого воздействия физических факторов на окружающую среду и при соблюдении которых обеспечиваются нормативы качества окружающей среды. В целом, конечная цель установления нормативов состоит в обеспечении научно обоснованного сочетания экологических, социальных и экономических интересов общества, то есть предельно допустимые нормативы — это своего рода компромисс между экологическими интересами и социально-экономической средой общества, компромисс вынужденный, позволяющий на взаимно заинтересованных началах развивать цивилизацию и охранять жизнь человека. Все нормативы качества окружающей среды подразделяются на три группы: · санитарно-гигиенические; · экологические; · вспомогательные. Цель нормативов первой группы - определить показатели качества компонентов окружающей среды применительно к здоровью человека. Это наиболее разработанная часть нормативов. Вторая группа устанавливает требования к источнику вредного воздействия, ограничивая его деятельность определенной пороговой величиной. Цель нормативов третьей группы в обеспечении единства в употребляемой терминологии, в деятельности организационных структур и правовом регулировании экологических отношений. Гидромеханические процессы
К гидромеханическим процессам, используемым для очистки выбросов и сбросов от нерастворимых в них загрязняющих веществ относятся: · отстаивание в поле сил тяжести (гравитационное разделение); · разделение в поле центробежных сил (центрифугирование); · разделение на пористых слоях (фильтрация).
Гравитационное разделение Процессы гравитационного разделения используются для очистки водных и газовоздушных потоков от взвешенных частиц твердой или жидкой фазы под действием силы тяжести. Частица массой (m)начинает двигаться в среде под действием силы тяжести если ее плотность (rч) отличается от плотности среды (r). Сила (Fос), под действием которой частица начинает двигаться, равняется разности между весом (Р) и выталкивающей силой (Fв). Для шарообразной частицы:
Если выталкивающая сила меньше веса частицы (rч>r), частица осаждается, если наоборот – частица всплывает. Скорость движения частицы (w) первоначально возрастает согласно закону равноускоренного движения:
При движении частицы в среде возникает обратно направленная сила сопротивления среды (Fс), которая уменьшает ее ускорение:
где z - коэффициент сопротивления среды, зависящий от режима обтекания частицы средой (ламинарный, переходный или турбулентный); S – площадь проекции тела на плоскость, перпендикулярную направлению движения. Для шарообразной частицы:
За счет сопротивления среды ускорение частицы становится равным нулю и частица начинает двигаться с постоянной скоростью, которая определяется из равенства:
Fос = Fс
Коэффициент сопротивления (x) зависит от режима движения частицы (ламинарный, переходный или турбулентный) и определяется значением критерия Рейнольдса (Re):
где m - кинематическая вязкость газа, Па/с При значении Re < 2 (ламинарный режим)
При значении Re от 2 до 500 (переходный режим)
При значении Re больше 500 (турбулентный режим) значение постоянно и равно 0,44.
Для расчета значения Re при неизвестной скорости осаждения частицы пользуются зависимость, предложенную Н.В. Лященко:
где Ar – критерий Архимеда:
Рассчитав по уравнению Лященко значение критерия Re можно определить скорость осаждения шарообразной частицы:
Скорости осаждения (всплытия) частиц нешарообразной формы (w’) будут меньше. Для определения скоростей осаждения (всплытия) используют поправочный коэффициент (коэффициент формы) j:
w’ = w×j (2.9)
Значения коэффициента j<1 и его определяют опытным путем. К примеру:
Для частиц нешарообразной формы определяющим линейным размером в критерии Re служит диаметр эквивалентного шара (dэ), равный диаметру шара, имеющего тот же объем, что и данная частица:
m – масса частицы
В реальных условиях, когда происходит осаждение (всплытие) множества частиц, скорость совместного движения частиц будет меньше, чем скорость движения отдельной, изолированной частицы. Причина – взаимодействие частиц и торможение их обратным потоком вытесняемой объемом частиц среды (газа или жидкости). Скорость стесненного движения (wст) зависит от объемной доли среды в системе (e):
где Vc, Vф – соответственно, объемы среды и осаждаемой фазы.
Для определения скорости стесненного осаждения (всплытия) используют интерполяционное уравнение, полученное при обобщении опытных данных:
Затем по рассчитанному значению критерия Re определяют скорость стесненного движения.
Скорость осаждения взвешенных частиц является основным параметром, используемым для расчета геометрических размеров аппаратов для очистки газовых и жидкостных потоков от взвешенных частиц (пылеосадительные камеры и отстойники) (рисунок 2.1).
Рисунок 2.1.
Продолжительность прохождения газа через осадительную камеру при его равномерном распределении по сечению равна:
где Vк,Vг – соответственно, объем камеры (м3) и объемный расход газа (м3/с); L – длина камеры, м; B – ширина камеры, м; H – высота камеры, м. За это же время под действием силы тяжести частица пройдет путь:
где w – скорость осаждения частицы, м/с.
Чтобы частица успела осесть в пылеосадительной камере, должно соблюдаться условие: h ³ H
Фракционная эффективность пылеосадительных камер (эффективность улавливания частиц определенных размеров) зависит от соотношения h/H. Если величина h больше или равна по величине Н, то частицы будут улавливаться в камере. Эффективность улавливания частиц данного размера можно выразить в виде:
wi – скорость осаждения частиц диаметром di.
Массообменные процессы Фазовое равновесие. Линия равновесия. Рассмотрим в качестве примера процесс массопередачи, в котором аммиак, представляющий собой распределяемый компонент, поглощается из его смеси с воздухом чистой водой, т. е. в виду отсутствия равновесия переходит из газовой фазы Фу, где его концентрация равна У, в жидкую фазу Фх, имеющую начальную концентрацию Х = 0. С началом растворения аммиака в воде начнется переход части его молекул в обратном направлении со скоростью, пропорциональной концентрации аммиака в воде и на границе раздела фаз. С течением времени скорость перехода аммиака в воду будет снижаться, а скорость обратного перехода возрастать, причем такой двусторонний переход будет продолжаться до тех пор, пока скорости переноса в обоих направлениях не станут равны друг другу. При равенстве скоростей установится динамическое равновесие, при котором не будет происходить видимого перехода вещества из фазы в фазу. При равновесии достигается определенная зависимость между предельными, или равновесными, концентрациями распределяемого вещества в фазах для данных температуры и давления, при которых осуществляется процесс массопередачи. В условиях равновесия некоторому значению Хотвечает строго определенная равновесная концентрация в другой фазе, которую обозначим через У*. Соответственно концентрации Уотвечает равновесная концентрация Х *. В самом общем виде связь между концентрациями распределяемого вещества в фазах при равновесии выражается зависимостью: У* = f(X) (3.1) или X* = j (У) (3.2)
Любая из этих зависимостей изображается графически линией равновесия, которая либо является кривой, как показано на рисунке 3.1, либо в частном случае - прямой линией. На рисунке 3.1а показана равновесная кривая для системы с компонентами-носителями, выражающая зависимость равновесной концентрации, например в газовой фазе, от концентрации жидкой фазы при Р = const и t = const. На рисунке 3.1 б приведен пример равновесной кривой для процесса ректификации, построенной при Р = const. Каждая точка кривой, как показано на рисунке соответствует разным температурам (t1, t2 и т. д.). Отношение концентраций фаз при равновесии называется коэффициентом распределения:
Коэффициент распределения выражает тангенс угла наклона линии равновесия и для кривой линии равновесия является величиной переменной. Конкретный вид законов равновесного распределения, выражающих зависимости (3.1) и (3.2), различен для разных процессов массопередачи. Так, например, в процессе абсорбции при низких концентрациях распределяемого вещества в исходном растворе равновесие описывается законом Генри, для идеальных растворов в процессах ректификации - законом Рауля и т. д. Зная линию равновесия для конкретного процесса и рабочие, т. е. неравновесные концентрации фаз в соответствующих точках, можно определить направление и движущую силу массопередачи в любой точке аппарата. На основе этих данных может быть рассчитана средняя движущая сила, а по ней - скорость процесса массопередачи.
Процесса. Вид функции Y = f(X ) или уравнение рабочей линии в его общем виде, является одинаковым для всех массообменных процессов и получается из их материальных балансов. Рассмотрим схему массообменного аппарата, работающего в режиме идеального вытеснения при противотоке фаз (рисунок 3.2). Пусть в процессе массопередачи из фазы в фазу, например из газовой фазы в жидкую, переходит только один распределяемый компонент. Сверху в аппарат поступает Lн кг/сек одной фазы (жидкой), содержащей Хн массовых долей распределяемого компонента, а снизу из аппарата удаляется Lк кг/сек той же фазы, содержащей Хк массовых долей распределяемого компонента. Снизу в аппарат поступает Gн кг/сек другой фазы (газовой) концентрацией Уни сверху удаляется Gк кг/сек этой фазы, имеющей концентрацию Укмассовых долей распределяемого компонента. Тогда материальный баланс по всему веществу
Gн + Lн = Lк + Gк (3.4)
и материальный баланс по распределяемому компоненту
Gн× Ун + Lн× Хн = Lк× Хк + Gк× Ук (3.5)
Уравнение материального баланса для части аппарата от его нижнего конца до некоторого произвольного сечения, для которого расходы фаз составляют G и L кг/сек, а их текущие концентрации равны Уи Хсоответственно. Материальный баланс по всему веществу Gн + L = Lк + Gк (3.6)
и материальный баланс по распределяемому компоненту
Gн× Ун + L× Х = Lк× Хк + G× У (3.7)
Решая это уравнение относительно У, получим
Уравнение (3.8) представляет собой уравнение рабочей линии, выражающее связь между рабочими концентрациями распределяемого компонента в фазах для произвольного сечения аппарата.
Если концентрации фаз мало изменяются по высоте аппарата, то расходы фаз по его высоте можно с достаточной для практических целей точностью считать постоянными, т. е. принять L = const и G = const. В этом случае уравнение (3.8) приходит к виду:
Вводя обозначения
У = А×Х +В
Таким образом, рабочая линия представляет собой прямую, которая наклонена к горизонту под углом, тангенс которого равен А, и отсекает на оси ординат отрезок, равный В. Рабочая линия для всего аппарата ограничена точками с координатами Хн и Ук(верхний конец аппарата, рисунок 3.2) и Ук и Хн(нижний конец аппарата). Если расходы фаз значительно изменяются по высоте аппарата, то материальные балансы по компоненту- носителю для части аппарата от его нижнего конца до произвольного сечения (где концентрации фаз равны Х и У) выражаются уравнениями:
откуда
Подставив значения L и G в общее уравнение материального баланса (3.7) и после соответствующих преобразований, получим
Из уравнения полученного уравнения следует, что в рассматриваемом случае рабочая линия криволинейна. Направление массопередачи. Распределяемое вещество всегда переходит из фазы, где его содержание выше равновесного, в фазу, в которой -концентрация этого вещества ниже равновесной. Направление переноса распределяемого вещества, т. е. направление массопередачи, можно определить с помощью линии равновесия и рабочей линии (рисунок 3.3).
Пусть массопередача происходит между фазами Фхи Фу, рабочие концентрации которых равны Х и Усоответственно. Если рабочая линия расположена ниже линии равновесия {рисунок 3.3 а), то для любой точки, например точки А рабочей линии, У< У * и Х> Х *, где У * и Х* - равновесные концентрации. Следовательно, распределяемое вещество (компонент) будет переходить в этом случае из фазы Фхв фазу Фу. Перенос в таком направлении происходит, например, в процессе ректификации, где более летучий компонент переходит из жидкой фазы ( Фхв паровую Фу ). Если же рабочая линия расположена выше линии равновесия (рисунок 3.3 б), то для произвольно выбранной на рабочей линии точки А концентрация У > У*и Х< Х*. При этом распределяемый компонент будет переходить из фазы Фу в фазу Фх. В качестве примера такого направления массопередачи можно указать на направление переноса в процессе абсорбции, где распределяемый компонент (поглощаемый газ) переходит из газовой фазы (Фу) в жидкую (Фх). Таким образом, на У - Х -диаграмме направление процесса массопередачи может быть определено по взаимному положению равновесной и рабочей линий. Скорость массопередачи Уравнение массопередачи. Как отмечалось, процесс массопередачи включает процессы массоотдачи в пределах каждой из двух взаимодействующих фаз и, кроме того, процесс переноса распределяемого вещества через поверхность раздела фаз:
где угр, хгр —концентрации на границе раздела соответствующих фаз; bу,bх— коэффициенты массоотдачи, выраженные соответственно через концентрации фаз У и Х; у, х - концентрациям распределяемого вещества в основной массе (ядре) фазы.
Сложность расчета процесса связана с тем, что практически невозможно измерить концентрации фаз непосредственно у границы их раздела. Учитывая это, основное уравнение массопередачи, определяющее количество М вещества, переносимого из фазы в фазу в единицу времени, выражают следующим:
где у*, х* — равновесные концентрации в данной фазе, соответствующие концентрациям распределяемого вещества в основной массе (ядре) другой фазы; Ку,Кх— коэффициенты массопередачи, выраженные соответственно через концентрации фаз У и Х; у, х - концентрациям распределяемого вещества в основной массе (ядре) фазы.
При такой форме записи уравнения массопередачи движущая сила процесса выражается разностью между рабочей и равновесной концентрацией (или наоборот), отражающей меру отклонения системы от состояния равновесия. Коэффициент массопередачи (Ку или Кх) показывает, какое количество вещества переходит из фазы в фазу за единицу времени через единицу поверхности контакта фаз при движущей силе массопередачи, равной единице. Следует подчеркнуть, что в условно принимаемых за движущую силу разностях концентраций (у — у*) или (х* —х) величины у* и х* представляют собой фактически не существующие в потоке предельные (равновесные) концентрации, значения которых можно найти в справочниках. Концентрации фаз изменяются при их движении вдоль поверхности раздела, соответственно изменяется движущая сила массопередачи. Поэтому в уравнение массопередачи вводят величину средней движущей силы (Dуср или Dхср). Тогда уравнения (3.21) принимают вид:
С помощью этих уравнений обычно находят поверхность контакта фаз F и по ней рассчитывают основные размеры аппарата. Для определения F необходимо предварительно рассчитать коэффициент массопередачи Ку или Кх и среднюю движущую силу. Величина М — количество вещества, переводящее из фазы в фазу в единицу времени, или нагрузка аппарата, либо задается при расчете, либо определяется из материального баланса.
Абсорбция Или растворимость газа (поглощаемого компонента А) в жидкости при данной температуре пропорциональна его парциальному давлению над жидкостью
где Р*А - парциальное давление поглощаемого газа, находящегося в равновесии с раствором, имеющим концентрацию ХА (в мол. долях); Х*А - концентрация газа в растворе (в мол. долях), равновесном с газовой фазой, в которой парциальное давление поглощаемого компонента равно РА; Е - коэффициент пропорциональности, называемый коэффициентом, или константой Генри.
Числовые значения коэффициента Генри для данного газа зависят от природы поглотителя и газа и от температуры, но не зависят от общего давления в системе. Значения Е увеличивается с увеличением температуры, поэтому процессы абсорбции часто проводят при возможно низких температурах. Парциальное давление Р*А, согласно закона Дальтона равно:
где У*А – мольная доля А в газовой смеси, равновесной с жидкой фазой; Р - общее давление в системе
и тогда Отношение Е/Р = m называется коэффициентом распределения или константой фазового равновесия. При сильном разбавлении любой раствор приближается к идеальному, поэтому закон Генри применим только в области разбавленных растворов и на практике применяется для описания процесса абсорбции плохо растворимых газов. Для хорошо растворимых газов этот закон применим только при относительно низких концентрациях. При более высоких концентрациях растворимость газов обычно ниже, чем следует из закона Генри. Примером хорошо растворимых газов являются аммиак NH3, фтористый водород HF, хлористый водород HCl; умеренно растворимых – диоксид серы SO2, хлор Cl2; плохо растворимых – кислород, азот, углекислый газ. При химическом взаимодействии растворяемого газа с жидким абсорбентов процесс абсорбции называется хемосорбцией. При хемосорбции концентрация абсорбируемого компонент в жидкой фазе быстро уменьшается за счет образования нового химического соединения, что приводит к соответствующему увеличению движущей силы и интенсификации процесса абсорбции. В результате скорость процесса химической абсорбции зависит не только от скорости массообмена, но и от скорости химической реакции взаимодействия поглощаемого компонента и абсорбента. Адсорбция Механизм процесса адсорбции Адсорбцией называется концентрирование вещества в поверхностном слое в результате его самопроизвольного перехода из объема фазы. Процесс адсорбции обычно наблюдается в 2-х фазных системах: · Газ – твердое; · Жидкость - твердое. Равновесие в процессе адсорбции определяется двумя процессами: 1. Притяжением молекул (ионов) к поверхности раздела фаз под действием межмолекулярных сил. 2. Тепловым движением, стремящимся восстановить равенство концентраций в поверхностном слое и объеме фазы. Количественно процесс адсорбции характеризуется числом молей или массой вещества, накапливающегося на границе раздела фаз в расчете на единицу площади или объема твердой фазы. Фундаментальным вкладом в учение об адсорбции явилась теория Ленгмюра. Эта теория позволяет учесть ограниченность адсорбционного объема или поверхности адсорбента по поглощаемому веществу. Ограниченность этого параметра приводит к адсорбционному насыщению поверхности адсорбента по мере увеличения концентрации распределяемого вещества. Это положение является основным в теории Ленгмюра и уточняется следующими допущениями: 1) адсорбция локализована (молекулы не перемещаются по поверхности) на отдельных адсорбционных центрах, каждый из которых взаимодействует только с одной молекулой адсорбата - образуется мономолекулярный слой; 2) адсорбционные центры энергетически эквивалентны - поверхность адсорбента эквипотенциальна; 3) адсорбированные молекулы не взаимодействуют друг с другом.
Для получения уравнения изотермы обратимся к основному положению теории Ленгмюра. Примем, что при адсорбции происходит квазихимическая реакция между распределяемым компонентом и адсорбционными центрами поверхности:
А* + В ↔АВ*
где А* - адсорбционные центры на поверхности адсорбента; В – адсорбируемые молекулы; АВ* - образующийся на поверхности комплекс.
По мере увеличения концентрации вещества В реакция сдвигается в сторону образования комплекса и свободных адсорбционных центров становится меньше. Константа адсорбционного равновесия (без учета коэффициентов активности реагирующих веществ) равна:
В этом соотношении С*АВ=А и С*А =А∞ - А, (2) где А – величина адсорбции (количество поглощенного вещества на единице поверхности или массы адсорбента); А∞ - максимальная емкость адсорбционного слоя. Подставляя уравнение (2) в уравнение (1), получим:
или
После преобразований:
окончательно получим
Выражение (3) называется уравнением изотермы адсорбции Ленгмюра. Так как концентрации газов и паров практически пропорциональны парциальным давлениям, то для них изотерма адсорбции Ленгмюра принимает вид:
где РВ – парциальное давление вещества В в газовой смеси. Необходимо отметить, что константа адсорбционного равновесия в уравнении Ленгмюра (К и КР) характеризует энергию взаимодействия адсорбата с адсорбентом. Чем сильнее это взаимодействие, тем больше константа адсорбционного равновесия. Важны экстраполяционные следствия из соотношений (3) и (4). При малых концент
|
|||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 595; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.27.225 (0.014 с.) |

 (2.1)
(2.1) (2.2)
(2.2) (2.3)
(2.3) (2.4)
(2.4)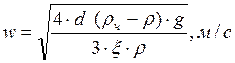 (2.5)
(2.5)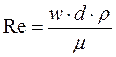 (2.6)
(2.6)
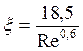
 , (2.7)
, (2.7)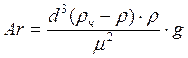 (2.8)
(2.8)
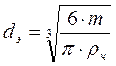 (2.10)
(2.10)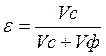 (2.11)
(2.11) (2.12)
(2.12)
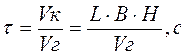 (2.13)
(2.13) (2.14)
(2.14) (2.15)
(2.15) (3.3)
(3.3)

 (3.8)
(3.8)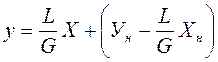 (3.9)
(3.9) и
и  , получаем уравнение прямой линии:
, получаем уравнение прямой линии: и
и  (3.10)
(3.10) и
и 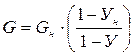 (3.11)
(3.11) (3.12)
(3.12)
 (3.20)
(3.20) (3.21)
(3.21)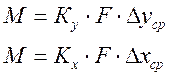 (3.22)
(3.22) ,
, ,
,

 (1)
(1)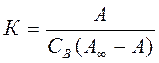


 (3)
(3) , (4)
, (4)


