Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Распределение электронов в атоме по состояниямСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
· Правила отбора для электронных переходов в атоме допускает только переходы с Δℓ=±1 и Δmℓ=0, ±1. Остальные переходы являются «запрещенными», а уровни, откуда такие переходы невозможны – метастабильными. Математически это выражается через Эйнштейновские коэффициенты Ank, которые характеризуют вероятность спонтанных переходов между n и k уровнями. Для разрешенных линий эти коэффициенты порядка 108 с-1, а для запрещенных линий миллион-миллиард раз меньше. Так как время жизни электрона в возбужденном состоянии обратно пропорционально Ank, то для разрешенных линий время жизни на верхних уровнях ~10-8 c (поэтому электроны там не задерживаются). Для метастабильных уровней это время порядка секунды или даже намного больше, поэтому, если электроны каким-то образом попадают на эти уровни, то они могут задерживаться там надолго. Но большое число накопление на таких уровнях возможно лишь при малой плотности вещества и излучения. Так как интенсивность спектральных линий прямо пропорционально Ank и плотности атомов в метастабильных условиях, то запрещенные линии могут достигнуть больших интенсивностей только при малой плотности вещества и излучения. Такие условия соблюдаются в коронах звезд (Солнца) и в планетарных (газовых) туманностях, где возбуждение запрещенных линии происходит вследствие электронных ударов. Кстати, именно в спектрах короны и туманностей впервые были обнаружены эти линии. Без принципа Паули электроны, стремясь попасть в положение с наименьшей энергией, опустились бы все на основной уровень, атомы резко сжались бы, плотность вещества увеличивалась бы в десятки и сотни раз, а химические свойства стали бы совершенно иными. Следует отметить, что данная теория является компромиссной – «полуквантовой» теорией, т.к., базируясь на квантовых исходных постулатах, она пользуется законами классической физики для описания движения электронов в атоме. Более точная, современная квантовая теория атома не устанавливает точного местоположения электрона в объеме атома, а рассматривает лишь вероятность нахождения электрона в том или ином месте объема. Периодическая система элементов Менделеева И распределение электронов по подоболочкам
Приложение 1 Самый легкий атом − позитроний До начала ХХв. были известны и использовались лишь стабильные, т.е. существующие практически неограниченное время элементы. С открытием радия началось изучение и использование тяжелых, нестабильных элементов. В данный момент открыт №118 элемент таблицы Менделеева. В 1951г. был открыт наилегчайший атом − позитроний (Ps), состоящий из позитрона и электрона. Его масса в 920 раз меньше атома водорода, а время существования − 10−10с. По атомным масштабам это довольно долгое время, т.к. электрон и позитрон до аннигиляции успевают обернуться вокруг общего центра тяжести около 1 млн. раз. За это время позитрон может проявлять себя разнообразными способами, и в частности, подобно атому водорода, вступать в различные химические реакции.
Строение позитрония аналогично строению водорода, однако, существуют некоторые отличия в их химических свойствах, которые возникают из-за того, что масса позитрона и электрона одинаковы и малы. Среднее расстояние электрона от позитрона в основном энергетическом состоянии позитрония примерно вдвое больше расстояния электрона от протона в атоме водорода (поэтому энергия распада позитрония вдвое меньше энергии ионизации атома водорода − 6,8эв). Существуют две разновидности позитрония: орто-позитроний (1PS -триплетный) и пара-позитроний (SPS -синглетный). В пара-позитронии собственные моменты вращения электрона и позитрона − спины − направлены антипараллельно, т.е. суммарный спин пара-позитронии равен нулю. Пара-позитроний превращается в два γ -кванта со временем жизни 1,25∙10−10с. В орто-позитронии спины электрона и позитрона направлены параллельно, т.е. его суммарный спин равен единице. Он аннигилирует с испусканием трех γ -квантов с гораздо большим временем жизни 1,4∙10−7с.
Обычные химические методы для изучения позитрония, очевидно, неприменимы, т.к. позитроний возникает в ничтожных количествах (порядка одного атома в 1см3).
§ 3.4. Радиоактивность
В 1896 году А.Беккерель совершенно случайно обнаружил самопроизвольное испускание солей урана излучения неизвестной природы, которое действовало на фотопластинку, ионизировало воздух, проникало сквозь тонкие металлические пластинки, вызывало люминесценцию ряда веществ. Это излучение назвали радиоактивным излучением, а само явление – испускание радиоактивного излучения радиоактивностью. Оказалось, что она не зависит от внешних воздействий, которые могут оказать влияние на состояния электронной оболочки атома. Следовательно, радиоактивность обусловлена лишь внутренней структурой атома, т.е. структурой ядра. Сейчас под радиоактивностью понимают способность некоторых атомных ядер самопроизвольно (спонтанно) превращаться в другие ядра с испусканием различных видов радиоактивных излучений и элементарных частиц. Наблюдаются два типа радиоактивности: естественная и искусственная. Естественная радиоактивность наблюдается у неустойчивых изотопов (с атомным номером Z>83), существующих в природе, а искусственная радиоактивность (открытая Фредириком и Ирен Жолио-Кюри в 1934г.) наблюдается у изотопов, полученных посредством ядерных реакции. Тем не менее, законы радиоактивного превращения в обоих случаях одинаковы: Радиоактивное излучение бывает 3 типов; α-,β- и γ- излучение α – излучение (α-частицы) это поток ядер гелия, с зарядом +2 е и массовым числом 4. Отклоняется электрическим и магнитным полями. Обладает высокой ионизирующей способностью и малой проникающей способностью (путь пробега в воздухе 3-9 см). Известно более 200 α-активных ядер в основном с А> 200 и Z> 82. Скорости вылетающих α-частиц имеют значения 14000 – 20000 км/с или кинетическую энергию – 4-9 Мэв. При испускании α-частицы заряд ядра уменьшается на 2 единицы, а массовое число на 4 единицы, а это означает, что химический элемент
Энергия Так как при Нейтрино и Потом уточнялось, что при При При
В отличии от Х- лучей, Ионизирующая способность
Спектр
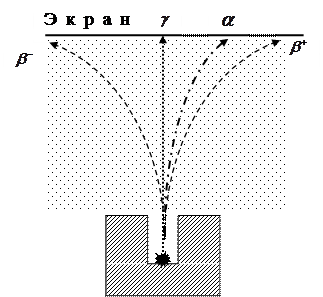
В природе не существует стабильных ядер с Z> 83: здесь играют роли принцип Паули + кулоновские силы. С появлением Z увеличивается отталкивающие силы Кулона, а вновь добавляемый протон занимает все более и более высокие энергетические состояния. В конце концов, энергия одного из этих состояний может превысить энергию расщепления ядра, так что ядро окажется нестабильным. На рисунке схематично показано отклонения радиоактивного излучения в магнитном поле, силовые линии которого перпендикулярны плоскости рисунка и направлены к нам (обозначены точками).
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 484; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.238.67 (0.009 с.) |



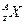 смещается в периодической системе на 2 номера влево с уменьшением A на 4 и превращается в элемент
смещается в периодической системе на 2 номера влево с уменьшением A на 4 и превращается в элемент  . Реакция этого перемещения пишется так:
. Реакция этого перемещения пишется так: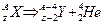
 -излучение (
-излучение ( -распаде) или антиэлектронов-позитронов (при
-распаде) или антиэлектронов-позитронов (при  -распаде). Отклоняется электрическим и магнитным полями, имеет значительно меньшую (по сравнению с α-частицами на ~2 порядка) ионизирующая способность и гораздо большую проникающая способность.
-распаде). Отклоняется электрическим и магнитным полями, имеет значительно меньшую (по сравнению с α-частицами на ~2 порядка) ионизирующая способность и гораздо большую проникающая способность. (как бы в ядре один из нейтронов превратился в протон).
(как бы в ядре один из нейтронов превратился в протон). (как бы в ядре один из протонов превратился в нейтрон).
(как бы в ядре один из протонов превратился в нейтрон). - излучение – это коротковолновое (
- излучение – это коротковолновое ( и поэтому ярко выраженными корпускулярными свойствами) электромагнитное излучение с
и поэтому ярко выраженными корпускулярными свойствами) электромагнитное излучение с  ~ 10-12 м,
~ 10-12 м, 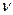 ~ 10 20 Гц,
~ 10 20 Гц,  ~ 1 Мэв (10 Кэв ÷5 Мэв), похожий на рентгеновских лучей.
~ 1 Мэв (10 Кэв ÷5 Мэв), похожий на рентгеновских лучей.