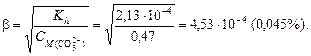Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Соль образована одним слабым электролитомСодержание книги
Поиск на нашем сайте
Константу гидролиза вычисляют по формуле:
где Kh, 1 - константа гидролиза по первой ступени, Kw - ионное произведение воды, равное 10-14 при 298 K; Kdn – последняя константа диссоциации слабого электролита. Константы диссоциации гидроксокомплексов металлов называют ступенчатыми константами нестойкости, их находят в справочнике в таблице констант нестойкости гидроксокомплексов. Степень гидролиза связана с константой гидролиза уравнением:
где С – концентрация гидролизующегося иона, моль/кг. В растворах солей, гидролизующихся по аниону, среда щелочная (см. уравнение (67)) и расчет рН ведут по формуле:
В растворах солей, гидролизующихся по катиону, среда кислая (см. уравнение (68)), расчет рН ведут по формуле
Соль образована двумя слабыми электролитами Константу гидролиза вычисляют по формуле:
где K осн и K к - константы диссоциации основания и кислоты, образующих соль. Формула (96) служит для расчета константы гидролиза по табличным значениям констант диссоциации. Степень гидролиза вычисляют по уравнению:
Отношение концентраций ионов Н+ и ОН- в растворе соли определяется относительной силой кислоты и основания:
где K к и K осн - константы диссоциации слабых кислоты и основания, которыми образована соль. Отсюда следует, что при 298 К (KW = 10-14):
Константа и степень гидролиза у соли, образованной двумя слабыми электролитами, значительно выше, чем у солей, образованных одним слабым электролитом. Примеры решения задач Пример 1. составить молекулярное и ионное уравнения гидролиза, указать характер среды для сульфата железа (II). Решение. 1. Напишем уравнение диссоциации соли: FeSO4 ® Fe2+ + SO42- 2. Определим сильный и слабый электролиты. Иону Fe2+ соответствует слабое основание Fe(OH)2, иону SO42- соответствует сильная кислота H2SO4, следовательно гидролиз идет по катиону. 3. Составим ионное уравнение гидролиза (по первой ступени!): Fe2+ + HOH ® FeOH+ + H+. В ходе гидролиза образуются ионы H+, среда кислая. 4. Составим молекулярное уравнение гидролиза и уравняем его как обычную реакцию обмена: 2 FeSO4 + 2H2O ® (FeOH)2SO4 + H2SO4. Пример 2. составить молекулярное и ионное уравнения гидролиза, указать характер среды для карбоната калия.
Решение. 1. Напишем уравнение диссоциации соли: K2CO3 ® K+ + CO32- 2. Определим сильный и слабый электролиты. Иону K+ соответствует сильное основание KOH, иону CO32- соответствует слабая кислота H2CO3, следовательно гидролиз идет по аниону. 3. Составим ионное уравнение гидролиза (по первой ступени!): CO32-+ HOH ® HCO3-+ OH-. В ходе гидролиза образуются ионы OH-, среда в растворе щелочная. 4. Составим молекулярное уравнение гидролиза и уравняем его как обычную реакцию обмена: K2CO3 + H2O ® KHCO3+ KOH. Пример 3. составить молекулярное и ионное уравнения гидролиза, указать характер среды для нитрита аммония. Решение. 1. Напишем уравнение диссоциации соли: NH4NO2 ® NH4+ + NO2-. 2. Определим сильный и слабый электролит. Иону NH4+ соответствует слабое основание NH4OH, иону NO2- соответствует слабая кислота HNO2, следовательно гидролиз идет как по катиону так и по аниону. 3. Составим ионное уравнение гидролиза: NH4+ + NO2- + HOH ® NH4OH + HNO2. 4. Составим молекулярное уравнение гидролиза и уравняем его как обычную реакцию обмена: NH4NO2 + H2O ® NH4OH + HNO2. Пример 4. Вычислить рН раствора сульфата аммония, концентрацией 0,1 моль/л. Решение. 1. Составим ионное уравнение гидролиза: NH4+ + H2O ® NH4OH + H+. 2. Значение константы диссоциации гидроксида аммония Kd = 1,76×10-5. Вычислим константу гидролиза:
3. Найдем концентрацию ионов аммония. Согласно уравнению диссоциации сульфата аммония (NH4)2SO4 ® 2 NH4+ + SO42-,
4. Вычислим концентрацию ионов [H+]:
и значение рН: рН = -lg[H+] = -lg(1,066×10-5) = 4,97. Пример 5. вычислить степень гидролиза карбоната натрия в растворе с рН = 12. Решение. 1. Составим ионное уравнение гидролиза: CO32- + H2O ® HCO3- + OH-. 2. Значение второй константы диссоциации угольной кислоты Kd 2 = 4,69×10-11. Вычислим первую константу гидролиза:
3. Из формулы где [OH-] = 10-pOH = 10-(14-12) = 10-2 4. Вычислим степень гидролиза
Задачи для решения I. Составить молекулярные и ионные уравнения гидролиза, указать характер среды 250. (NH4)2S 251. (NH4)2SO3 252. (NH4)3PO4 253. (ZnOH)2SO4 254. Al(NO3)3 255. Al2(SO4)3 256. Al2S3 257. AlCl3 258. Be(NO3)2 259. Ca(NO3)2 260. CdCl2 261. CH3COONH4 262. CoCl2 263. Cr(NO3)3 264. Cr2(SO4)3 265. CrCl3 266. Cs2SO4 267. CsF 268. CuSO4 269. Fe2(SO4)3 270. FeCl3 271. Fr2S 272. Ga(NO3)3 273. HCOOK 274. HCOONH4 275. K2SiO3 276. K2SO3 277. K3AsO4 278. KClO4 279. KCN 280. KH2AsO4 281. KHCO3 282. KMnO4 283. LiCN 284. MgCl2 285. MgSO4 286. MnCl2 287. Na2CO3
288. Na2HAsO4 289. Na2S 290. Na2SiO3 291. Na2WO4 292. Na3PO4 293. NaAlO2 294. NaCl 295. NaClO4 296. NaCN 297. NaH2PO4 298. NaHCO3 299. NaI 300. NaNO2 301. NH4Cl 302. NH4CNS 303. NH4HCO3 304. NH4NO2 305. NiSO4 306. Pb(CH3COO)2 307. Pb(NO3)2 308. PbCl4 309. Rb2S 310. Rb3PO4 311. Rb3SbO4 312. SbCl3 313. SnCl2 314. SnCl4 315. SnSO4 316. SrSO3 317. Zn(CH3COO)2 318. ZnBr II. Написать в молекулярном и ионном виде реакции взаимоусиления гидролиза 319. Ацетат меди + сульфит лития. 320. Ацетат свинца + карбонат натрия. 321. Ацетат цинка + сульфит натрия. 322. Нитрат алюминия + карбонат натрия. 323. Нитрат висмута + сульфид калия. 324. Нитрат железа (III) + сульфид рубидия. 325. Нитрат свинца + карбонат стронция. 326. Нитрат серебра + карбонат натрия. 327. Нитрат хрома (III) + сульфид меди. 328. Сульфат алюминия + сульфид натрия. 329. Сульфат бария + сульфит цезия. 330. Сульфат кобальта + карбонат калия. 331. Сульфат олова + карбонат цезия. 332. Формиат алюминия + карбонат натрия. 333. Формиат меди + сульфит лития. 334. Формиат цинка + сульфид лития. 335. Фосфат алюминия + карбонат калия. 336. Хлорид железа (II) + сульфид натрия. 337. Хлорид магния + сульфит рубидия. 338. Хлорид марганца + сульфит натрия. 339. Хлорид никеля + карбонат цезия.
III. Найти неизвестные величины
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 585; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.44.233 (0.007 с.) |

 ,
,
 ,
,
 .
.
 .
.
 ,
,
 .
.

 или
или  .
.


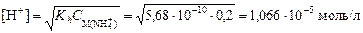

 найдем концентрацию карбонат-иона:
найдем концентрацию карбонат-иона:  ,
,