Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Энергетическая диаграмма для атома водорода.Содержание книги Похожие статьи вашей тематики
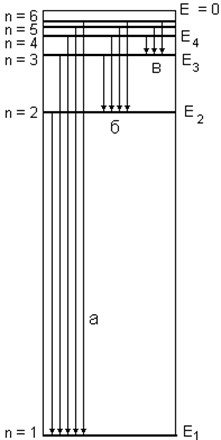
Поиск на нашем сайте Поскольку излучение света на той или иной длине волны связано с испусканием энергии атомом, то была предложена нижеследующая схема его энергетических состояний (см. рис.3). Излучаемая водородным атомом в виде света энергия представляется на энергетической диаграмме как переход электрона с более высоких уровней на второй. Именно переходы на второй уровень описывались эмпирической формулой Бальмера, поэтому и серия переходов и, соответственно, спектральных линий в видимой области получила название серии Бальмера (рис.3б). В принципе, возможны и осуществляются переходы и на первый уровень, однако они приходятся уже на ультрафиолетовую область – это так называемая серия Лаймана (рис.3а). Переходы на третий уровень со всех расположенных выше описываются как серия Пашена, они попадают уже в инфракрасную область (рис. 3в). Эмиссионные спектры (спектры излучения) возникают при термическом возбуждении атомов в вольтовой дуге или в разряде. Наиболее характерной чертой спектров, излучения атомов является их дискретность. Спектры состоят из набора линий, каждая из которых соответствует определенной длине волны (рис.2).
Рис.2. Спектр атома водорода.
Рис.3. Схема энергетических уровней атома водорода.
Шведским ученым Ридбергом предложена следующая формула, описывающая энергетические переходы в одноэлектронном атоме (ионе):
Δ E = R · Z2 (1/ni2 - 1/ nj2 ). (10)
Здесь главные квантовые числа для различных уровней обозначены как ni = 1, 2, 3, 4, 5..., nj = 2, 3, 4, соответственно. Это выражение получается из термов электрона на различных энергетических уровнях, см. формулу (1). Пользуясь уравнением Ридберга (10) и приведенной выше формулой Планка (2), можно рассчитать длины волн испускаемого излучения lji при переходах электрона в атоме с энергетических уровней nj на энергетический уровень ni, соответствующих спектральных серий, в частности длины волн серии Бальмера:
h × c lj2 = ¾¾¾¾¾¾. (11) R×(1/n22 – 1/nj2) Экспериментальная часть. Цель работы - изучение эмиссионных спектров атомарного водорода и ртути и неизвестного элемента; идентификация неизвестного элемента с использованием табличных данных.
Характеристичность спектров атомов позволяет использовать их для идентификации элементов. Каждому химическому элементу соответствует свой характеристический набор линий в спектре. Идентификация химического элемента может осуществляться, как минимум, по трем линиям его эмиссионного спектра. Для изучения эмиссионных спектров, используются спектральные приборы, которые обеспечивают разложение света, идущего от источника излучения, в спектр по длинам волн. Спектральный прибор имеет три основные части (рис.4): а) коллиматор часть с узкой щелью (входная щель прибора), установленной в фокусе объектива коллиматора; б) диспергирующий элемент (спектральная призма или дифракционная решетка); в) камерный объектив, который собирает на своей фокальной поверхности параллельные пучки и дает монохроматическое изображение входной щели, соответствующее различным длинам волн.
Рис.4. Схема спектрального прибора. Приборы и источники излучения: 1. Спектральный прибор - монохроматор УМ-2. 2. Ртутная лампа, водородная лампа и лампа с неизвестным элементом. 3. Источники питания ламп. Порядок выполнения работы. 1. Ознакомиться с инструкцией по работе на спектральном приборе. Под руководством лаборанта подготовить УМ-2 к работе. 2. Провести градуировку прибора по линиям спектра ртути. Для этого подключить ртутную лампу к источнику питания и поместить ее перед входной щелью прибора. Вращая барабан, вывести указатель на середину желтой линии в спектре излучения ртути. Наблюдение вести через окуляр прибора. Необходимо устанавливать указатель в окуляре на середину линии, после чего снимать отсчет по шкале барабанчика. Затем перейти к следующей линии и т.д. Результаты представить по прилагаемой форме (Табл.2.). 3. Подключить водородную лампу к источнику питания. Медленно вращая рукоятку барабанчика, вывести указатель последовательно на четыре линии, снимая отсчет по шкале барабанчика. 4. Подключить лампу с неизвестным элементом к источнику питания, произвести отсчет делений барабанчика для каждой линии.
Таблица 2. Градуировка монохроматора
Обработка результатов. 1. Используя данные, полученные для ртутной лампы (табл.2.), построить на миллиметровке градуировочный график зависимости длины волн от числа делений шкалы барабана монохроматора l = f (дел.). Примерный вид графика представлен на рис. 5. 2. Используя построенный по результатам измерений градуировочный график, определить по делениям барабана длины волн обнаруженных спектральных линий атомарного водорода. 3. Используя градуировочный график, определить длины волн излучения лампы, содержащей неизвестный элемент, и, сопоставив с длинами волн, приведенными в таблице 3, определить этот элемент.

Рис. 5. Калибровочный график монохроматора.
Таблица 3. Характеристические линии в спектрах испускания атомов некоторых химических элементов
4. Используя формулы (10) и (11), приведенные в теоретической части работы, вычислить теоретические значения длин волн линий серии Бальмера атомов водорода, сопоставить их с экспериментально измеренными и заполнить представленные ниже таблицы 4 и 5. 5. Полученную экспериментально длину волны для водородной лампы сравнить с теоретическим значением, вычислить погрешность измерений.
Таблица 4. Спектральные данные для атомарного водорода
Таблица 5. Спектральные данные для атомов неизвестного элемента
Литература. 1. Угай Я.А. Общая химия. - М, Высшая школа. 1984. 2. Карапетьянц М.Х., Дракин А.П., Строение вещества. - М.: Высшая школа, 1989. 3. Мешковский И.K., Попков O.С. Строение вещества и химическая связь. Учебное пособие. СПбГИТМО(ТУ), 1999. 4. Новиков А.Ф., Успенская М.В. Электронный учебник по курсу химии, глава 2 "Современные представления о строении и свойствах атомов, Пeриoдичeский зaкoн Д.И.Мeндeлeeвa", раздел 2.2. Центр дистанционного обучения СПбГУИТМО, 2004.
Лабораторная работа № 3
ОПРЕДЕЛЕНИЕ ДИПОЛЬНОГО МОМЕНТА МОЛЕКУЛЫ.
Теоретическая часть.
Дипольные моменты позволяют получить информацию о структуре молекул. С практической точки зрения они важны для нахождения подходящего растворителя для данного твердого вещества, так как способность растворителя разрушать связь в ионном кристалле связана с его способностью полярной молекулы уменьшать электростатическое взаимодействие между ионами в кристалле и сольватировать ионы. Дипольный момент является векторной количественной характеристикой полярности молекулы. Существование или отсутствие электрического дипольного момента у молекулы связано с ее симметрией. Если электрические центры тяжести положительных и отрицательных зарядов совпадают, то такие молекулы неполярны (О2, N2, ССl4 и др.). Если электрические центры тяжести не совпадают (например, гетероядерные двухатомные молекулы, такие как HCl, NaF, или многоатомные молекулы Н2О, CH3Cl), то в молекуле образуется постоянный электрический диполь - система двух равных по величине и противоположных по знаку зарядов, разделенных некоторым расстоянием. Такие молекулы полярны и характеризуются постоянным дипольным моментом. С точки зрения электростатики, полярная молекула представляет собой диполь, характеризуемый собственным дипольным моментом величиной μс = q · l. Здесь l - длина диполя, а q - его электростатический заряд, который может быть представлен как q = δ · e (δ - эффективный заряд диполя, e - заряд электрона). Тогда собственный дипольный момент будет равен:
μс = δ · e · l. (1)
Эффективный заряд δ возникает в результате перераспределения электронной плотности при образовании молекулы, он соответствует степени ионности химической связи. Зная экспериментальное значение дипольного момента, можно рассчитать эффективный заряд:
d= m / e × l. (2)
Дипольный момент измеряется в Кл·м, однако практически более удобной оказалась внесистемная единица измерения – Дебай (Д): 1Д = 3,336·10-30 Кл·м. Дипольный момент – величина векторная, поэтому результирующий дипольный момент молекулы есть векторная сумма дипольных моментов связей внутри молекулы, что определяется ее стрoeниeм. При помещении в статическое электрическое поле полярная молекула, естественно, ориентируется по силовым линиям поля, однако, помимо этого, она испытывает еще и дополнительную деформацию, связанную со смещением общего электронного облака молекулы в сторону положительного электрода и со смещением положительных ядер – в сторону отрицательного. Таким образом, к собственному дипольному моменту молекулы в электрическом поле добавляется момент, индуцированный внешним полем:
μ = μс + μинд. (3)
Неполярная молекула, естественно, имеет только индуцированный дипольный момент. Этот индуцированный дипольный момент молекулы μинд линейно зависит от напряженности локального электрического поля Елок , действующего на молекулу:
μинд = αинд · Елок. (4)
Коэффициент пропорциональности имеет определенный физический смысл и называется индукционной (αинд), или деформационной поляризуемостью (αдеф). Размерность поляризуемости оказывается соответствующей м3 или см3. Дальнейший анализ позволил установить, что значение поляризуемости примерно равно кубу радиуса молекулы, представляемой в виде сферы. Следовательно, объем молекулы может быть найден как (4π / 3) · αдеф. Тогда общий объем одного моля молекул будет равен:
ΣVм = (4π / 3) · NА· αдеф, (5)
где NА – число Авогадро. Деформационная поляризуемость, таким образом, включает в себя электронную и атомную составляющие:
αдеф = αэл + αат . (6)
В случае полярной молекулы поляризуемость включает в себя еще и ориентационную составляющую αор:
α = αдеф + αор = αэл + αат + αор . (7)
Установлено, что ориентационная составляющая поляризуемости αор связана с собственным дипольным моментом молекулы μс следующим образом:
αор = μс2 / 3kT, (8)
здесь k - постоянная Больцмана, Т - температура. Если мы имеем дело не с одной молекулой, а с веществом, содержащим моль (число Авогадро NА) молекул, удобнее оперировать не поляризуемостью, а так называемой поляризацией вещества в электрическом поле:
PМ = μ · NА / VМ , (9)
где VМ = М / ρ – это мольный объем вещества. Обнаружилось, что поляризация тоже зависит от напряженности внешнего электрического поля Е:
PМ = [(ε – 1) / 4π] · E. (10)
Здесь ε – диэлектрическая проницаемость вещества. Связь между напряженностями внешнего Е и локального Елок электрических полей дается соотношением:
Елок = [(ε + 2) / 3] · E. (11)
Комбинируя эти выражения, получаем формулу Клаузиуса-Моссотти для мольной поляризации вещества:
PМ = [(ε – 1) / (ε + 2)] · VМ = (4π / 3) · NА· α, (12) или: PМ = [(ε – 1) / (ε + 2)] · (M / ρ) = (4π / 3) · NА· α. (13)
Объединяя эти формулы, получаем уравнение, впервые выведенное П. Дебаем:
PМ = [(ε – 1) / (ε + 2)] · VМ = (4π / 3) · NА · (αэл + αат + μс2 / 3kT). (14)
Уравнение Дебая является точным для разреженных газов и лишь приближенно выполняется для слабо полярных жидкостей, но практически не применимо к жидкостям с высокой диэлектрической проницаемостью. Уравнение Дебая не учитывает взаимодействия между полярными молекулами, поэтому для экспериментального определения дипольного момента молекул используют метод разбавленных растворов. При разбавлении раствора, содержащего полярное вещество, например, ацетон (СН3)2СО в неполярном растворителе (четыреххлористый углерод ССl4), взаимодействие между молекулами ацетона уменьшается по мере того, как увеличивается расстояние между ними. Диэлектрические свойства раствора определяют при использовании этого метода по изменению электрической емкости конденсаторов, заполненных растворами полярного вещества различной концентрации. При этом емкость конденсаторов возрастает с увеличением содержания полярного вещества. Как и поляризуемость, поляризация может быть представлена в виде суммы трех составляющих:
PМ = Pэл + Pат + Pор = Рдеф + Pор , (15)
где Рэл = (4/3)pNAaэл – поляризация электронного типа; Рат = (4/3)pNAaат – атомная поляризация; Рор = (4/3)pNAaор = μс2 / 3kT – ориентационная поляризация; Рдеф = (4/3)pNAaдеф – деформационная поляризация.
Дипольный момент молекулы μ может быть найден, в частности, с использованием метода разделения составляющих поляризации по частоте. Дело в том, что при низких частотах осцилляции внешнего электрического поля осуществляются все три вида поляризации (атомная, электронная и ориентационная). При высоких же частотах, соответствующих частотам колебаний электромагнитного поля видимого света, проявляется, в основном, только электронная составляющая поляризации, которая может быть найдена через показатель преломления молекулярного вещества n по уравнению Лоренца-Лорентца. Это уравнение выведено для поведения молекул в высокочастотном поле, приближающемся к частотам колебаний видимого света. В этих условиях говорят уже не о диэлектрической проницаемости вещества ε, а о его показателе преломления n, связь между ними дается соотношением Максвелла ε ≈ n2:
Pэл = RМ = [(n2 – 1) / (n2 + 2)] · VМ = (4π / 3) · NА· αэл , (16)
где Рэл – электронная поляризация вещества, RМ – мольная рефракция, VМ – мольный объем, NА – число Авогадро, αэл – электронная поляризуемость молекулы. Вычитая поляризацию при высоких частотах, найденную по уравнению Лоренца-Лорентца, из поляризации при низких частотах по уравнению Клаузиуса-Моссотти, можно определить ориентационную составляющую общей поляризации:
Рор = (4π / 3) · NА · (μс2 / 3kT), (17)
а затем вычислить дипольный момент молекулы μс.
Экспериментальная часть. Цель работы - определение дипольного момента молекулы ацетона, используя метод разбавленных растворов. Для этого измеряют емкости конденсаторов с растворами ацетона в четыреххлористом углероде и определяют показатель преломления ацетона и четыреххлористого углерода. Приборы и реактивы: 1. Измеритель емкости. 2. Стеклянные сосуды, в которых находятся плоские конденсаторы, погруженные в растворы ацетона в четыреххлористом углероде. 3. Рефрактометр Аббе. 4. Растворы ацетона в четыреххлористом углероде (концентрации растворов даны в мольных долях, например, 0,01; 0,02 и т.д.). Чистые вещества: (СН3)2 СО, CCl4. 5. Фильтровальная бумага, фланель. Порядок выполнения работы.
1. Используя методические указания, под руководством лаборанта ознакомиться с работой на приборах. 2. Измерить емкости конденсаторов, заполненных растворами ацетона с концентрацией Х2 (мольная доля) в неполярном растворителе с концентрацией Х1 (мольная доля). 3. Измерить показатели преломления чистых ацетона n2 и четыреххлористого углерода n1 на рефрактометре Аббе. 4. Рассчитать диэлектрическую проницаемость изучаемых растворов e ацетона в четыреххлористом углероде по формуле:
(e1 – 1)·(Сх – Со) e = 1 + ¾¾¾¾¾¾—, (18) С1 – Со
где e1 = 2,23 – диэлектрическая проницаемость четыреххлористого углерода; Сх – емкость конденсатора с раствором полярного вещества (ацетона) в неполярном растворителе (четыреххлористом углероде); Со - емкость "пустого" (без жидкости) конденсатора; С1 - емкость конденсатора, наполненного чистым растворителем (четыреххлористым углеродом). 5. Полученные экспериментальные данные занести в таблицу 6.
Таблица 6.
Обработка результатов. 1. Выражение для мольной поляризации раствора полярного вещества (ацетона) в неполярном растворителе (четыреххлористом углероде): e – 1 Рм = ¾¾ × VМ = X1 (Р1эл + Р1ат) + X2 (Р2эл + Р2ат + P2op), (19) e + 2 где e – диэлектрическая проницаемость раствора; VМ – мольный объем раствора, [см 3/ моль]; X1– концентрация растворителя, X2 – концентрация растворенного вещества в мольных долях: (Х1 + Х2 = 1); Р1эл и Р2эл – мольные электронные поляризации растворителя и растворенного вещества; Р1ат и Р2ат – мольные атомные поляризации компонентов раствора (их значениями можно пренебречь, поскольку они невелики по сравнению с электронной поляризацией Рат ≪ Рэл), вычислить мольную ориентационную поляризацию [см3/моль] растворенного вещества по уравнению:
1 ì e – 1 ü Pop = ¾ · í ¾¾ × VМ – Х1Р1эл – Х2 Р2эл ý. (20) X2 î e + 2 þ
2. Мольные объемы растворов VМ рассчитываются по уравнению:
VМ = (1/r)(Х1М1+ Х2М2), (21)
где М1, М2 - соответственно, мольные массы ацетона и четыреххлористого углерода, г/моль; r - плотность раствора, г/см3. Электронные поляризации компонентов раствора находятся по уравнениям:
n21 – 1 n22 – 1 Р1эл = ¾¾¾ × VМ1 ; Р2эл = ¾¾¾ × VМ2 . (22) n21 + 2 n22 + 2
Здесь VМ1= М1/r1 и VМ2= М2/r2 – это мольные объемы четыреххлористого углерода и ацетона, r1 и r2 - их плотности, соответственно.
Таблица 7.
Рассчитанные величины представить по приведенной форме, заполнив таблицы 7 и 8. 3. Построить график зависимости Рор от величины 1/VМ, а затем аппроксимировать ее прямой линией (примерный вид его показан на рис.6.). При этом необходимо из точки 1/VМ = 1/VМ1 на оси абсцисс (VМ1 - мольный объем чистого растворителя) провести ось ординат (Pop). Затем зависимость Pop от 1 / VМ экстраполировать на бесконечное разбавление (провести прямую Рор= f (1/VМ) до пересечения с осью Рoр) и найти Pоp* (см. рис. 1). 4. Вычислить дипольный момент молекулы ацетона по преобразованному уравнению (Рор = μс2 / 3kT) m= 1,28×10-2 (Pоp* × T)1/2, где Т - абсолютное значение температуры опыта. 5. Рассчитанное значение дипольного момента сравнить с табличным (см.табл.10.). 6. Определить погрешность измерения.
Таблица 8.
Рис. 6. Таблица 9.
n - показатель преломления для желтой D -линии натрия.
Таблица 10. Дипольные моменты молекул
Литература. 1. Угай Я.А. Общая химия. - М, Высшая школа. 1984. 2. Карапетьянц М.Х., Дракин А.П., Строение вещества. - М.: Высшая школа, 1989. 3. Новиков А.Ф., Успенская М.В. Электронный учебник по курсу химии, глава 3. "Химичeскaя связь, стрoeниe и свoйствa мoлeкул", раздел 3.5. Центр дистанционного обучения СПб.ГУИТМО, 2004.
Лабораторная работа № 4 ТЕПЛОВЫЕ ЭФФЕКТЫ ХИМИЧЕСКИХ ПРОЦЕССОВ Теоретическая часть.
Термохимия - раздел химической термодинамики, предметом которой является определение тепловых эффектов химических реакций или фазовых превращений веществ экспериментальными и расчетными методами. При этом она основывается на общих законахтермодинамики . Термодинамической системой принято называть вещество или совокупность взаимодействующих веществ, мысленно или реально выделяемых в пространстве. Остальная часть пространства со всем, что в ней находится, называется окружающей средой. Система считается закрытой, если между ней и окружающей средой возможен только обмен теплом. Для описания состояния термодинамической системы вводятся термодинамические параметры (объем, температура, давление, количество вещества) и термодинамические функции (внутренняя энергия, энтальпия, энтропия, энергия Гиббса и др.). Прежде всего химическая система характеризуется термодинамическими параметрами. К термодинамическим параметрам (или переменным) системы относятся такие параметры, которые могут быть изменены или заданы извне, а именно: давление p, объем V, температура T, количество молей вещества ν, концентрация cконц. Иногда к ним относят и количество теплоты Q, подводимое к системе извне или отводимое от нее. Основные термодинамические параметры связаны между собой известным уравнением Менделеева-Клапейрона (см. лабораторную работу №1): pV = ν · RT. Его можно преобразовать к следующему виду: p = (ν ⁄ V) · RT, а так как мольная концентрация cконц = ν ⁄ V, то p = cконц · RT. (1)
К термодинмическим функциям относят прежде всего внутреннюю энергию U, включающую в себявсе возможные виды энергии частиц, составляющих систему, исключая кинетическую и потенциальную энергии самой системы. Внутренняя энергия системы определяется энергией движения молекул, энергией движущихся электронов в атомах, энергией внутримолекулярных колебаний атомов и атомных групп, внутриядерной энергией и т.п. По этой причине абсолютное значение внутренней энергии, впрочем, как и других функций состояния, определено быть не может, однако могут быть найдены изменения этих функций в ходе превращений. Основным законом термодинамики является закон сохранения энергии, который в термодинамической форме выражается уравнением: DQ = DU + A. (2)
Это уравнение означает, что если к системе подводится теплота DQ, то она расходуется на изменение внутренней энергии DU и на совершение работы А. При этом: DU = U1 - U2, (3)
где U1 - внутренняя энергия система в начальном состоянии; U2 - внутренняя энергия системы в конечном состояний. Под величиной А имеют в виду работу, совершаемую системой против сил, действующих на нее извне: внешнего давления, электрического и магнитного поля и т. д. Если на систему не действуют никакие силы, кроме сил внешнего давления, то работа против сил внешнего давления выражается уравнением: А = р × DV. (4)
где DV = V2 - V1 - изменение объема системы; р-давление в системе. В термодинамике оказалось удобным ввести еще одну функцию, характеризующую состояние системы, энтальпию Н, которая определяется следующим образом: H = U + pV. (5)
Экспериментально невозможно определить абсолютное значение энтальпии и внутренней энергии системы, но можно определить количество тепла, которым обменивается система с окружающей средой, и количество совершаемой работы, поэтому в термодинамике принято учитывать только изменения термодинамических функций. Подобно внутренней энергии изменение энтальпии DН = Н2 - Н1 характеризует изменение энергетического состояния системы при ее переходе из начального состояния в конечное:
DH =DU + p DV. (6)
Таким образом, выделение теплоты из системы или поглощение ею теплоты из окружающей среды в результате химического процесса или фазового перехода связывают с изменением внутренней энергии системы, если процесс происходит при постоянном объеме Qv = DU, или с изменением энтальпии, если процесс происходит при постоянном давлении в системе Qр = DН. Так как внутренняя энергия системы является функцией температуры, то тепловые эффекты процессов также зависят от температуры. Тепловым эффектом, или теплотой химической реакции, называется изменение энтальпии системы в результате прохождения реакции, определяемое как количество теплоты, которое выделяется (поглощается) системой в результате необратимого химического процесса при условии постоянства давления. При этом исходные вещества и продукты реакции должны иметь одинаковую температуру. Обычно тепловой эффект реакции относят к 1 молю вещества и стандартным условиям (температура 298 К (+25оС), нормальное атмосферное давление 101325 Па), выражают его в единицах энергии, в кДж/моль. Изменение энтальпии, отвечающее стандартным условиям, обозначают так: DНо298. Если в ходе реакции запас энергии в системе повышается, система поглощает тепло, то тепловой эффект ее имеет положительное значение ΔН > 0, что соответствует эндотермической реакции, в противоположном случае говорят об экзотермической реакции: ΔН < 0. Таким образом, тепловой эффект реакции имеет знак «-», если теплота выделяется из системы (экзотермическая реакция), и знак «+», если теплота поглощается системой (эндотермическая реакция). Уравнения химических реакций, в которых указывается тепловой эффект химических реакций, получили название термохимических уравнений. В термохимических уравнениях тепловой эффект химической реакции записывается рядом с уравнением баланса масс. При этом указывается также агрегатное состояние веществ. Например: Н2 газ +1/2 О2 газ → Н2Ожидк ; DН°298 = -285,5 кДж/моль. (7)
В термохимии в качестве одной из стандартных характеристик индивидуальных веществ является тепловой эффект, или энтальпия образования, одного моля химического соединения из простыx веществ. При этом условно принимается, что энтальпия образования простых веществ равна нулю (DН°f = 0). При расчетах тепловых эффектов реакций с участием органических веществ часто используются величины теплот сгорания моля вещества в кислороде с образованием углекислого газа СО2 газ и воды Н2Ожидк при стандартных условиях. Их обозначают как DН°сгор.
Законы термохимии .
Термохимия как экспериментальная часть химический термодинамики базируется на двух основных законах. Первый закон термохимии (закон Лавуазье-Лапласа) формулируется так: Тепловой эффект реакции образования сложного вещества из простых равен по абсолютному значению, но противоположен по знаку тепловому эффекту реакции разложения данного соединения на простые вещества. Таким образом,
ΔНºобр = –ΔНºразл. (8)
Или, обобщая: Тепловой эффект прямой реакции равен тепловому эффекту обратной реакции, но с противоположным знаком. Этот закон часто применяют тогда, когда невозможно или трудно определить опытным путем тепловой эффект, скажем, прямой реакции, но легко определить его для обратной реакции. Второй закон термохимии (закон Гесса) формулируется следующим образом: Тепловой эффект химической реакции, протекающей при постоянном давлении или при постоянном объеме, не зависит от числа, последовательности и характера ее промежуточных стадий, но определяется только природой исходных веществ и продуктов и условий реакции, а также начальным и конечным состоянием системы.
Запись закона: ΔНреакц = ΔНст1 + ΔНст2 + ΔНст3 + ΔНст... (9)
Закон Гесса дает возможность вычислить тепловой эффект процесса. Он используется для расчета DН, DU реакции, а также в том случае, когда процесс либо экспериментально не проводится, либо не может быть осуществлен вообще. Рассмотренные определения дают возможность сформулироватьдва важных следствия из закона Гесса. Первое следствие: Тепловой эффект реакции равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом стехиометрических коэффициентов в уравнении реакции. Например, для реакции n1А + n2В → n3С + n4D можно записать:
DНº = (n3DНºС + n4DНºD) - (n1DНºA +n2DНºB). (10) Или в общем виде: ΔНх.р = Σnj·ΔНºобрпрод – Σni·ΔНºобрреаг, (11)
где nj и ni - стехиометрические коэффициенты при химических символах продуктов и реагентов в уравнении реакции. Второе следствие: Тепловой эффект химической реакции с участием органических веществ равен сумме теплот сгорания исходных веществ за вычетом суммы теплот сгорания продуктов реакции с учетом стехиометрических коэффициентов. Например, для реакции n1А + n2В → n3С + n4D можно записать: DНº = (n1DНºA +n2DНºB) - (n3DНºС + n4DНºD). (12) Или в общем виде: ΔНºх.р = Σni·ΔНºсгорреаг – Σnj·ΔНºсгор.прод . (13)
Практически для расчета теплового эффекта химической реакции необходимо написать уравнение этой реакции и привести для каждого из участвующих в реакции веществ значение стандартной теплоты его образования или сгорания. Зависимость теплового эффекта реакции от температуры может быть выражена через изменение теплоемкости системы в результате прохождения химического процесса или фазового превращения. Изменение теплоемкости для процесса при постоянном давлении может быть записано так:
DСР
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 2743; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.017 с.) |