

Мы поможем в написании ваших работ!
ЗНАЕТЕ ЛИ ВЫ?
|
Модели строения атома. Опыт Резерфорда
Похожие статьи вашей тематики
Давно известно, что все тела построены из отдельных очень малых частиц – атомов и молекул. Под атомом понимают мельчайшую частицу химического элемента. Молекулой называют более сложную частицу, состоящую из нескольких атомов. Долгое время считалось, что атомы являются простейшими, неделимыми частицами вещества, однако ученые убедительно доказали, что атомы представляют собой довольно сложные образования. Указание на это дала оптика. Было доказано, что электромагнитные волны, а следовательно, и свет, испускаются при ускоренном движении электрических зарядов. Но и атомы вещества способны испускать свет – видимые электромагнитные волны, давая характерное для каждого атома излучение – спектр. Из этого можно было заключить, что атомы содержат в себе электрические заряды, способные ускоренно перемещаться. Атом в целом нейтрален, поэтому он должен содержать как положительные, так и отрицательные частицы.
К концу XIX–началу XX вв. серьезно встал вопрос о строении атома. В первой модели атома, предложенной Томсоном (1903 г.), предполагалось, что вещество в атоме распределено равномерно по сфере диаметром  (молекулярная физика показала, что размеры атомов и молекул имеют величину порядка нескольких ангстремов). Это вещество заряжено положительно, и в нем «плавают» электроны. Колебательные движения электронов возбуждают в пространстве электромагнитные волны. (молекулярная физика показала, что размеры атомов и молекул имеют величину порядка нескольких ангстремов). Это вещество заряжено положительно, и в нем «плавают» электроны. Колебательные движения электронов возбуждают в пространстве электромагнитные волны.
Модель Томсона необходимо было проверить экспериментально, что и было сделано Резерфордом (1911 г.) с помощью опыта по рассеянию  -частиц ( -частиц ( -частицы испускаются некоторыми элементами, расположенными в конце периодической таблицы Менделеева (см. приложение 2) и представляют собой ионизованные атомы гелия. Они несут положительный заряд в 2 элементарные единицы заряда и обладают массой в -частицы испускаются некоторыми элементами, расположенными в конце периодической таблицы Менделеева (см. приложение 2) и представляют собой ионизованные атомы гелия. Они несут положительный заряд в 2 элементарные единицы заряда и обладают массой в  , т. е. в 7300 раз большей, чем масса электрона). Резерфорд ставил на пути пучка , т. е. в 7300 раз большей, чем масса электрона). Резерфорд ставил на пути пучка  -частиц золотую фольгу. Согласно модели атома Томсона -частиц золотую фольгу. Согласно модели атома Томсона  -частица не может пройти даже через очень тонкую фольгу – фольга непрозрачна, так как атомы заполняют все пространство. -частица не может пройти даже через очень тонкую фольгу – фольга непрозрачна, так как атомы заполняют все пространство.  -частицы должны остановиться, передав свою энергию и импульс фольге в целом. Однако основная масса -частицы должны остановиться, передав свою энергию и импульс фольге в целом. Однако основная масса  -частиц проходит сквозь фольгу, не меняя своего направления. При этом наблюдаются частицы, отклонившиеся от своего первоначального направления на углы от 0° до 180°. -частиц проходит сквозь фольгу, не меняя своего направления. При этом наблюдаются частицы, отклонившиеся от своего первоначального направления на углы от 0° до 180°.
Результаты опыта Резерфорда опровергли модель Томсона:  -частицы прошли сквозь фольгу. Однако отклонить -частицы прошли сквозь фольгу. Однако отклонить  -частицы от первоначального направления могли только положительные заряды большой массы. Поскольку отклонения испытывают лишь немногие частицы, лишь некоторые -частицы от первоначального направления могли только положительные заряды большой массы. Поскольку отклонения испытывают лишь немногие частицы, лишь некоторые  -частицы проходят вблизи больших по массе положительных зарядов. Это значит, что положительный заряд атома сосредоточен в объеме, очень малом по сравнению с объемом атома. Для того чтобы -частицы проходят вблизи больших по массе положительных зарядов. Это значит, что положительный заряд атома сосредоточен в объеме, очень малом по сравнению с объемом атома. Для того чтобы  -частица, имеющая энергию в несколько мегаэлектронвольт (Мэв), могла быть отброшена назад, необходимо, чтобы при столкновении на нее подействовали очень большие силы, что возможно только в том случае, если при столкновении -частица, имеющая энергию в несколько мегаэлектронвольт (Мэв), могла быть отброшена назад, необходимо, чтобы при столкновении на нее подействовали очень большие силы, что возможно только в том случае, если при столкновении  -частицы и атома их центры сближаются на расстояние ~ -частицы и атома их центры сближаются на расстояние ~ 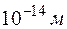 , а не , а не  , т. е. на расстояние, значительно меньшее размера атома. , т. е. на расстояние, значительно меньшее размера атома.
На основании этих фактов Резерфорд предположил, что атом состоит из положительно заряженного ядра с зарядом 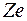 ( ( – порядковый номер в системе Менделеева; – порядковый номер в системе Менделеева;  – элементарный заряд), в котором сосредоточена почти вся масса атома. Вокруг ядра движутся по некоторым орбитам электроны, образуя электронную оболочку атома. Размер ядра – элементарный заряд), в котором сосредоточена почти вся масса атома. Вокруг ядра движутся по некоторым орбитам электроны, образуя электронную оболочку атома. Размер ядра 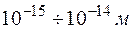 . Размер области, в которой движутся электроны, – . Размер области, в которой движутся электроны, –  . Так как атомы нейтральны, заряд ядра равен суммарному заряду электронов, т. е. вокруг ядра должно вращаться . Так как атомы нейтральны, заряд ядра равен суммарному заряду электронов, т. е. вокруг ядра должно вращаться  электронов. Это так называемая ядерная или планетарная модель атомов. Ее очевидным недостатком было то, что она противоречила классической теории электродинамики. В самом деле, движение электронов по криволинейным траекториям (будем считать для простоты траектории круговыми) есть ускоренное движение, так как кулоновская сила взаимодействия между ядром и электроном сообщает электрону нормальное ускорение, направленное к ядру. Но ускоренное движение электронов есть переменный ток (постоянный ток – это равномерное и прямолинейное движение электронов). Переменный ток создает в пространстве переменное электромагнитное поле. На создание этого поля расходуется энергия. Энергия поля может создаваться только за счет кулоновского взаимодействия электрона с ядром. В результате электрон должен двигаться по спирали и, в конце концов, упасть на ядро. Однако опыт показывает, что атомы – устойчивые образования. Отсюда следует вывод, что результаты классической электродинамики, основанной на уравнениях Максвелла, неприменимы к внутриатомным процессам. Поэтому необходимо было найти новые закономерности. электронов. Это так называемая ядерная или планетарная модель атомов. Ее очевидным недостатком было то, что она противоречила классической теории электродинамики. В самом деле, движение электронов по криволинейным траекториям (будем считать для простоты траектории круговыми) есть ускоренное движение, так как кулоновская сила взаимодействия между ядром и электроном сообщает электрону нормальное ускорение, направленное к ядру. Но ускоренное движение электронов есть переменный ток (постоянный ток – это равномерное и прямолинейное движение электронов). Переменный ток создает в пространстве переменное электромагнитное поле. На создание этого поля расходуется энергия. Энергия поля может создаваться только за счет кулоновского взаимодействия электрона с ядром. В результате электрон должен двигаться по спирали и, в конце концов, упасть на ядро. Однако опыт показывает, что атомы – устойчивые образования. Отсюда следует вывод, что результаты классической электродинамики, основанной на уравнениях Максвелла, неприменимы к внутриатомным процессам. Поэтому необходимо было найти новые закономерности.
Спектры излучения атомов
Ключом к познанию строения атомов послужило изучение атомных спектров. Спектром называется совокупность простых электромагнитных волн, составляющих данное излучение.
Исследования спектров излучения разреженных газов, т. е. спектрального излучения отдельных атомов, показали, что каждому газу присущ вполне определенный линейчатый спектр, состоящий из отдельных спектральных линий. Прежде всего было замечено, что линии в спектрах атомов расположены не беспорядочно, а объединяются в группы или, как их называют, серии линий. Отчетливее всего это видно в спектре простейшего атома – атома водорода. Спектрограмма части спектра атомарного водорода в видимой и близкой ультрафиолетовой области выглядит примерно, как на рис. 4.1.1.
Рис. 4.1.1
Наиболее яркие линии этого спектра имеют свои обозначения:  (по мере убывания длины волны). Очевидно, что линии располагаются не беспорядочным образом, а в определенном порядке. Расстояние между линиями закономерно убывает по мере перехода от более длинных волн к более коротким. (по мере убывания длины волны). Очевидно, что линии располагаются не беспорядочным образом, а в определенном порядке. Расстояние между линиями закономерно убывает по мере перехода от более длинных волн к более коротким.
Серия линий видимой части спектра атома водорода носит имя швейцарского ученого Бальмера, который подобрал эмпирическую формулу, описывающую все известные спектральные линии этого спектра: 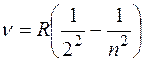 , ,  Здесь Здесь 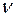 – частота, – частота, 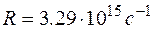 – постоянная Ридберга. – постоянная Ридберга.
В спектре атома водорода были позднее обнаружены еще пять серий: в ультрафиолетовой области – серия Лаймана; в инфракрасной (длинноволновой) области – серии Пашена, Брэкета, Пфунда, Хемфри. Все шесть серий спектра атома водорода описываются одной формулой, называемой обобщенной формулой Бальмера: 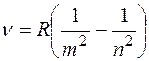 . Здесь . Здесь  соответствует сериям Лаймана, Бальмера, Пашена, Брэкета, Пфунда, Хэмфри; соответствует сериям Лаймана, Бальмера, Пашена, Брэкета, Пфунда, Хэмфри; 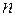 принимает целочисленные значения, начиная с принимает целочисленные значения, начиная с 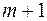 . Значит, . Значит, 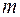 определяет серию, определяет серию, 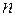 определяет спектральную линию в серии. При возрастании определяет спектральную линию в серии. При возрастании 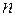 частота линии в каждой серии стремится к предельному значению частота линии в каждой серии стремится к предельному значению  , которое называется границей серии. , которое называется границей серии.
Пример 1. Определить длину волны, соответствующую границе серии Бальмера.
Решение. Длина световой волны связана с частотой соотношением: 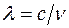 , где , где 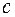 – скорость света. Частота света, излучаемого атомом при переходе с n -го энергетического уровня на m -й выражается обобщенной формулой Бальмера: – скорость света. Частота света, излучаемого атомом при переходе с n -го энергетического уровня на m -й выражается обобщенной формулой Бальмера:  , где , где 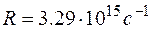 . Серии Бальмера соответствуют . Серии Бальмера соответствуют 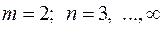 . Границе серии соответствует . Границе серии соответствует 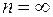 , т. е. , т. е. 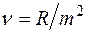 . Используя это, находим: . Используя это, находим:
 . .
Пример 2. Экспериментально установлено, что вторая спектральная линия водородной серии Брэкета соответствует длине волны 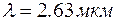 . На основании этих данных установить приближенное значение постоянной Ридберга. . На основании этих данных установить приближенное значение постоянной Ридберга.
Решение. По обобщенной формуле Бальмера имеем: 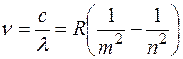 . Для серии Брекета . Для серии Брекета 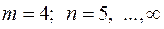 . Второй линии соответствует . Второй линии соответствует  . Используя это, получим: . Используя это, получим:
 . .
Пример 3. При переходе электрона водородного атома с одной из возможных орбит на другую, более близкую к ядру, энергия атома уменьшается на 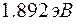 . Определить длину волны излучения . Определить длину волны излучения  . .
Решение. Величина, на которую уменьшилась энергия атома, равна энергии излученного фотона: 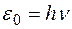 . Здесь . Здесь 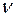 – частота фотона, – частота фотона, 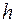 – постоянная Планка. Учитывая, что – постоянная Планка. Учитывая, что  , находим: , находим:
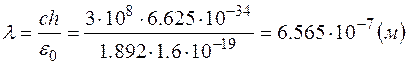 . .
Постулаты Бора
Выше было указано, что ядерная (планетарная) модель атома в сочетании с классической электродинамикой неспособна объяснить устойчивость атома. Кроме этого, модель Резерфорда, опираясь на классическую механику, не может объяснить характер атомного спектра. В самом деле, если электрон движется по спирали, приближаясь к ядру, то в этих условиях его излучение не может быть монохроматическим: момент импульса электрона  в силу закона сохранения момента импульса должен оставаться постоянным, поэтому по мере уменьшения радиуса в силу закона сохранения момента импульса должен оставаться постоянным, поэтому по мере уменьшения радиуса  будет возрастать угловая скорость электрона будет возрастать угловая скорость электрона 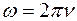 , а следовательно, и частота испускаемого света. , а следовательно, и частота испускаемого света.
Выход из создавшегося тупика был найден Нильсом Бором (1913 г) ценой предположений, противоречащих классической механике и электродинамике. Допущения, сделанные Бором, содержатся в двух высказанных им постулатах.
1. Из бесконечного множества электронных орбит, возможных с точки зрения классической механики, осуществляются только некоторые дискретные орбиты, удовлетворяющие определенным квантовым условиям. Электрон, находящийся на одной из этих орбит, несмотря на то, что он движется с ускорением, не излучает электромагнитных волн (света).
2. Излучение испускается или поглощается в виде светового кванта 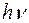 при переходе электрона из одного стационарного состояния в другое. Величина светового кванта равна разности энергий тех стационарных состояний, между которыми совершается квантовый скачок электрона при переходе электрона из одного стационарного состояния в другое. Величина светового кванта равна разности энергий тех стационарных состояний, между которыми совершается квантовый скачок электрона 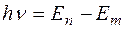 . Частота излучаемой линии . Частота излучаемой линии 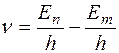 . ( . (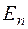 и и  – энергии стационарных состояний атома до и после излучения или поглощения. Если – энергии стационарных состояний атома до и после излучения или поглощения. Если  – происходит излучение фотона; при этом атом переходит из состояния с большей энергией в состояние с меньшей энергией, т. е. с орбиты, более удаленной от ядра, на орбиту, лежащую ближе к ядру. Если – происходит излучение фотона; при этом атом переходит из состояния с большей энергией в состояние с меньшей энергией, т. е. с орбиты, более удаленной от ядра, на орбиту, лежащую ближе к ядру. Если 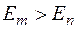 , то все наоборот.) Набор возможных частот и определяет спектр атома. , то все наоборот.) Набор возможных частот и определяет спектр атома.
Опыты Франка и Герца
Существование дискретных энергетических уровней атома подтверждено опытами немецких физиков Франка и Герца, изучавших столкновения электронов с атомами газов. В трубке (рис. 4.1.2), заполненной парами ртути под небольшим давлением (~ 10-5Па), расположены три электрода: катод  , сетка , сетка 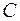 и анод и анод  . Электроны вылетают из катода вследствие термоэлектронной эмиссии, ускоряются разностью потенциалов U, приложенной между катодом и сеткой и измеряемой вольтметром . Электроны вылетают из катода вследствие термоэлектронной эмиссии, ускоряются разностью потенциалов U, приложенной между катодом и сеткой и измеряемой вольтметром 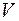 . Напряжение . Напряжение 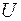 может меняться потенциометром может меняться потенциометром 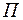 . Между сеткой и анодом создается слабое электрическое поле (~ . Между сеткой и анодом создается слабое электрическое поле (~ 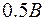 ), тормозящее движение электронов к аноду, сила тока в цепи анода зависит от напряжения ), тормозящее движение электронов к аноду, сила тока в цепи анода зависит от напряжения 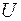 . .
Сила тока вначале монотонно возрастает (рис. 4.1.3), достигает максимума при 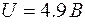 , после чего резко падает, достигает минимума и снова начинает расти. Максимумы тока повторяются при , после чего резко падает, достигает минимума и снова начинает расти. Максимумы тока повторяются при 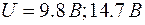 и т. д. Такой ход кривой объясняется тем, что вследствие дискретности энергетических уровней атомы ртути могут воспринимать энергию только определенными порциями: и т. д. Такой ход кривой объясняется тем, что вследствие дискретности энергетических уровней атомы ртути могут воспринимать энергию только определенными порциями:  либо либо 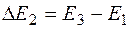 и т. д., где и т. д., где 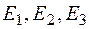 – энергии 1-го, 2-го, 3-го и т. д. стационарного состояния. – энергии 1-го, 2-го, 3-го и т. д. стационарного состояния.
Рис. 4.1.2 Рис. 4.1.3
До тех пор, пока энергия электрона меньше 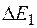 , соударения между электроном и атомом носят упругий характер, причем, поскольку масса электрона во много раз меньше массы атома ртути, энергия электрона практически не меняется. Часть электронов попадает на сетку, остальные, проскочив сетку, достигают анода, создавая ток в цепи гальванометра , соударения между электроном и атомом носят упругий характер, причем, поскольку масса электрона во много раз меньше массы атома ртути, энергия электрона практически не меняется. Часть электронов попадает на сетку, остальные, проскочив сетку, достигают анода, создавая ток в цепи гальванометра  . Чем больше скорость, с которой электроны достигают сетки (т. е. чем больше разность потенциалов между катодом и сеткой), тем больше будет доля электронов, проскочивших через сетку, и, следовательно, больше будет ток в цепи гальванометра (анодный ток). . Чем больше скорость, с которой электроны достигают сетки (т. е. чем больше разность потенциалов между катодом и сеткой), тем больше будет доля электронов, проскочивших через сетку, и, следовательно, больше будет ток в цепи гальванометра (анодный ток).
Когда энергия, накапливаемая электроном в промежутке катод–сетка, достигает или превосходит 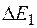 , соударения перестают быть упругими – электроны при ударах об атомы передают им энергию , соударения перестают быть упругими – электроны при ударах об атомы передают им энергию 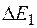 и затем продолжают двигаться с меньшей скоростью и не могут преодолеть тормозящее электрическое поле. Поэтому число электронов, достигающих анода, уменьшается. Например, при и затем продолжают двигаться с меньшей скоростью и не могут преодолеть тормозящее электрическое поле. Поэтому число электронов, достигающих анода, уменьшается. Например, при  электрон сообщает атому энергию, соответствующую электрон сообщает атому энергию, соответствующую 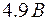 и продолжает двигаться с энергией и продолжает двигаться с энергией  . Если даже такой электрон окажется между сеткой и анодом, он не сможет преодолеть задерживающее напряжение . Если даже такой электрон окажется между сеткой и анодом, он не сможет преодолеть задерживающее напряжение 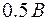 и возвратится обратно на сетку. В соответствии с этим при увеличении ускоряющего потенциала вплоть до и возвратится обратно на сетку. В соответствии с этим при увеличении ускоряющего потенциала вплоть до 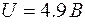 анодный ток возрастает монотонно. При анодный ток возрастает монотонно. При 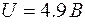 значение тока проходит через максимум, резко уменьшается и возрастает вновь. Дальнейшие максимумы наблюдаются при значениях потенциала, кратных значению значение тока проходит через максимум, резко уменьшается и возрастает вновь. Дальнейшие максимумы наблюдаются при значениях потенциала, кратных значению 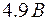 . Значит, атомы ртути поглощают энергию порциями, что соответствует 1-му постулату Бора. . Значит, атомы ртути поглощают энергию порциями, что соответствует 1-му постулату Бора.
Атомы ртути, получившие при соударении с электронами энергию 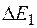 , переходят в возбужденное состояние, из которого они, спустя весьма короткое время (~ , переходят в возбужденное состояние, из которого они, спустя весьма короткое время (~  ), возвращаются в основное состояние, излучая световой квант (фотон) с частотой ), возвращаются в основное состояние, излучая световой квант (фотон) с частотой  (в соответствии со 2-м постулатом Бора). По известному значению (в соответствии со 2-м постулатом Бора). По известному значению 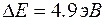 можно вычислить длину волны излучения: можно вычислить длину волны излучения: 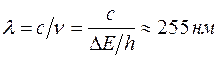 . Такая линия действительно была обнаружена в спектре атомов ртути, бомбардируемых электронами. . Такая линия действительно была обнаружена в спектре атомов ртути, бомбардируемых электронами.
Таким образом, в опытах Франка и Герца было непосредственно обнаружено существование у атомов дискретных энергетических уровней.
Радиусы боровских орбит
Квантовым условием, определяющим действительные орбиты электрона в атоме, по предположению Бора, является равенство момента импульса электрона целому кратному постоянной Планка, деленной на  : : 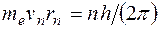 ( ( ). Здесь ). Здесь  – масса электрона, – масса электрона, 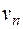 – скорость электрона на – скорость электрона на 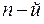 орбите радиуса орбите радиуса 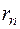 , , 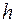 – постоянная Планка. – постоянная Планка.
Рассмотрим электрон, движущийся в поле атомного ядра с зарядом 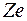 . При . При 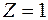 такая система соответствует атому водорода, при других такая система соответствует атому водорода, при других  – водородоподобному иону, т. е. атому с порядковым номером – водородоподобному иону, т. е. атому с порядковым номером  , из которого удалены все электроны, кроме одного (например, He+, Li2+). , из которого удалены все электроны, кроме одного (например, He+, Li2+).
Электрон движется по n -й орбите под действием кулоновской силы, создающей ему нормальное ускорение 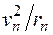 . По второму закону Ньютона, . По второму закону Ньютона, 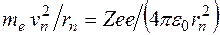 . Подставим в это равенство выражение для скорости . Подставим в это равенство выражение для скорости 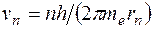 , полученное из квантового условия существования стационарных орбит: , полученное из квантового условия существования стационарных орбит: 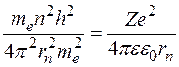 . Отсюда для радиуса n -й стационарной орбиты получаем выражение: . Отсюда для радиуса n -й стационарной орбиты получаем выражение: 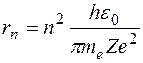 . Поскольку . Поскольку  , то радиусы растут пропорционально квадратам целых чисел. Для первой орбиты водородного атома ( , то радиусы растут пропорционально квадратам целых чисел. Для первой орбиты водородного атома (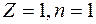 ) получается: ) получается:
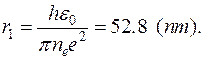
Пример 4. На какой орбите скорость электрона атома водорода равна 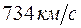 ? ?
Решение. Радиус n -й орбиты электрона в атоме водорода 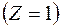 равен равен  . Из боровского квантового условия существования стационарных орбит . Из боровского квантового условия существования стационарных орбит 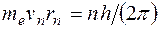 выражаем скорость электрона на n -й орбите: выражаем скорость электрона на n -й орбите: 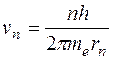 . Подставляя сюда выражение радиуса n -й орбиты и выражая . Подставляя сюда выражение радиуса n -й орбиты и выражая 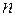 , получаем: , получаем: 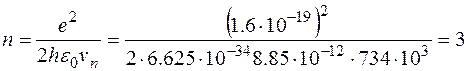 . .
Энергия электрона
Полная энергия электрона в водородоподобной системе складывается из его кинетической энергии (ядро атома неподвижно) и отрицательной потенциальной энергии взаимодействия электрона с ядром: 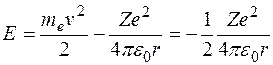 , так как , так как 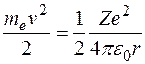 . Радиусы орбит могут принимать только дискретные значения. Отсюда следует, что энергия электрона может принимать только следующие дозволенные дискретные значения: . Радиусы орбит могут принимать только дискретные значения. Отсюда следует, что энергия электрона может принимать только следующие дозволенные дискретные значения: 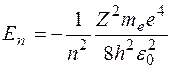 ( ( ). Из этого выражения следует, что энергетические состояния атома образуют последовательность энергетических уровней, изменяющихся в зависимости от значения ). Из этого выражения следует, что энергетические состояния атома образуют последовательность энергетических уровней, изменяющихся в зависимости от значения 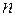 . Целое число . Целое число 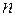 , определяющее энергетические уровни атома, называется главным квантовым числом. Значению , определяющее энергетические уровни атома, называется главным квантовым числом. Значению 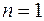 соответствует основное состояние атома; состояния с соответствует основное состояние атома; состояния с 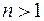 являются возбужденными. являются возбужденными.
|



 (молекулярная физика показала, что размеры атомов и молекул имеют величину порядка нескольких ангстремов). Это вещество заряжено положительно, и в нем «плавают» электроны. Колебательные движения электронов возбуждают в пространстве электромагнитные волны.
(молекулярная физика показала, что размеры атомов и молекул имеют величину порядка нескольких ангстремов). Это вещество заряжено положительно, и в нем «плавают» электроны. Колебательные движения электронов возбуждают в пространстве электромагнитные волны. -частиц (
-частиц ( , т. е. в 7300 раз большей, чем масса электрона). Резерфорд ставил на пути пучка
, т. е. в 7300 раз большей, чем масса электрона). Резерфорд ставил на пути пучка 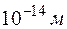 , а не
, а не 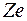 (
( – порядковый номер в системе Менделеева;
– порядковый номер в системе Менделеева;  – элементарный заряд), в котором сосредоточена почти вся масса атома. Вокруг ядра движутся по некоторым орбитам электроны, образуя электронную оболочку атома. Размер ядра
– элементарный заряд), в котором сосредоточена почти вся масса атома. Вокруг ядра движутся по некоторым орбитам электроны, образуя электронную оболочку атома. Размер ядра 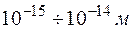 . Размер области, в которой движутся электроны, –
. Размер области, в которой движутся электроны, – 
 (по мере убывания длины волны). Очевидно, что линии располагаются не беспорядочным образом, а в определенном порядке. Расстояние между линиями закономерно убывает по мере перехода от более длинных волн к более коротким.
(по мере убывания длины волны). Очевидно, что линии располагаются не беспорядочным образом, а в определенном порядке. Расстояние между линиями закономерно убывает по мере перехода от более длинных волн к более коротким.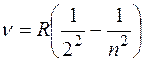 ,
,  Здесь
Здесь 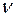 – частота,
– частота, 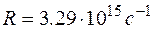 – постоянная Ридберга.
– постоянная Ридберга.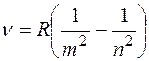 . Здесь
. Здесь  соответствует сериям Лаймана, Бальмера, Пашена, Брэкета, Пфунда, Хэмфри;
соответствует сериям Лаймана, Бальмера, Пашена, Брэкета, Пфунда, Хэмфри; 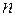 принимает целочисленные значения, начиная с
принимает целочисленные значения, начиная с 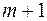 . Значит,
. Значит, 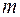 определяет серию,
определяет серию,  , которое называется границей серии.
, которое называется границей серии.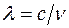 , где
, где 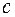 – скорость света. Частота света, излучаемого атомом при переходе с n -го энергетического уровня на m -й выражается обобщенной формулой Бальмера:
– скорость света. Частота света, излучаемого атомом при переходе с n -го энергетического уровня на m -й выражается обобщенной формулой Бальмера:  , где
, где 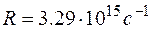 . Серии Бальмера соответствуют
. Серии Бальмера соответствуют 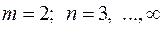 . Границе серии соответствует
. Границе серии соответствует 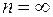 , т. е.
, т. е. 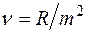 . Используя это, находим:
. Используя это, находим: .
.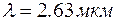 . На основании этих данных установить приближенное значение постоянной Ридберга.
. На основании этих данных установить приближенное значение постоянной Ридберга.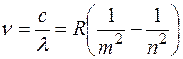 . Для серии Брекета
. Для серии Брекета 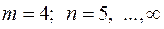 . Второй линии соответствует
. Второй линии соответствует  . Используя это, получим:
. Используя это, получим: .
.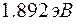 . Определить длину волны излучения
. Определить длину волны излучения  .
.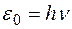 . Здесь
. Здесь 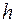 – постоянная Планка. Учитывая, что
– постоянная Планка. Учитывая, что  , находим:
, находим: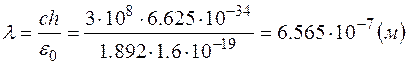 .
. в силу закона сохранения момента импульса должен оставаться постоянным, поэтому по мере уменьшения радиуса
в силу закона сохранения момента импульса должен оставаться постоянным, поэтому по мере уменьшения радиуса  будет возрастать угловая скорость электрона
будет возрастать угловая скорость электрона 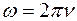 , а следовательно, и частота испускаемого света.
, а следовательно, и частота испускаемого света.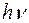 при переходе электрона из одного стационарного состояния в другое. Величина светового кванта равна разности энергий тех стационарных состояний, между которыми совершается квантовый скачок электрона
при переходе электрона из одного стационарного состояния в другое. Величина светового кванта равна разности энергий тех стационарных состояний, между которыми совершается квантовый скачок электрона 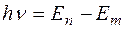 . Частота излучаемой линии
. Частота излучаемой линии 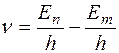 . (
. (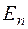 и
и  – энергии стационарных состояний атома до и после излучения или поглощения. Если
– энергии стационарных состояний атома до и после излучения или поглощения. Если  – происходит излучение фотона; при этом атом переходит из состояния с большей энергией в состояние с меньшей энергией, т. е. с орбиты, более удаленной от ядра, на орбиту, лежащую ближе к ядру. Если
– происходит излучение фотона; при этом атом переходит из состояния с большей энергией в состояние с меньшей энергией, т. е. с орбиты, более удаленной от ядра, на орбиту, лежащую ближе к ядру. Если 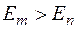 , то все наоборот.) Набор возможных частот и определяет спектр атома.
, то все наоборот.) Набор возможных частот и определяет спектр атома. , сетка
, сетка  и анод
и анод  . Электроны вылетают из катода вследствие термоэлектронной эмиссии, ускоряются разностью потенциалов U, приложенной между катодом и сеткой и измеряемой вольтметром
. Электроны вылетают из катода вследствие термоэлектронной эмиссии, ускоряются разностью потенциалов U, приложенной между катодом и сеткой и измеряемой вольтметром  . Напряжение
. Напряжение 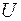 может меняться потенциометром
может меняться потенциометром 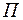 . Между сеткой и анодом создается слабое электрическое поле (~
. Между сеткой и анодом создается слабое электрическое поле (~ 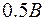 ), тормозящее движение электронов к аноду, сила тока в цепи анода зависит от напряжения
), тормозящее движение электронов к аноду, сила тока в цепи анода зависит от напряжения 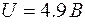 , после чего резко падает, достигает минимума и снова начинает расти. Максимумы тока повторяются при
, после чего резко падает, достигает минимума и снова начинает расти. Максимумы тока повторяются при 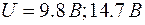 и т. д. Такой ход кривой объясняется тем, что вследствие дискретности энергетических уровней атомы ртути могут воспринимать энергию только определенными порциями:
и т. д. Такой ход кривой объясняется тем, что вследствие дискретности энергетических уровней атомы ртути могут воспринимать энергию только определенными порциями:  либо
либо 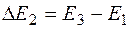 и т. д., где
и т. д., где 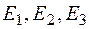 – энергии 1-го, 2-го, 3-го и т. д. стационарного состояния.
– энергии 1-го, 2-го, 3-го и т. д. стационарного состояния.
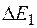 , соударения между электроном и атомом носят упругий характер, причем, поскольку масса электрона во много раз меньше массы атома ртути, энергия электрона практически не меняется. Часть электронов попадает на сетку, остальные, проскочив сетку, достигают анода, создавая ток в цепи гальванометра
, соударения между электроном и атомом носят упругий характер, причем, поскольку масса электрона во много раз меньше массы атома ртути, энергия электрона практически не меняется. Часть электронов попадает на сетку, остальные, проскочив сетку, достигают анода, создавая ток в цепи гальванометра 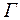 . Чем больше скорость, с которой электроны достигают сетки (т. е. чем больше разность потенциалов между катодом и сеткой), тем больше будет доля электронов, проскочивших через сетку, и, следовательно, больше будет ток в цепи гальванометра (анодный ток).
. Чем больше скорость, с которой электроны достигают сетки (т. е. чем больше разность потенциалов между катодом и сеткой), тем больше будет доля электронов, проскочивших через сетку, и, следовательно, больше будет ток в цепи гальванометра (анодный ток). электрон сообщает атому энергию, соответствующую
электрон сообщает атому энергию, соответствующую 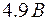 и продолжает двигаться с энергией
и продолжает двигаться с энергией  . Если даже такой электрон окажется между сеткой и анодом, он не сможет преодолеть задерживающее напряжение
. Если даже такой электрон окажется между сеткой и анодом, он не сможет преодолеть задерживающее напряжение 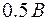 и возвратится обратно на сетку. В соответствии с этим при увеличении ускоряющего потенциала вплоть до
и возвратится обратно на сетку. В соответствии с этим при увеличении ускоряющего потенциала вплоть до  ), возвращаются в основное состояние, излучая световой квант (фотон) с частотой
), возвращаются в основное состояние, излучая световой квант (фотон) с частотой  (в соответствии со 2-м постулатом Бора). По известному значению
(в соответствии со 2-м постулатом Бора). По известному значению 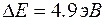 можно вычислить длину волны излучения:
можно вычислить длину волны излучения: 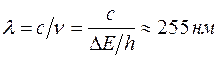 . Такая линия действительно была обнаружена в спектре атомов ртути, бомбардируемых электронами.
. Такая линия действительно была обнаружена в спектре атомов ртути, бомбардируемых электронами. :
: 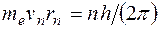 (
( ). Здесь
). Здесь  – масса электрона,
– масса электрона, 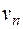 – скорость электрона на
– скорость электрона на 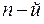 орбите радиуса
орбите радиуса 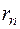 ,
, 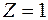 такая система соответствует атому водорода, при других
такая система соответствует атому водорода, при других 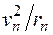 . По второму закону Ньютона,
. По второму закону Ньютона, 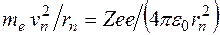 . Подставим в это равенство выражение для скорости
. Подставим в это равенство выражение для скорости 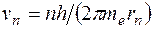 , полученное из квантового условия существования стационарных орбит:
, полученное из квантового условия существования стационарных орбит: 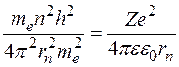 . Отсюда для радиуса n -й стационарной орбиты получаем выражение:
. Отсюда для радиуса n -й стационарной орбиты получаем выражение: 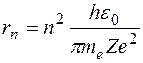 . Поскольку
. Поскольку 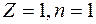 ) получается:
) получается: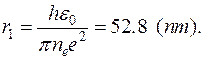
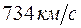 ?
?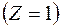 равен
равен  . Из боровского квантового условия существования стационарных орбит
. Из боровского квантового условия существования стационарных орбит 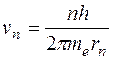 . Подставляя сюда выражение радиуса n -й орбиты и выражая
. Подставляя сюда выражение радиуса n -й орбиты и выражая 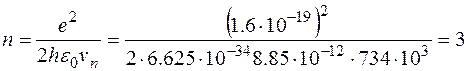 .
.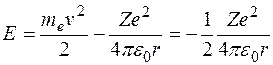 , так как
, так как 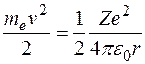 . Радиусы орбит могут принимать только дискретные значения. Отсюда следует, что энергия электрона может принимать только следующие дозволенные дискретные значения:
. Радиусы орбит могут принимать только дискретные значения. Отсюда следует, что энергия электрона может принимать только следующие дозволенные дискретные значения: 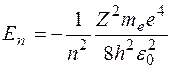 (
(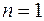 соответствует основное состояние атома; состояния с
соответствует основное состояние атома; состояния с 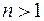 являются возбужденными.
являются возбужденными.


