
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Модель атома Томсона. Опыты по рассеиванию а-частиц. Ядерная модель атома.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Модель атома Томсона (модель «Пудинг с изюмом», англ. Plum pudding model). Дж. Дж. Томсон предложил рассматривать атом как некоторое положительно заряженное тело с заключёнными внутри него электронами. Эта модель не объясняла дискретный характер излучения атома и его устойчивость.[источник не указан 231 день] Была окончательно опровегнута Резерфордом после проведённого им знаменитого опыта по рассеиванию альфа-частиц. Дж.Дж.Томсон в 1903 году выдвинул гипотезу о том, что электрон находится внутри атома. Но атом в целом нейтральный, поэтому ученый предположил, что отрицательные электроны окружены в атоме положительно заряженным веществом. Атом, по мысли Дж. Томсона, очень похож на пудинг с изюмом: электроны, как "изюминки", а "каша" - положительно заряженное вещество атома (см. рис из "Открытая физика" 2.5) В 1913 г. английский физик Резерфорд проделал классические опыты по рассеянию a-частиц тонкими слоями различных веществ. a-частицы, испускаемые радиоактивными веществами, являются подходящими пробными зарядами для исследования внутриатомных электрических полей. Они представляют собой полностью ионизированные атомы гелия, имеют положительный заряд, равный удвоенному элементарному заряду (q = 3.2·10-19 Кл), массу m = 6.67·10-27кг, обладают высокой энергией (а значит и скоростью), достаточной для проникновения в атомы вещества. Схема опытов Резерфорда и его учеников Гейгера и Марсдена изображена на рис.1.Внутри герметичной камеры, в которой был создан высокий вакуум, находился свинцовый контейнер с радиоактивным элементом, испускавшим a-частицы. Узкий пучок частиц падал перпендикулярно на поверхность металлической (золотой) фольги, толщиной около 1 мкм (10-6м). Регистрация частиц производилась по вспышкам света (сцинтилляциям), вызываемыми ими на экране, покрытом люминофором. Экран был укреплен перед объективом на корпусе микроскопа, с помощью которого визуально наблюдали сцинтилляции и подсчитывали их число. Так определяли количество частиц, движущихся по данному направлению после их взаимодействия с атомами вещества. Микроскоп вместе с экраном мог вращаться вокруг вертикальной оси, походящей через центр камеры, для регистрации рассеянных атомами фольги частиц. На рисунке: 1- атом золота, 2- a-частицы Результаты опытов Резерфорда: 1.большинство частиц проходит через атомы вещества. не рассеиваясь (как через "пустоту"); 2.с увеличением угла рассеяния число отклонившихся от первоначального направления частиц резко уменьшается; 3.имеются отдельные частицы, отбрасываемые атомами назад, против их первоначального движения (как мяч от стенки). Резерфорд вывел формулу, по которой можно рассчитать количество a-частиц, рассеянных под определенными углами. В эту формулу входит характеристический параметр "d ", являющийся поперечным размером образований, отклоняющих частицы. Резерфорд дал объяснения рассеяния а-частиц, предложив в 1911 г. ядерную модель строения атома. Согласно этой модели атом состоит из массивного положительно заряженного ядра, очень малого по размерам. В ядре сосредоточена почти вся масса атома. Вокруг ядра на значительном расстоянии от него вращаются электроны, образующие электронную оболочку атома. Размер всего атома около 10-8 см, ядра — порядка 10-13 см, т. е. по размеру ядро примерно в 100 000 раз меньше атома. Поэтому большинство а-частиц пролетает через атомы металлической пластинки на сравнительно больших расстояниях от их ядер и не отклоняется от своего пути. Однако часть а-частиц проходит близко от ядра,; в результате возникают кулоновские силы отталкивания и частицы отклоняются. Те частицы, которые приближаются на достаточно малые расстояния к ядру, отклоняются еще более резко под действием тех же сил.
69.Тормозное рентгеновское излучение, Тормозное рентгеновское излучение – излучение электромагнитного поля, возникающее при разном торможении заряженных частиц в веществе. Для объяснения свойств теплового излучения пришлось ввести представление об испускании электромагнитного излучения порциями (квантами). Квантовая природа излучения подтверждается также существованием коротковолновой границы тормозного рентгеновского спектра. Рентгеновское излучение возникает при бомбардировке твердых мишеней быстрыми электронами (рис. 2.6) Здесь анод выполнен из W, Mo, Cu, Pt – тяжелых тугоплавких или с высоким коэффициентом теплопроводности металлов.
Только 1–3 % энергии электронов идет на излучение, остальная часть выделяется на аноде в виде тепла, поэтому аноды охлаждают водой. Попав в вещество анода, электроны испытывают сильное торможение и становятся источником электромагнитных волн (рентгеновских лучей). Начальная скорость электрона при попадании на анод определяется по формуле: >Заметное излучение наблюдается лишь при резком торможении быстрых электронов, начиная с U ~ 50 кВ, при этом (с – скорость света). В индукционных ускорителях электронов – бетатронах, электроны приобретают энергию до 50 МэВ, = 0,99995 с. Направив такие электроны на твердую мишень, получим рентгеновское излучение с малой длиной волны. Это излучение обладает большой проникающей способностью. Согласно классической электродинамике при торможении электрона должны возникать излучения всех длин волн от нуля до бесконечности. Длина волны, на которую приходится максимум мощности излучения, должна уменьшиться по мере увеличения скорости электронов, что в основном подтверждается на опыте (рис. 2.7).
Однако есть принципиальное отличие от классической теории: нулевые распределения мощности не идут к началу координат, а обрываются при конечных значениях Экспериментально установлено, что В данном эксперименте можно определить постоянную Планка h. Из всех методов определения постоянной Планка метод, основанный на измерении коротковолновой границы тормозного рентгеновского спектра, является самым точным.
Атом водорода по Бору. Бо́ровская моде́ль а́тома (Моде́ль Бо́ра) — полуклассическая модель атома, предложенная Нильсом Бором в 1913 г. За основу он взял планетарную модель атома, выдвинутую Резерфордом. Однако, с точки зрения классической электродинамики, электрон в модели Резерфорда, двигаясь вокруг ядра, должен был бы излучать непрерывно, и очень быстро, потеряв энергию, упасть на ядро. Чтобы преодолеть эту проблему Бор ввел допущение, суть которого заключается в том, что электроны в атоме могут двигаться только по определенным (стационарным) орбитам, находясь на которых они не излучают, а излучение или поглощение происходит только в момент перехода с одной орбиты на другую. Причем стационарными являются лишь те орбиты, при движении по которым момент количества движения электрона равен целому числу постоянных Планка[1]:
Здесь me — масса электрона, Z — количество протонов в ядре, Именно такое выражение для энергии можно получить, применяя уравнение Шрёдингера, решая задачу о движении электрона в центральном кулоновском поле. Радиус первой орбиты в атоме водорода R0=5,2917720859(36)×10−11 м[2], ныне называется боровским радиусом, либо атомной единицей длины и широко используется в современной физике. Энергия первой орбиты E 0 = − 13.6 эВ представляет собой энергию ионизации атома водорода. Достоинства теории Бора 1) Объяснила дискретность энергетических состояний водородоподобных атомов. 2)Теория Бора подошла к объяснению внутриатомных процессов с принципиально новых позиций, стала первой полуквантовой теорией атома. 3)Эвристическое значение теории Бора состоит в смелом предположении о существовании стационарных состояний и скачкообразных переходов между ними. Эти положения позднее были распространены и на другие микросистемы. Недостатки теории Бора 1) Не смогла объяснить интенсивность спектральных линий. 2)Справедлива только для водородоподобных атомов и не работает для атомов, следующих за ним в таблице Менделеева. 3)Теория Бора логически противоречива: не является ни классической, ни квантовой. В системе двух уравнений, лежащих в её основе, одно — уравнение движения электрона — классическое, другое — уравнение квантования орбит — квантовое. Теория Бора являлась недостаточно последовательной и общей. Поэтому она в дальнейшем была заменена современной квантовой механикой, основанной на более общих и непротиворечивых исходных положениях. Сейчас известно, что постулаты Бора являются следствиями более общих квантовых законов. Но правила квантования типа широко используются и в наши дни как приближенные соотношения: их точность часто бывает очень высокой.
|
||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 792; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.146.176.112 (0.009 с.) |


 (рис.1)
(рис.1)
 где U – ускоряющее напряжение.
где U – ускоряющее напряжение. Рис. 2.7
Рис. 2.7 – это и есть коротковолновая граница рентгеновского спектра.
– это и есть коротковолновая граница рентгеновского спектра. Существование коротковолновой границы непосредственно вытекает из квантовой природы излучения. Действительно, если излучение возникает за счёт энергии, теряемой электроном при торможении, то энергия кванта не может превысить энергию электрона eU, т.е.
Существование коротковолновой границы непосредственно вытекает из квантовой природы излучения. Действительно, если излучение возникает за счёт энергии, теряемой электроном при торможении, то энергия кванта не может превысить энергию электрона eU, т.е.  , отсюда
, отсюда  или
или  .
.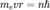 . Используя это допущение и законы классической механики, а именно равенство силы притяжения электрона со стороны ядра и центробежной силы, действующей на вращающийся электрон, он получил следующие значения для радиуса стационарной орбиты Rn и энергии En находящегося на этой орбите электрона:
. Используя это допущение и законы классической механики, а именно равенство силы притяжения электрона со стороны ядра и центробежной силы, действующей на вращающийся электрон, он получил следующие значения для радиуса стационарной орбиты Rn и энергии En находящегося на этой орбите электрона: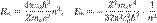
 — диэлектрическая постоянная, e — заряд электрона.
— диэлектрическая постоянная, e — заряд электрона.


