
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Световое давление. Эффект КомптонаСодержание книги
Поиск на нашем сайте
1. Чему равна масса фотона?
а) б) в) г)
2. Чему равно давление света (в общем случае)?
а) б) в) г)
3. В чем заключается эффект Комптона?
а) В рассеянных различными веществами рентгеновских лучах наряду с излучением первоначальной длины волны содержатся лучи большей длины волны. б) Налетая на свободный покоящийся электрон, фотон меняет направление своего движения, т. е. рассеивается. в) Изменение длины волны фотона при рассеянии не зависит от длины волны падающего фотона и от природы рассеивающего вещества. г) Рассеяние фотона возможно лишь при взаимодействии его со свободным электроном.
4. Чему равно изменение длины волны при рассеянии фотона на свободном электроне?
а) б) в) г)
Теория атома Бора
1. Какой вариант дает вывод о том, что атом имеет сложное строение?
а) Испускание света атомами дает основание утверждать, что в атоме есть источники света. б) Оптические исследования показали, что атомы вещества способны испускать свет (видимые электромагнитные волны). Поскольку электромагнитные волны испускаются ускоренно движущимися электрическими зарядами, можно заключить, что электрически нейтральные атомы содержат и положительные, и отрицательные заряды, способные перемещаться ускоренно. в) Поглощение света атомами позволяет заключить, что они обладают какими-то механизмами поглощения. г) Заключение о сложном строении атома можно сделать, имея в виду невидимые излучения, испускаемые некоторыми веществами (например, радиоактивными). 2. Модель атома, предложенная Томсоном.
а) Сфера, заполненная частицами, каждая из которых несет равные положительный и отрицательный заряд. Частицы совершают хаотические движения, возбуждающие в пространстве электромагнитные волны. б) Атом – это сфера, одна половина которой заряжена положительно, другая – отрицательно. Вращательное движение сферы приводит к излучению электромагнитных волн. в) Положительно заряженное вещество равномерно распределено по сфере диаметром г) Атом состоит из положительно заряженного ядра и упруго связанных с ним электронов. Силы притяжения между ядром и электронами периодически сменяются силами отталкивания, что заставляет их совершать колебания, приводящие к излучению электромагнитных волн.
3. В чем результаты опыта Резерфорда противоречили модели атома Томсона?
а) Поскольку фольга в целом электрически нейтральна, то положительно заряженные a -частицы, налетев на фольгу, должны были испытать упругое соударение и отскочить от фольги. Однако большая часть a -частиц прошла сквозь фольгу. б) Для того чтобы a -частица, имеющая энергию в несколько мегаэлектронвольт, могла быть отброшена назад, необходимо, чтобы при столкновении на нее подействовали очень большие силы, что возможно только в том случае, если при столкновении a -частицы и атома их центры сближаются на расстояние в) Электронов в атомах золотой фольги много. Их суммарный отрицательный заряд должен был притянуть положительно заряженные a -частицы. Однако этого не произошло – основная масса a -частиц прошла мимо. г) Согласно модели атома Томсона a -частицы не могут пройти через фольгу – фольга непрозрачна, так как атомы заполняют все пространство. a -частицы должны остановиться, передав свою энергию и импульс фольге. Однако основная масса частиц проходит сквозь фольгу, не меняя своего направления.
4. Модель атома, предложенная Резерфордом.
а) Атом состоит из положительно заряженного ядра с зарядом б) Атом состоит из положительно заряженного ядра с зарядом в) Атом состоит из положительно заряженного ядра и упруго связанных с ним электронов. Силы притяжения между ядром и электронами периодически сменяются силами отталкивания, что заставляет их совершать колебания, приводящие к излучению электромагнитных волн. г) Атом состоит из положительно заряженной пространственной решетки, в некоторых ячейках которой находятся отрицательно заряженные электроны. Время от времени электроны скачком меняют свое местоположение, скачком перемещаясь в соседнюю ячейку. При этом испускается квант света.
5. Недостатки модели атома, предложенной Резерфордом.
а) Модель атома Резерфорда противоречила классической теории электродинамики. Электрон, двигаясь по криволинейной траектории (т. е. с нормальным ускорением, отличным от нуля), должен испускать электромагнитные волны, которые уносят с собой энергию. Эта энергия может создаваться только за счет кулоновского взаимодействия электрона с ядром. В результате электрон должен двигаться по спирали и упасть на ядро. Но атомы – устойчивые образования. б) Модель атома Резерфорда не объясняла электрической нейтральности атома в целом. в) Модель атома Резерфорда не объясняла, как ведут себя электроны в случае пересечения их орбит. г) Модель атома Резерфорда не объясняла соотношения размеров ядра и электрона.
6. Что было обнаружено при исследовании спектров излучения разреженных газов?
а) Спектры разреженных газов линейчатые. б) Линии спектров объединяются в серии. в) Расстояние между линиями в серии с уменьшением длины волны уменьшаются. г) Яркость линий с уменьшением длины волны увеличивается.
7. Что устанавливает формула Бальмера?
а) Расстояние между линиями в спектре атома водорода. б) Частоты всех спектральных линий видимой части спектра атома водорода. в) Количество линий в спектре атома водорода. г) Связь между спектральными линиями в спектре атома водорода.
8. Формула Бальмера:
а) б) в) г)
9. Сколько серий обнаружено в спектре атома водорода?
а) Три. б) Шесть. в) Девять. г) Двенадцать.
10. Что устанавливает обобщенная формула Бальмера?
а) Количество спектральных линий в каждой серии. б) Расстояние между линиями во всех сериях спектра атома водорода. в) Частоты спектральных линий всех серий спектра атома водорода. г) Связь между спектральными линиями во всех сериях.
11. Обобщенная формула Бальмера:
а) б) в) г)
12. Первый постулат Бора:
а) спектр излучения изолированных атомов состоит из спектральных линий дискретных частот, соответствующих строго определенным орбитам электронов; б) количество дискретных орбит, по которым могут двигаться электроны вокруг ядра в атоме, бесконечно много. Находясь на какой-либо орбите, электрон испускает волну строго определенной частоты; в) электрон, движущийся по стационарной орбите, не излучает электромагнитных волн; г) из бесконечного множества электронных орбит, возможных с точки зрения классической механики, осуществляются в действительности только некоторые дискретные орбиты, удовлетворяющие определенным квантовым условиям. Электрон, находящийся на одной из этих орбит, несмотря на то, что он движется с ускорением, не излучает электромагнитных волн (света).
13. Второй постулат Бора:
а) излучение испускается или поглощается в виде светового кванта б) электрон, переходя из состояния с большей энергией в состояние с меньшей энергией, лишнюю энергию испускает в виде светового кванта; в) энергия атома есть величина квантовая – она может изменяться только порциями г) количество дискретных орбит, по которым могут двигаться электроны вокруг ядра в атоме, бесконечно много. Находясь на какой-либо орбите, электрон испускает волну строго определенной частоты.
14. Квантовое условие, определяющее действительные орбиты в атоме водорода (по Бору):
а) б) в) г)
15. Что было обнаружено в опытах Франка и Герца?
а) В спектре атомов ртути, бомбардируемых электронами, была обнаружена спектральная линия, соответствующая энергии, передаваемой электроном атому ртути. б) В опытах определена зависимость силы тока в цепи анода в зависимости от напряжения между катодом и сеткой. в) Пока энергия электронов, разгоняемых разностью потенциалов между катодом и сеткой, меньше некоторого значения г) В опытах Франка и Герца было непосредственно обнаружено существование у атомов дискретных энергетических уровней.
16. Выражение для радиуса n -й стационарной орбиты (по Бору):
а) б) в) г)
17. Выражение для энергии электрона, находящегося на n -й орбите (по Бору):
а) б) в) г)
18. Выражение для постоянной Ридберга (по Бору):
а) б) в) г)
Основы квантовой механики
1. В чем заключается гипотеза Луи де Бройля?
а) Все физические тела обладают волновыми свойствами. б) Дуализм присущ не только оптическим явлениям, но и всем микрообъектам. в) С каждым микрообъектом связан волновой процесс с длиной волны, определяемой соотношением г) Всякий микрообъект обладает волновыми свойствами, которые проявляются лишь в некоторых явлениях.
2. Каковы соотношения между корпускулярными и волновыми характеристиками по де Бройлю?
а) б) в) г)
3. Почему волновые свойства не проявляются у макроскопических тел?
а) Длина волны, соответствующая макроскопическому телу очень мала и не может быть измерена. б) Волновой процесс, присущий макроскопическому телу, имеет очень малую интенсивность и практически незаметен. в) Макроскопическим телам не присущи волновые процессы. г) Амплитуда колебаний макроскопического тела очень мала и современными методами неизмерима. 4. Физический смысл соотношения неопределенностей Гейзенберга:
а) вследствие двойственной корпускулярно-волновой природы микрообъектов нельзя говорить о движении их по определенной траектории; б) соотношение неопределенностей Гейзенберга устанавливает для микрочастицы связь классических характеристик движения (координаты и импульса) с волновыми (частотой и длиной волны); в) невозможность одновременно точно определить координату и соответствующую составляющую импульса не связана с несовершенством методов измерения или измерительных приборов; г) микрочастица не может иметь одновременно абсолютно точные значения координаты и соответствующей этой координате составляющей импульса.
5. Какая проблема встала перед физикой в связи с установлением корпускулярно-волнового дуализма у микрочастиц?
а) Возникла необходимость создания механики микрочастиц, которая учитывала бы и их волновые свойства. б) Проблема объяснения с позиций классической физики существования у микрочастиц волновых свойств. в) Проблема установления связи корпускулярных характеристик с волновыми. г) Проблема определения значений волновых характеристик для микрочастиц.
6. Что описывает уравнение Шредингера?
а) Вероятностный характер дифракционной картины для микрочастиц. б) Распределение потоков микрочастиц, рассеянных или отраженных по различным направлениям. в) Состояние микрочастиц в зависимости от их корпускулярных и волновых свойств. г) Вероятность нахождения микрочастицы в заданном объеме.
7. Общее уравнение Шредингера:
а) б) в) г)
8. Сколько квантовых чисел характеризуют состояние электрона в атоме?
а) Два. б) Четыре. в) Шесть. г) Восемь.
9. Что определяет главное квантовое число?
а) Энергетические уровни электрона в атоме. б) Момент импульса электрона при его движении вокруг ядра. в) Количество электронов на данном энергетическом уровне. г) Количество энергетических уровней в атоме.
10. Что определяет орбитальное квантовое число?
а) Направление движения электрона по орбите. б) Скорость движения электрона по орбите. в) Импульс электрона в атоме. г) Момент импульса электрона в атоме.
11. Что определяет магнитное квантовое число?
а) Проекцию скорости движения электрона по орбите на заданное направление. б) Направление перехода электрона с орбиты на орбиту. в) Проекцию импульса электрона на заданное направление. г) Проекцию момента импульса электрона на заданное направление.
12. Что определяет магнитное спиновое квантовое число?
а) Проекцию спина на заданное направление. б) Направление спина. в) Величину спина. г) Связь спина с другими квантовыми характеристиками электрона.
13. Какие значения принимает орбитальное квантовое число?
а) б) в) г)
14. Какие значения принимает магнитное квантовое число?
а) б) в) г)
15. Какие значения принимает магнитное спиновое квантовое число?
а) б) в) г)
16. Сколько электронов может находиться в состоянии, определяемом главным квантовым числом
а) б) в) г)
17. Принцип Паули:
а) в одном и том же атоме не может быть двух электронов с одинаковой энергией; б) в одном и том же атоме не может быть двух электронов, обладающих одинаковой совокупностью (одинаковым набором) четырех квантовых чисел в) каждый набор четырех квантовых чисел определяет состояние атома; г) в одном и том же атоме не может быть более двух электронов, обладающих одинаковыми магнитными квантовыми числами.
18. Распределение электронов в многоэлектронном атоме.
а) В многоэлектронном атоме электроны распределены без какой-либо системы. б) В многоэлектронном атоме каждому электрону присуща своя комбинация четырех квантовых чисел в) В многоэлектронном атоме электроны объединены в группы, каждая из которых соответствует определенному орбитальному квантовому числу. Количество электронов в группе определяется квантовыми числами г) В многоэлектронном атоме электроны распределяются по оболочкам, соответствующим главному квантовому числу
19. Как строится Периодическая система элементов Менделеева?
а) Все известные химические элементы объединены в группы, соответствующие одинаковой валентности. Внутри группы элементы располагаются по возрастанию атомной массы. б) Химические элементы в системе расположены по мере возрастания порядковых номеров; каждый последующий элемент системы образуется из предыдущего прибавлением к ядру одного протона и, соответственно, прибавлением одного электрона. в) Все известные химические элементы разделены на семь периодов в соответствии с заполнением электронами оболочек, соответствующих значениям главных квантовых чисел. г) Все известные химические элементы разделены на девять групп по сходности химических и физических свойств.
20. Чем вызвана периодичность свойств химических элементов?
а) Периодичность свойств химических элементов обусловлена одинаковым количеством электронов в подоболочках с одинаковым значением орбитального квантового числа б) Периодичность свойств химических элементов обусловлена одинаковым заполнением электронных оболочек. в) Периодичность свойств химических элементов вызвана тем, что эти свойства определяются числом внешних валентных электронов, а число валентных электронов периодически повторяется. г) Периодичность свойств химических элементов вызвана кратностью массовых чисел.
21. Почему на химические свойства атома оказывают влияние не все электроны, а только валентные?
а) Энергия, выделяемая или поглощаемая при химических реакциях, не превышает нескольких электронвольт на атом, а этой энергии достаточно только для того, чтобы изменить расположение внешних (валентных) электронов. Ее слишком мало, чтобы изменить орбиты внутренних электронов. б) Валентные электроны имеют значительно большую энергию, чем внутренние электроны, и легче отрываются от атома. в) Внешние валентные электроны находятся ближе к внешней границе атома, чем внутренние электроны, и испытывают большее влияние со стороны атомов вещества, реагирующего с данным веществом. г) Валентные электроны слабее связаны с ядром и обладают достаточно небольшой энергией, чтобы изменить их положение.
|
||||
|
Последнее изменение этой страницы: 2016-08-10; просмотров: 291; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.37.200 (0.01 с.) |

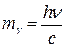 .
. .
.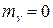 .
. .
.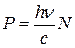 .
. .
. .
.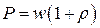 .
. .
. .
. .
. .
. и в нем «плавают» электроны. Колебательные движения электронов возбуждают в пространстве электромагнитные волны.
и в нем «плавают» электроны. Колебательные движения электронов возбуждают в пространстве электромагнитные волны. , а не
, а не  , т. е. на расстояние, значительно меньшее, чем размер атома.
, т. е. на расстояние, значительно меньшее, чем размер атома. (
(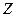 – порядковый номер в системе Менделеева;
– порядковый номер в системе Менделеева;  – элементарный заряд) и отрицательно заряженной частицы (с зарядом
– элементарный заряд) и отрицательно заряженной частицы (с зарядом  . Размер области, в которой движутся электроны
. Размер области, в которой движутся электроны  ;
; ;
; .
. ;
;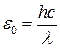 ;
;
 при переходе электрона из одного стационарного состояния в другое. Величина светового кванта равна разности энергий тех стационарных состояний, между которыми совершается квантовый скачок электрона
при переходе электрона из одного стационарного состояния в другое. Величина светового кванта равна разности энергий тех стационарных состояний, между которыми совершается квантовый скачок электрона  . Частота излучаемой линии
. Частота излучаемой линии  . (Если
. (Если  , происходит излучение фотона. Если
, происходит излучение фотона. Если 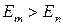 – поглощение). Набор возможных частот определяет спектр атома;
– поглощение). Набор возможных частот определяет спектр атома;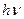 , при излучении света – уменьшается на
, при излучении света – уменьшается на  ;
; ;
; ;
; .
. , соударения между электроном и атомом ртути носят упругий характер.
, соударения между электроном и атомом ртути носят упругий характер. ;
; ;
; ;
; .
. ;
; ;
; ;
;
 ;
; ;
; ;
; .
. .
. .
. .
. .
. .
. .
. .
.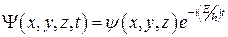 .
. .
. ,
,  – главное квантовое число.
– главное квантовое число. ,
,  ,
,  ,
, 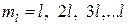 ,
, 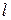 – орбитальное квантовое число.
– орбитальное квантовое число. ,
,  ,
,  ,
,  ,
,  – магнитное квантовое число.
– магнитное квантовое число. ,
,  .
. ,
,  ?
? ,
,  ,
,  ,
, 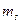 - магнитное спиновое квантовое число.
- магнитное спиновое квантовое число. ,
,  – магнитное спиновое квантовое число.
– магнитное спиновое квантовое число. ;
; , поэтому каждый из них вращается вокруг ядра по собственной орбите независимо от других.
, поэтому каждый из них вращается вокруг ядра по собственной орбите независимо от других. .
. квантовыми числами.
квантовыми числами. .
.


