
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теплоты сольватации (гидратации)Содержание книги
Поиск на нашем сайте
Как было показано выше, процесс электролитической диссоциации требует значительной затраты энергии. Происхождение этой энергии даже не рассматривалось в теории Аррениуса. По общепринятым сейчас представлениям, энергия, обеспечивающая появление ионов, выделяется в самом процессе электролитической диссоциации и представляет собой результат взаимодействия между растворяемым веществом и растворителем. Благодаря этому взаимодействию образуются комплексы, содержащие молекулы растворителя – сольватированные (гидратированные) ионы. Энергетические эффекты, наблюдающиеся при этом, были названы, по предложению Фаянса (1915), энергиями сольватации (DGs = Us ) или, в водных средах, гидратации (DGг = Uг ), а соответствующие тепловые эффекты – теплотами сольватации (– DНs = Все вещества, образующие ионы при растворении, можно разбить на две группы в зависимости от их строения и природы связей. К первой из них относятся соединения, кристаллическая решетка которых построена из ионов, – ионофоры. Для таких веществ термин «электролитическая диссоциация» не очень удачен, так как в них и до процесса растворения не было молекул. Сольватация в этом случае является источником энергии не процесса диссоциации молекул, а процесса разрушения решетки с образованием свободных ионов. Поэтому в растворителях с высокой диэлектрической проницаемостью все ионофоры – сильные электролиты. К другой группе относятся молекулярные вещества – ионогены. Образование ионов при растворении ионогенов происходит лишь благодаря их химическому взаимодействию с растворителем. Энергия, необходимая для разрыва химической связи, компенсируется энергией связи протона с молекулой воды в ионе гидроксония (если один из ионов – ион водорода) и энергией гидратации ионов Н3О+ и А–. Ионогены в водных растворах обычно слабые электролиты. И для ионофоров, и для ионогенов конечными продуктами взаимодействия между растворяемым веществом и растворителем являются сольватированные ионы, а энергетические эффекты проявляются как энергии сольватации. Чтобы доказать это, надо рассчитать энергию сольватации и сопоставить ее с энергией кристаллической решетки (энергией химической связи). Если эти энергии окажутся близкими, то вывод о разрушении решетки соли (нейтральной молекулы ионогена) за счет ион-дипольного взаимодействия можно считать правильным. Энергии и теплоты сольватации электролитов впервые были рассчитаны Борном и Габером (1919) при помощи циклов, основанных на законе Гесса. NaCl (кр)
Na+ (aq) + Cl– (aq) DHNaCl – изменение энтальпии в ходе разрушения кристаллической решетки хлорида натрия (связь с энергией решетки: DGp = DHNaCl – TDS; при 298К TDS составляет приблизительно 15 кДж/моль); DHL – теплота растворения хлорида натрия, экстраполированная на бесконечно разбавленный раствор соли; DHs+, DHs– – теплоты сольватации катиона и аниона. Из этого цикла для теплоты сольватации хлорида натрия получаем DHsNaCl = DHs+ + DHs– = DHL – DHNaCl = 4 – 772 = – 768 кДж/моль. Данное уравнение позволяет найти теплоту гидратации, если известны теплоты растворения и энергия решетки. Теплоты растворения находят экспериментально, а энергии решеток рассчитывают либо по соответствующим уравнениям, либо из циклов, используя другие экспериментально определимые величины. Как видно из расчета, теплоты гидратации имеют тот же порядок, что и энергия решеток, и могут обеспечить распад кристалла на отдельные ионы. Экспериментальные теплоты гидратации ионов. Разности теплот гидратации электролитов с одним общим ионом, например, DНгLiF – DНгNaF, DНгLiCl – DНгNaCl или DНгNaF – DНгNaCl, DНгKF – DНг KCl мало отличаются друг от друга. Следовательно, теплоты гидратации соединений аддитивно слагаются из теплот гидратации образующих их ионов. Из таблицы 1 видно, что если в ряду гидроксидов щелочных металлов принять теплоту гидратации иона цезия равной нулю, то относительные теплоты гидратации катионов буду расти в направлении от Cs к Li; подобные же результаты получаются и для теплот гидратации анионов при допущении, что теплота гидратации аниона иода принята равной нулю (таблица 2). Таким образом, размеры иона играют важную роль в процессе гидратации: как правило, теплоты в ряду близких по свойствам ионов увеличиваются при уменьшении их радиуса. Теплота гидратации растет с увеличением заряда иона (см. таблицу 3).
Таблица 1 Зависимость относительной теплоты гидратации катионов от их радиуса в ряду гидроксидов щелочных металлов
Таблица 2 Зависимость относительной теплоты гидратации анионов от их радиуса в ряду галогенидов лития
Таблица 3 Изменение теплоты гидратации галогенидов металлов с зарядом катиона
Теплоты гидратации отдельных ионов можно получить из опытных значений теплот гидратации соединений, приписав каждому из ионов некоторую долю суммарной теплоты гидратации. Полученные таким методом теплоты гидратации отдельных ионов называются экспериментальными, хотя все они являются в большей или меньшей степени произвольными и зависят от сделанных предположений. Их нельзя поэтому рассматривать как опытные, и их сравнение с вычисленными теплотами гидратации не дает возможности судить о степени совершенства того или иного теоретического метода. Для разделения теплот гидратации электролитов на их ионные составляющие были предложены также экстраполяционные способы, основанные на зависимости теплот гидратации от радиусов ионов. Теплоты гидратации ионов реальные и химические. При проведении цикла Борна – Габера, позволяющего рассчитать теплоту гидратации электролита, свободные ионы переносятся из газовой фазы в жидкую через межфазную границу с локализованным в ней поверхностным скачком потенциала cL. Каждый моль ионов совершает при этом электрическую работу zi F cL (zi F – заряд 1 моля i -го иона), которая включается в энергию (или теплоту) сольватации. Величины энергии (теплоты) сольватации отдельных ионов, определенные с учетом электрической компоненты zi F cL, называют реальными, а величины, не включающие ее, называют химическими: DGs(реал) = DGs(хим) + zi F cL. Из экспериментальных данных можно рассчитать только DGs(реал); величины DGs(хим) и zi F cL опытному определению недоступны. С другой стороны, все модельные методы расчета дают DGs(хим), и, следовательно, строгая экспериментальная проверка этих моделей невозможна. Модельные оценки величины cL для водных растворов показывают, что cL» + 0,1 В. Поэтому в настоящее время наиболее точные значения DGs(хим) можно рассчитать по вышеприведенному уравнению, используя опытные DGs(реал) и значения cL, полученные на основе модельных оценок. Для водных растворов при условии, что cL» 0,1 В, zi F cL» 10 zi кДж/моль, где zi учитывает не только величину, но и знак заряда иона. Для молекулы электролита (и всего электролита в целом) вследствие электронейтральности соблюдается равенство S n i zi = 0 или S n i zi F cL = 0. Электрические компоненты для положительных и отрицательных ионов взаимно компенсируются. Энергия сольватации электролита в целом не зависит от существования скачка потенциала на границе между раствором и вакуумом; реальная и химическая энергии сольватации для электролита совпадают.
|
||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 1850; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.2.239 (0.006 с.) |

 ) и гидратации (– DНг =
) и гидратации (– DНг = 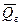 ).
).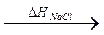 Na+(газ) + Cl–(газ)
Na+(газ) + Cl–(газ)
 DНг ), кДж/моль
DНг ), кДж/моль



