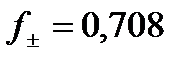Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема: Определение кажущейся степени диссоциации хлорида калия криоскопическим методомСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Цель работы: научиться определять кажущуюся степень диссоциации сильного электролита криоскопическим методом.
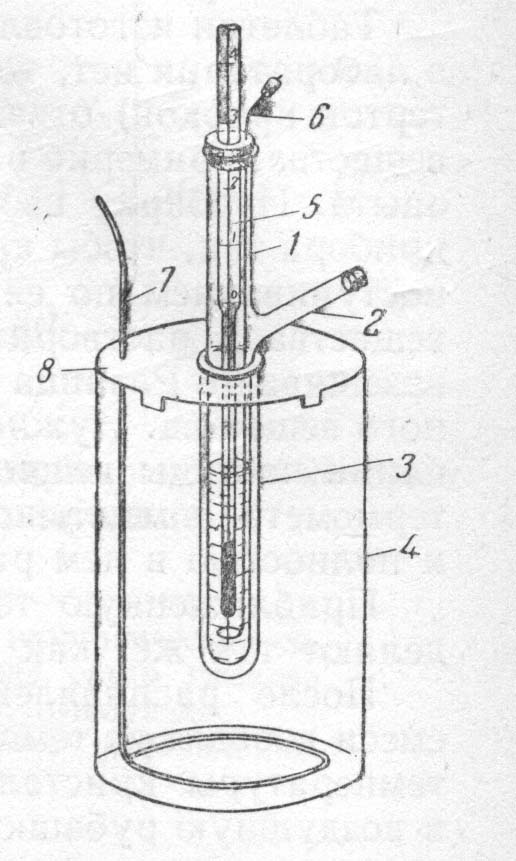
Оборудование и реактивы: прибор для определения молекулярной массы криоскопическим методом (рис. 1): пробирка с боковым отростком, широкая пробирка, толстостенный стакан, термометр Бекмана, мешалки, крышка; аналитические весы с разновесом, мерный цилиндр, шпатель, снег (толченый лед) и хлорид натрия для охладительной смеси, бюкс с 1,2-1,5 г хлорида калия, дистиллированная вода.
Теоретические пояснения
Электролитическая диссоциация – это распад веществ в расплаве или в растворе на свободно составляющие их ионы. По способности веществ распадаться или не распадаться на ионы различают электролиты и неэлектролиты. Электролиты – это вещества, которые подвергаются электролитической диссоциации, и вследствие чего их растворы или расплавы проводят электрический ток. К электролитам относятся все соли, а также кислотные, основные и амфотерные гидроксиды. Неэлектролиты – это вещества, которые не подвергаются электролитической диссоциации, и вследствие чего их растворы или расплавы не проводят электрический ток. К неэлектролитам относится большинство органических соединений. Электролитическая диссоциация потенциальных электролитов представляет собой равновесный процесс. Электролит может диссоциировать на ионы почти полностью или частично, что зависит от вида электролита и от концентрации его в растворе, а также от температуры раствора. Одной из количественных характеристик неполной электролитической диссоциации электролитов является степень диссоциации α, равная:
где Степень диссоциации электролита – это частное от деления числа продиссоциированных молекул к общему числу молекул электролита введенных в раствор. Степень диссоциации изменяется в пределах Степень электролитической диссоциации связана с изотоническим коэффициентом соотношением:
где i - изотонический коэффициент, n - число ионов, на которые распадается электролит. Так как при диссоциации электролита число частиц в растворе будет больше чем при растворении такого же количества неэлектролита, это обуславливает понижение температуры замерзания раствора по сравнению с растворителем:
где i - изотонический коэффициент (для электролитов больше 1),
где Учитывая (2) и (3), выражение (1) можно записать в виде:
Таким образом, степень диссоциации электролита можно определить методом криоскопии, для этого необходимо измерить понижение температуры замерзания его раствора и воспользоваться формулой (4). Для растворов сильных электролитов определенная таким образом степень электролитической диссоциации будет кажущейся (α<1, тогда как на самом деле α=1). Это объясняется тем, что образующиеся при диссоциации электролита ионы взаимодействуют друг с другом (притягиваются), что как бы приводит к уменьшению числа частиц в растворе и понижает значение α. Диссоциация – это обратимый равновесный процесс, который характеризуется константой равновесия, называемой константой диссоциации Кд.
где С – молярная концентрация электролита моль/л. Так вычисляют условную константу диссоциации, поскольку, используя для расчета молярную концентрацию, не учитывают взаимодействие ионов в растворе. Для вычисления истинной константы диссоциации используют активную концентрацию или активность а. Активная концентрация отражает суммарное взаимодействие ионов в растворе между собой, с молекулами растворенного вещества и с молекулами растворителя. Активность вычисляют по формуле:
где f - коэффициент активности ионов, зависящий от концентрации и состава раствора, заряда, природы иона, температуры и других факторов. В разбавленных растворах (С не превышает 0,5 моль/л) коэффициент активности зависит только от заряда иона и ионной силы, которая вычисляется по формуле:
где Сi – концентрации, а zi – заряды всех находящихся в растворе ионов. В последней формуле под Сi следует понимать моляльность, однако для разбавленных растворов, для которых справедлива эта формула моляльность не сильно отличается от молярности. В разбавленных растворах средний коэффициент активности вычисляют по формуле Дебая-Гюккеля:
Таким образом, активность ионов в разбавленном растворе можно вычислить по формуле:
где С - концентрация ионов моль/л, Понятие активности применимо и к электролиту в целом. Активность электролита равна произведению активностей его ионов. Для электролита
Средняя активность ионов электролита рассчитывается по формуле:
Используя активность можно вычислить истинную константу диссоциации:
Константа диссоциации связана со степенью электролитической диссоциации уравнением, которое справедливо для разбавленных растворов:
где С0 - исходная концентрация электролита моль/л, α - степень электролитической диссоциации. Для очень слабых электролитов можно использовать соотношение:
Методика проведения опыта
1. Подготовить термометр Бекмана, так как это было описано в предыдущей работе. 2. Собрать прибор по рис. 1, предварительно заполнив толстостенный стакан охладительной смесью, состоящей из трех частей снега (толченого льда) и одной части поваренной соли. Температура смеси должна быть -5 -7 0С. Ее можно регулировать при помощи изменения соотношения снега (льда) и соли. 3.Отмерить 10 мл Н2О и влить через боковой отросток в пробирку 1 (масса растворителя Н2О 10 г).
 ). ).
6. Взвесить на аналитических весах бюкс, в котором находится 0,3-0,5 г хлорида калия ( 7. Всыпать 8. Взвесить бюкс с остатком хлорида калия ( 9. По разнице масс ( 10. Определить температуру замерзания раствора хлорида калия так, как это было описано в пункте 4. Измерения повторить еще раз ( 11. Рассчитать кажущуюся степень электролитической диссоциации по формуле (4). 12. Результаты опыта представить в виде таблицы:
13. Выводы. Примеры решения задач
Пример 1: Вычислите молярную концентрацию раствора уксусной кислоты, если известно, что степень диссоциации ее молекул в растворе составляет 1,36%, а константа диссоциации равна 1,74· 10-5.
Решение: Константа диссоциации связана со степенью диссоциации следующим уравнением:
из которого следует:
Пример 2: Определить активность СаСI2 в его 0,02 М растворе. Решение: Так как при диссоциации 1 моль хлорида кальция образуется 2 моль ионов хлора и 1 моль ионов кальция, то при концентрации хлорида кальция 0,02 моль/л молярная концентрация ионов хлора будет 0,04, а ионов кальция 0,02 моль/л. Рассчитаем ионную силу раствора:
Средний коэффициент активности ионов приближенно найдем по уравнению Дебая-Гюккеля:
Теперь можно рассчитать активность хлорида кальция:
17.4 Необходимый уровень подготовки студентов
1. Знать понятия: степень электролитической диссоциации, электролиты и неэлектролиты, константа диссоциации слабого электролита. 2. Знать физический смысл изотонического коэффициента и его связь со степенью диссоциации. 3. Иметь представление о кажущейся степени электролитической диссоциации. 4. Уметь вычислять активность электролита и коэффициент активности при приближенном расчете для разбавленных растворов электролитов через ионную силу.
Задания для самоконтроля
1. Вычислить изотонический коэффициент и кажущуюся степень электролитической диссоциации 3% -ного водного раствора хлорида калия, если он замерзает при -2 0С. 2. Вычислить активность АgNO3, если концентрация соли в растворе составляет 0,06 моль/л. 3. Определить активность CuCI2 в водном растворе, если для приготовления раствора на 100 г воды взяли 0,2 г CuCI2.
Литература
1. Глинка Н.Л. Общая химия.: учебное пособие для вузов / Под ред. А.И. Ермакова. - М.: Интеграл-Пресс, 2002 – 728 с. 2. Васильев В.П. Аналитическая химия в 2 кн. Кн. 1 Титриметрические и гравиметрический методы анализа. Кн. 2 Физико-химические методы анализа. – 2-е изд., перераб. и доп. – М.: Дрофа, 2002 3. Глинка Н.Л. Задачи и упражнения по общей химии.: учебное пособие для вузов - М.: Интеграл-Пресс, 2002 – 240 с. 4. Курс общей химии / Под ред. Н.В. Коровина. – М.: В.Ш., 1990 5. Романцева Л.М. и др. Сборник задач и упражнений по общей химии: Учеб. пособие для нехим. спец-ей вузов /Л.М. Романцева, З.Л. Лещинская, В.А. Суханова. -2-е изд., перераб. и доп. - М.: Высш. шк., 1991
Содержание
Лукашов Сергей Викторович Пашаян арарат александрович
Х И М И Я
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-13; просмотров: 1816; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.188.79 (0.01 с.) |


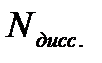 – число продиссоциированных молекул;
– число продиссоциированных молекул;  – общее число молекул.
– общее число молекул. (значение
(значение  относится к неэлектролитам,
относится к неэлектролитам,  <0,03 – к слабым электролитам, 0,03<
<0,03 – к слабым электролитам, 0,03<  – к сильным).
– к сильным).

 - понижение температуры замерзания раствора, определенное опытным путем,
- понижение температуры замерзания раствора, определенное опытным путем,  - понижение температуры, вычисленное без учета диссоциации электролита по формуле:
- понижение температуры, вычисленное без учета диссоциации электролита по формуле:
 - масса растворенного вещества в граммах,
- масса растворенного вещества в граммах,  - масса растворителя в граммах,
- масса растворителя в граммах,  - молярная масса растворенного вещества в г/моль,
- молярная масса растворенного вещества в г/моль,  - криоскопическая постоянная для воды равная 1,85
- криоскопическая постоянная для воды равная 1,85  , 1000- коэффициент пересчета от граммов растворителя к килограммам.
, 1000- коэффициент пересчета от граммов растворителя к килограммам.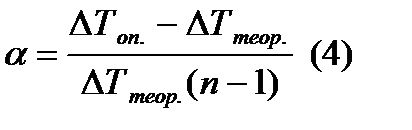

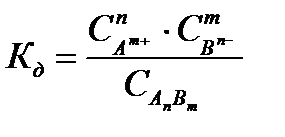



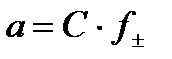
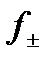 - средний коэффициент активности ионов.
- средний коэффициент активности ионов.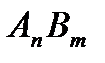 активность равна:
активность равна:



 .
. 4. Все время, перемешивая воду мешалкой, определить по температуре замерзания воды нулевую точку термометра. Нужно иметь в виду, что жидкость часто переохлаждается. Поэтому температурой замерзания воды следует считать температуру, которая устанавливается в момент замерзания после некоторого скачка вверх (
4. Все время, перемешивая воду мешалкой, определить по температуре замерзания воды нулевую точку термометра. Нужно иметь в виду, что жидкость часто переохлаждается. Поэтому температурой замерзания воды следует считать температуру, которая устанавливается в момент замерзания после некоторого скачка вверх ( ).
). ).
). взвешенного хлорида калия через боковой отросток в пробирку 1 и растворить его в находящейся там дистиллированной воде.
взвешенного хлорида калия через боковой отросток в пробирку 1 и растворить его в находящейся там дистиллированной воде. ).
). ) вычислить массу растворенного хлорида калия.
) вычислить массу растворенного хлорида калия. ).
).





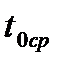



 .
.