
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема: Кинетика химических реакцийСодержание книги
Поиск на нашем сайте
Цель работы: изучение скорости химической реакции и ее зависимости от различных факторов: природы реагирующих веществ, концентрации, температуры. Оборудование и реактивы: химический стакан, термометр, штатив с пробирками, электроплитка, лучина, дистиллированная вода, 0,1М раствор НС1, 1,0 н, раствор H2SO4, 0,05 н раствор Na2S2O3, мел. Теоретические пояснения Кинетика – наука о скорости химических реакций. Скоростью химической реакции называют изменение концентрации реагирующего вещества в единицу времени. Скорость реакции зависит от ряда факторов: природы реагирующих веществ, концентрации реагирующих веществ, температуры, наличия катализатора. 1) Зависимость скорости реакции от концентрации выражается законом действующих масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам. Например, для реакции Н2(г) + I2 (г) → 2HI(г) закон действующих масс может быть записан Реакции в гетерогенной системе осуществляются на поверхности раздела между фазами. Поэтому скорость гетерогенных реакций при постоянной температуре зависит не только от концентрации веществ, но и от площади поверхности раздела. Так, для реакции: С(к) + О2(г) → СО2(г) закон действующих масс имеет вид 2) Зависимость скорости реакции от температуры выражается правилом Вант-Гоффа:
где v1 и v2 скорости реакции при Т2 и Т1, 3) Одним из методов ускорения химической реакции является катализ, который осуществляется при помощи веществ (катализаторов), увеличивающих скорость реакции, но не расходующихся в результате ее протекания. Механизм действия катализатора сводится к уменьшению величины энергии активации реакции, т.е. к уменьшению разности между средней энергией активных молекул (активного комплекса) и средней энергией молекул исходных веществ. Скорость химической реакции при этом увеличивается. Методика проведения опытов Опыт 1: Зависимость скорости реакции от концентрации реагирующих веществ.
Зависимость скорости реакции от концентрации реагирующих веществ изучают на примере взаимодействия тиосульфата натрия с серной кислотой: Nа2S2О3 + Н2S04 = Nа2SО4 + S02 + H2O + S Признаком реакции является помутнение раствора вследствие выделения серы. Заполните три бюретки: первую – 1н раствором Н2S04, вторую – 0,05 н раствором Nа2S2О3, третью — водой. Приведите бюретки в рабочее положение. Налейте в три пробирки из бюретки по 1 мл Н2S04. В другие три пробирки из бюреток налейте: в первую — 1 мл раствора Nа2S2О3 и 2 мл воды; во вторую – 2 мл раствора Nа2S2О3 и 1 мл воды; в третью – 3 мл раствора Nа2S2О3 и 0 мл воды. Заметив время, в первую пробирку прилейте из пробирки 1 мл отмеренного раствора серной кислоты и быстро перемешайте полученную смесь. Отметьте время начала помутнения раствора. Проделайте то же самое с двумя оставшимися пробирками. Рассчитайте vпракт для второго и третьего случаев, учитывая, что скорость реакции и время протекания реакции до начала помутнения раствора обратно пропорциональны. Следовательно:
где v1 – скорость реакции в первом случае (v1 = 1); v2 – скорость реакции во втором (третьем) случае; τ1 – время протекания реакции до начала помутнения раствора в первом случае, с; τ2 – время протекания реакции до начала помутнения раствора во втором случае, с. Результаты опыта внесите в таблицу 1:
Опыт 2: Зависимость скорости реакции от температуры. Зависимость скорости реакции от температуры изучают на примере реакции Nа2S2О3 + Н2S04 = Nа2SО4 + S02 + H2O + S По правилу Вант - Гоффа (при γ = 1,8) получаем, что при повышении температуры на 10° скорость реакции увеличится в 1,8 раза, на 20° - в 3,24 раза, на 30° - в 5,832 раза и т.д. Приведите бюретки с растворами Nа2S2О3, Н2S04 и водой в рабочее положение. В две пробирки из бюретки прилейте по 1 мл Н2S04. В две другие пробирки из бюреток прилейте по 1 мл раствора Nа2S2О3 и по 2 мл воды. Одну пару пробирок (одна пробирка с Н2S04, другая с 1 мл Nа2S2О3 и 2 мл воды) поместите в стакан с горячей водой с температурой на 10° выше комнатной. Через 5-7 мин, когда растворы нагреются до нужной температуры, смешайте их и определите время помутнения раствора, как в опыте 1. Другую пару пробирок поместите в термостат с температурой на 20о выше комнатной. Через 5-7 мин смешайте растворы и определите время начала помутнения. Рассчитайте vпракт для второго и третьего случаев (методика расчета дана выше). На миллиметровой бумаге постройте кривую зависимости vтеор от температуры. На этом же графике отметьте значения vпракт. Рассчитайте значение температурного коэффициента γпракт исходя из опытных данных. Результаты опыта (экспериментальные данные для комнатной температуры возьмите из опыта 1, № п/п 1) запишите в таблицу 2:
Примеры решения задач Пример 1: Вычисление скорости реакции по концентрациям реагирующих веществ. Реакция между веществами А и В протекает по уравнению 2А + В = С; концентрация вещества А равна 6 моль/л, а вещества В - 5 моль/л. Константа скорости реакции равна 0,5 л2∙моль -2∙с-1. Вычислите скорость химической реакции в начальный момент и в тот момент, когда в реакционной смеси останется 45 % вещества В. Решение: Согласно закону действующих масс скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам. Следовательно, для
Скорость химической реакции в начальный момент равна v = 0,5∙ 6 2 ∙5 = 90,0 моль ∙с -1∙ л -1 По истечении некоторого времени в реакционной смеси останется 45 % вещества В. т. е. концентрация вещества В станет равной 5,0∙0,45= 2,25 моль/л. Значит, концентрация вещества В уменьшилась на 5,0 - 2,25 = 2,75 моль/л. Так как вещества А и В взаимодействуют между собой в соотношении 2:1, то концентрация вещества А уменьшилась на 5,5 моль/л (2,75∙ 2) и стала равной 0,5 моль/л (6,0 - 5,5). Следовательно, v2 = 0,5∙(0.5)2 ∙ 2,25 = 0,28 моль∙с -1∙л -1. Пример 2: Как изменится скорость прямой реакции 2СО + О2 = 2СО2 если общее давление в системе увеличить в 4 раза? Решение: Увеличение давления в системе в 4 раза вызовет уменьшение объема системы в 4 раза, а концентрация реагирующих веществ возрастет в 4 раза. Согласно закону действующих масс начальная скорость реакции равна
после увеличения давления
После увеличения давления в 4 раза скорость реакции возросла в 64 раза.
5.4 Необходимый уровень подготовки студентов 1. Знать понятия: скорость химической реакции, катализ и катализатор, константа скорости химической реакции, энергия активации, порядок реакции. 2. Знать факторы, влияющие на скорость химической реакции. 3. Уметь выражать связь между скоростью реакции и концентраций реагирующих веществ на основе закона действующих масс. 4.Знать правило Вант - Гоффа, уметь применять его для нахождения скорости химической реакции при повышении температуры на определенное число градусов. Задания для самоконтроля 1. Что называют скоростью химической реакции? От каких факторов она зависит? 2. Как и почему изменяется скорость химической реакции при изменении температуры? 3. Что называют энергией активации? 4. От каких факторов зависит скорость химической реакции в гетерогенных системах? 5. Что называют катализатором? Какое влияние и почему оказывает катализатор на скорость химической реакции? 6. Что называют порядком реакции? Запишите кинетическое уравнение для реакции первого порядка. 7. Изобразите графически зависимость IgC от t для реакции первого порядка. 8. Константа скорости реакции А + 2В = ЗС равна 0,6 л2∙ моль -2∙с -1. В результате реакции концентрация вещества В оказалось равной 0,5 моль/л. Вычислите, какова концентрация вещества А и скорость прямой реакции? 9. На сколько градусов нужно повысить температуру, чтобы скорость реакции возросла в 90 раз? Температурный коэффициент равен 2,7.
Лабораторная работа №6
Тема: Химическое равновесие
Цель работы: изучение влияния различных факторов на химическое равновесие. Оборудование и реактивы: разбавленные растворы хлорида железа (III) и роданида аммония в бюретках, концентрированный раствор FeCI3, твердый хлорид аммония и роданид аммония, нитрат свинца (II), штатив и 4 пробирки, U -образная трубка, пробки с газоотводными трубками, спиртовка, два химических стакана, лед, электрическая плитка.
Теоретические пояснения
Понятие «химическое равновесие» применимо только к обратимым реакциям. Химическим равновесием называют такое состояние реагирующей системы, при котором скорость прямой реакции vпрям. равна скорости обратной реакции vобрат.. Равенство скоростей прямой и обратной реакций является кинетическим условием химического равновесия. Химическое равновесие характеризуется постоянным для данных условий соотношением равновесных концентраций всех веществ, участвующих во взаимодействии. Величина, равная отношению произведения равновесных концентраций Н2(г) +I2(г) = 2HI(г) константа равновесия имеет вид:
Константа равновесия зависит от природы реагентов, температуры и не зависит от исходной концентрации веществ в системе. Химическое равновесие остается неизменным до тех пор, пока постоянны параметры, при которых оно установилось. При изменении условий равновесие нарушается. Через некоторое время в системе вновь наступает равновесие, характеризующееся новым равенством скоростей и новыми равновесными концентрациями всех веществ. Равновесие смещается в ту или иную сторону потому, что изменение условий по-разному влияет на скорости прямой и обратной реакций. Равновесие смещается в сторону той реакции, скорость которой при нарушении равновесия становится больше. Например, если при изменении внешних условий равновесие нарушается так, что скорость прямой реакции становится больше скорости обратной реакции, то равновесие смещается вправо. В общем случае направление смещения равновесия определяется принципом Ле-Шателье: если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия.
Методика проведения опыта
Опыт 1: Влияние концентрации веществ на химическое равновесие.
В данном опыте изучают обратимую реакцию взаимодействия хлорида железа (III) с роданидом аммония. Роданид железа Fe(NCS)3 придает раствору красную окраску. По изменению интенсивности окраски можно судить об изменении концентрации Fe(NCS)3 т.е. о смещении равновесия в ту или иную сторону. В четыре пробирки внесите по 5-10 капель разбавленных растворов хлорида железа (III) FeCI3 и роданида аммония NH4CNS. Легким встряхиванием пробирок размешайте растворы. Поставьте все пробирки в штатив. В одну из пробирок добавьте несколько капель концентрированного раствора хлорида железа (III), в другую - несколько кристаллов роданида аммония, в третью - хлорида аммония, четвертую пробирку оставьте для сравнения. Растворы размешайте энергичным встряхиванием или стеклянной палочкой. При оформлении отчета отметьте изменение интенсивности окраски в каждом случае; запишите уравнение реакции между FeCI3 и NH4CNS и выражение константы равновесия данной реакции. В каком направлении смещается равновесие и как изменяется концентрация каждого компонента в случае добавления: а) хлорида железа (III); б) роданида аммония; в) хлорида аммония? Примеры решения задач
Пример 1: Вычисление константы равновесия реакции по равновесным концентрациям реагирующих веществ и определение их исходных концентраций.
При синтезе аммиака N2 +3H2 = 2NH3 равновесие установилось при следующих концентрациях реагирующих веществ (моль/л): Решение: Определяем константу равновесия Кс этой реакции:
Исходные концентрации азота и водорода находим на основе уравнения реакции. На образование 2 моль NH3, расходуется 1 моль азота, а на образование 3,6 моль аммиака потребовалось 3,6/2 = 1,8 моль азота. Учитывая равновесную концентрацию азота, находим его первоначальную концентрацию: Сисх(Н2) = 2,5 + 1,8 = 4,3 моль/л На образование 2 моль NH3 необходимо израсходовать 3 моль водорода, а для получения 3,6 моль аммиака требуется 3∙3,6/2 = 5,4 моль; учитывая равновесную концентрацию водорода, находим его исходную концентрацию: Сисх(Н2) = 1,8 + 5,4 = 7,2 моль/л. Таким образом, реакция начиналась при концентрациях (моль/л): С(N2) = 4,3; С(H2) = 7,2.
Пример 2: Вычисление равновесных концентраций реагирующих веществ.
Реакция протекает по уравнению А+В = 2C. Определите равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В соответственно равны 0,5 и 0,7 моль/л, а константа равновесия реакции Кс =50. Решение: К моменту равновесия концентрации веществ А и В понизятся, а концентрация вещества С увеличится. На каждый моль веществ А и В образуется 2 моль вещества С; поэтому, если понижение концентрации веществ А и В обозначить через x моль, то увеличение концентрации вещества С будет равно 2x моль. Равновесные концентрации реагирующих веществ будут: [ A ] = (0,5-х) моль/л; [ B ] = (0,7-х) моль/л; [ С ] = 2х моль/л. Кс = Решая это уравнение, получаем: x1 = 0,86; x2 = 0,44. По условию задачи справедливо значение х2. Отсюда равновесные концентрации реагирующих веществ равны: [ A ] = (0,5-0,44) = 0,06 моль/л; [ B ] = (0,7-0,44) = 0,26 моль/л; [ С ] = 0,44∙2 = 0,88 моль/л.
6.4 Необходимый уровень подготовки студентов 1. Знать понятия: химическое равновесие, константа химического равновесия, принцип Ле - Шателье. 2. Уметь на основе принципа Ле-Шателье предсказывать направление смещения химического равновесия при оказании на систему внешнего воздействия.
Задания для самоконтроля 1. Какое состояние обратимой реакции называют химическим равновесием? 2. Напишите уравнение константы равновесия для каждого из следующих обратимых процессов: а) 2N02 (г) = 2NO(r) + 02(г) б) ЗН2(г) + N2(г) = 2NH3(г) в) Н2(г) + СuО(к) = Н2О(г) + Си(к) Как сместится равновесие в каждом из указанных случаев при увеличении давления? 3. В каком направлении сместится равновесие при повышении температуры в следующих обратимых реакциях (тепловой эффект реакции рассчитайте по данным приложения [3]): а) 2S02(г) + О2(г) = 2S03(г) б) Н2(г) + Вr2(г) = 2НВr(г) в) N2(г) + 02(г) = 2NO(г) 4. Рассчитайте константу равновесия реакции С25Н2807 + НС1 = С25Н27О6С1 +Н2О если для ее проведения смешали 12 мл 10-2 М раствора С25Н2807 и 15 мл 10-2 М раствора НС1. Полученную смесь разбавили водой до 50 мл. Равновесная концентрация С25Н27О6С1 оказалась равной 2,03∙10 -3 моль/л. Ответ: 3,14∙105.
Лабораторная работа №7
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-13; просмотров: 418; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.013 с.) |

 где
где  — скорость химической реакции;
— скорость химической реакции;  — константа скорости;
— константа скорости;  и
и  концентрации реагирующих веществ.
концентрации реагирующих веществ. где
где  - константа скорости;
- константа скорости;  - концентрация кислорода; S - площадь поверхности раздела между фазами.
- концентрация кислорода; S - площадь поверхности раздела между фазами.
 - температурный коэффициент, показывающий, во сколько раз увеличивается скорость реакции при повышении температуры на 10 оС.
- температурный коэффициент, показывающий, во сколько раз увеличивается скорость реакции при повышении температуры на 10 оС.
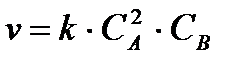




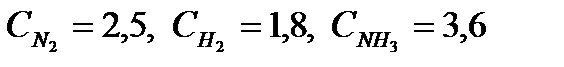 . Рассчитайте константу равновесии этой реакции и исходные концентрации азота н водорода.
. Рассчитайте константу равновесии этой реакции и исходные концентрации азота н водорода.




