
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема: Коррозия металлов. Защита металлов от коррозииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Цель: изучение условий возникновения коррозионных микроэлементов, их моделей, а так же влияния различных факторов на скорость электрохимической коррозии металлов. Оборудование: металлические пластины – стальная, свинцовая, медная, цинковая, алюминиевая, нержавеющей стали; ферроксилининдикатор, бумажный фильтр, наждачная бумага, U-образная трубка, милливольтметр, хлорид натрия (кристаллический), 0,1 М раствор H2SO4, раствор сульфата меди (II), раствор K3[Fe(CN)6], конц. HNO3, 2н раствор HCI, 0,4 М раствор уксусной кислоты, раствор иодида калия, раствор 3% NaCI, раствор для воронения (на 1 литр 600 г NaOH и 60 г NaNO2), пробирки, дистиллированная вода. Теоретические пояснения
Коррозией называют процесс разрушения металла в результате химического или электрохимического воздействия окружающей среды. Скорость коррозии выражают либо через потерю массы образца в единицу времени на единицу площади поверхности, либо через уменьшение толщины металла в единицу времени. По характеру разрушения металла различают равномерную и местную коррозию. Равномерная коррозия распределяется по всей поверхности металла, а местная коррозия сосредоточена на отдельных участках По механизму коррозионного процесса различают химическую или электрохимическую коррозию. Химическая коррозия характерна для сред не проводящих электрический ток. В процессе химической коррозии происходит прямое взаимодействие металла с окислителем. Электрохимическая коррозия возникает в средах, обладающих ионной проводимостью. В этом случае процесс коррозии является анодным растворением металла под влиянием катодного восстановления окислителя. Наиболее распространенными окислителями в коррозионном процессе являются ионы водорода и молекулы кислорода. Коррозия с участием ионов водорода называется коррозией с выделением водорода или коррозией с водородной деполяризацией. В наиболее простом виде электродные процессы могут быть представлены уравнениями: Me - ne- → Men+ 2H+ +2e → H2 Коррозия с выделением водорода возможна, если потенциал водородного электрода положительнее потенциала металла. Скорость коррозии в этом случае определяется скоростью реакции выделения водорода, зависящей от природы металла и вида поверхности, на которой выделяется водород. Скорость коррозии зависит так же от рН и температуры раствора, с которым реагирует металл Коррозия с участием кислорода называется коррозией с поглощением кислорода или коррозией с кислородной деполяризацией. В наиболее простом виде электродные процессы могут быть представлены уравнениями: Me - ne- → Men+ O2 + 2H2O + 4e- → 4OH– Коррозия с поглощением кислорода возможна, если потенциал кислородного электрода положительнее потенциала металла. Скорость коррозии в этом случае обычно определяется скоростью диффузии кислорода и возрастает при перемешивании раствора и увеличении концентрации растворенного кислорода. На основе понимания механизма электрохимической коррозии разработаны разнообразные способы борьбы с ней. Легирование – это введение в состав сплава компонентов, повышающих устойчивость металлов к коррозии. Например, в качестве легирующих добавок к железу применяют никель и хром (нержавеющая сталь). В некоторых случаях скорость коррозии лимитируется анодными реакциями. Обычно это наблюдается у металлов способных к пассивации, таких как алюминий, титан, хром, никель, тантал и др. Пассивностью металла называют состояние повышенной коррозионной устойчивости, вызываемое торможением анодного процесса. Пассивация обычно обусловлена образованием на поверхности металла защитных пленок. Поверхность металла можно защитить покрытиями, которые бывают нескольких видов: - неметаллические покрытия (лаки, краски, эмали); - покрытия, образующиеся в результате химической обработки поверхности металла (например, воронение стали); - металлические покрытия, которые подразделяются на анодные (покрытие более активным металлом, образующим устойчивые к коррозии оксидные пленки) и катодные (покрытие менее активным металлом). При повреждении анодного покрытия будет анодно растворяться само покрытие, а не основной металл. При повреждении катодного покрытия растворяется основной металл, а не металл покрытия. В некоторых случаях в коррозионную среду вводят ингибиторы (замедлители) коррозии. Электрохимическая защита применяется в средах с хорошей ионной проводимостью, например, морская вода, почва. Существует несколько видов электрохимической защиты: - протекторная защита – присоединение к защищаемому изделию большого листа из более активного металла, который выступает в качестве анода и окисляется, материал изделия выступает в роли катода, он защищен от коррозии; - катодная защита – защищаемая деталь присоединяется к отрицательному полюсу внешнего источника тока и становится катодом, в качестве анода используются куски железа, которые присоединяются к положительному полюсу источника тока, при этом подвергаясь анодному окислению; - анодная защита – защищаемое изделие подключается к положительному полюсу внешнего источника тока, при этом происходит пассивация защищаемого металла.
Методика проведения опыта
Опыт 1: Электрохимическая неоднородность поверхности стали
Для проведения опыта зачистите стальную пластинку наждачной бумагой, промойте проточной водой и высушите фильтровальной бумагой. Затем положите на пластинку бумажный фильтр, смоченный ферроксилининдикатором (100 мл Н2О + 3 г NaCI + K3[Fe(CN)6] + несколько капель фенолфталеина). Через 2-3 минуты опишите изменение цвета фильтровальной бумаги, форму и распределение пятен. Объясните наблюдения и, используя значения потенциалов электродных реакций запишите уравнения этих реакций.
Опыт 2: Влияние природы контактирующих металлов на скорость коррозии железа В U-образную трубку залейте на 1/2 объема 0,1 М раствор серной кислоты. Металлические пластины тщательно зачистите и промойте дистиллированной водой. В одно колено трубки поместите стальную пластинку во второе медную. С помощью милливольтметра определите напряжение элемента. Повторите опыт со свинцовой пластинкой. При оформлении результатов опыта запишите уравнения катодного и анодного процессов, а также суммарное уравнение реакции. Приведите схему коррозионного элемента. Опыт 3: Активирующее действие ионов хлора В две пробирки налейте (1/2 объема) раствор сульфата меди, подкисленный серной кислотой. В одну из пробирок добавьте хлорид натрия. Затем в обе пробирки поместите алюминиевую проволочку. Наблюдайте, в какой из пробирок интенсивнее выделяется газ. Запишите уравнения анодного катодного и суммарного процессов, приведите схему коррозионного элемента. Объясните механизм влияния ионов хлора на скорость реакции.
Опыт 4: Обнаружение микрогальванических элементов на поверхности металлов. Железную пластинку тщательно зачистить наждачной бумагой, промыть водой и высушить полоской фильтровальной бумаги. На поверхность пластинки нанести пипеткой в разных местах две капли 3% раствора NaCI. С помощью милливольтметра обнаружить наличие электрического тока. Для этого необходимо одним электродом прикоснуться к поверхности пластинки под каплей, а другим прикоснуться к поверхности соседней капли. Повторить опыт с алюминиевой и цинковой пластинками. Дать объяснение о причинах возникновения электрического тока.
Опыт 5: Оксидирование железа (воронение). Железную пластинку (гвоздь) зачистить наждачной бумагой, закрепить на тонкой проволоке и протравить в соляной кислоте (1:1), затем промыть водой. В стаканчике нагреть 100 мл раствора, содержащего на 1 литр 600 г NaOH и 60 г NaNO2 и опустить в него подготовленный железный образец. Через 10-15 минут извлечь его из рабочего раствора, промыть водой и наблюдать появление на поверхности вороной окраски. Опыт 6: Легирование металла. В две пробирки налейте (1/2 объема) воды и добавьте 2-4 мл раствора серной кислоты и 2-4 капли раствора K3[Fe(CN)6]. В одну пробирку поместите зачищенную наждачной бумагой и промытую водой стальную пластинку, а в другую – пластинку из нержавеющей стали (незачищенную). Отметьте изменение цвета раствора через 5 минут и количество выделяющихся пузырьков газа в единицу времени. Объясните причину различного поведения пластинок в растворе кислоты. Опыт 7: Пассивация алюминия. В пробирку поместить кусочек алюминия и прилить 2 – 3 мл концентрированной азотной кислоты. Через 3 – 4 минуты кислоту слить, промыть металл водой и подействовать на него 2н раствором соляной кислоты. Почему теперь алюминий не растворяется в соляной кислоте?
Опыт 8: Протекторная защита металла. В две пробирки налейте (1/2 объема) 0,4 М раствора уксусной кислоты и добавьте в каждую несколько капель раствора иодида калия. В одну пробирку поместите пластинку свинца, а в другую пластинку свинца, соединенную с цинковой пластинкой. Наблюдайте, в какой из пробирок быстрее появится желтое окрашивание. Объясните наблюдаемые явления. Приведите схемы катодного и анодного процессов, составьте схемы коррозионных элементов.
15.3 Необходимый уровень подготовки студентов
1. Знать, что называется коррозией металлов, какие существуют ее виды, в чем их отличие. 2. Знать причины возникновения коррозионных микрогальванических элементов, что такое коррозия с водородной и кислородной деполяризацией. 3. Уметь писать уравнения анодных и катодных процессов, протекающих при электрохимической коррозии. 4. Иметь представление о методах защиты металлов от коррозии.
Задания для самоконтроля
1. Что называют коррозией металлов? 2. Какие виды коррозии вы знаете? 3. В чем отличие электрохимической коррозии от химической? 4. Чем вызвана электрохимическая неоднородность поверхности металла? 5. Каковы причины возникновения коррозионных микрогальванических элементов? 6. Возможна ли коррозия с выделением водорода в растворе, в котором активность Cu2+ равна 10-3 моль/л и рН среды равен 3? 7. Возможна ли коррозия меди с поглощением кислорода на воздухе в растворе, в котором активность Cu2+ равна 10-4 моль/л, а среда нейтральна? 8. Как можно снизить скорость коррозии металлов? 9. Какие защитные покрытия вам известны, и какими методами их получают? 10. Что такое анодные и катодные защитные покрытия? 11. Какие вещества называют ингибиторами коррозии?
Лабораторная работа №16 Тема: Криоскопический метод определения молекулярной массы растворенного вещества
Цель работы: определение молекулярных масс криоскопическим методом. Оборудование и реактивы: прибор для определения молекулярной массы криоскопическим методом (рис. 1): пробирка с боковым отростком, широкая пробирка, толстостенный стакан, термометр Бекмана, мешалки, крышка; аналитические весы с разновесом, мерный цилиндр, шпатель, снег (толченый лед) и хлорид натрия для охладительной смеси, бюкс с 1,2-1,5 г мочевины, дистиллированная вода.
Теоретические пояснения
При образовании растворов характер взаимодействия компонентов определяется их химической природой, что затрудняет выявление общих закономерностей. Поэтому удобно прибегнуть к некоторой идеализированной модели раствора. Такой раствор, образование которого не связано с тепловым эффектом и с изменением объема называют идеальным раствором. Хотя большинство растворов и не обладает в полной мере свойствами идеальных, однако свойства многих из них могут быть описаны при помощи этой модели. Наиболее подходящими в этом плане являются разбавленные растворы, в которых содержание растворенного вещества очень мало по сравнению с содержанием растворителя. Рассмотрим свойства разбавленных растворов, которые зависят от числа частиц растворенного вещества и от количества растворителя, но практически не зависят от природы растворенных частиц (коллигативные свойства). К таким свойствам относятся: понижение давления насыщенного пара растворителя над раствором, повышение температуры кипения, понижение температуры замерзания раствора по сравнению с чистым растворителем, осмотическое давление. Согласно закону Рауля, относительное понижение давления насыщенного пара над раствором равно мольной доле растворенного нелетучего вещества:
Повышение температуры кипения и понижение температуры замерзания растворов по сравнению с чистым растворителем, по следствию из закона Рауля прямопропорциональны моляльной концентрации растворенного вещества:
где
Криоскопия и эбулиоскопия – методы определения молекулярных масс растворенных веществ. Эти методы позволяют определить молекулярную массу не диссоциирующих при растворении веществ по понижению температуры замерзания и по повышению температуры кипения растворов известной концентрации:
где
Методика проведения опыта
1. Подготовить к работе термометр Бекмана (рис1). Особенностями этого термометра являются большая длина шкалы (примерно 5 см на 1 0С) и наличие вверху термометра запасного резервуара с ртутью, позволяющего изменять количество ртути в рабочей части термометра и тем самым температурные интервалы измерения. Шкала термометра разделена на 5 0С, а каждый градус на десятые и сотые доли. Тысячные доли могут быть подсчитаны при наблюдении в лупу.
а) осторожно переворачивают термометр вниз запасным резервуаром и соединяют ртуть, находящуюся в капилляре с ртутью в запасном резервуаре;
в) перевести термометр в вертикальное положение (ртутный шарик внизу);
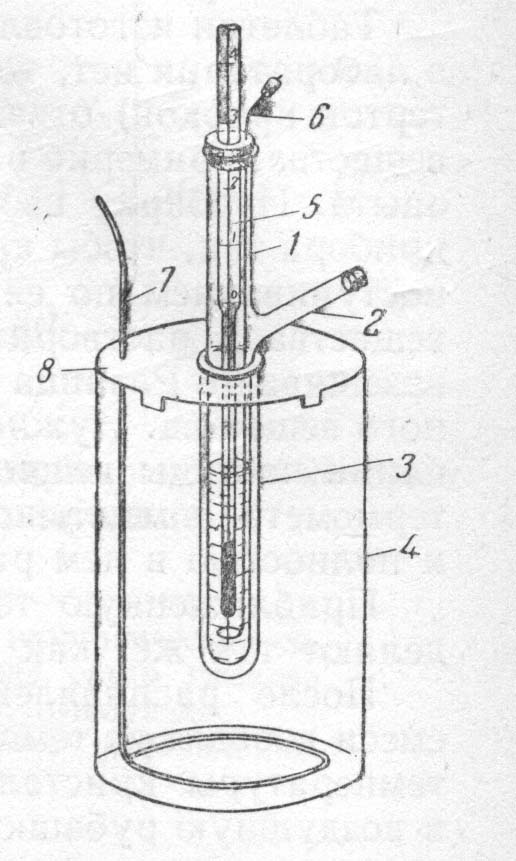 г) поместить ртутный шарик термометра в смесь соли и снега (толченого льда) с температурой -2, -3 0С; г) поместить ртутный шарик термометра в смесь соли и снега (толченого льда) с температурой -2, -3 0С;
д) когда ртуть в запасном резервуаре поднимется чуть выше нулевой отметки, щелкнуть по крышке термометра так, чтобы ртуть капилляра оторвалась от ртутного столбика в запасном резервуаре; е) проверить настройку термометра, как было описано во втором абзаце пункта 1. Если ртуть в капилляре займет положение между 3-5 градусом – термометр готов к работе, в противном случае повторить действия, описанные в пунктах г), д), е); 2. Собрать прибор по рис. 2, предварительно заполнив толстостенный стакан охладительной смесью, состоящей из трех частей снега (толченого льда) и одной части поваренной соли. Температура смеси должна быть -5 -7 0С. Ее можно регулировать при помощи изменения соотношения снега (льда) и соли. 3.Отмерить 10 мл Н2О и влить через боковой отросток в пробирку 1 (масса растворителя Н2О 10 г). 4. Все время перемешивая воду мешалкой, определить по температуре замерзания воды нулевую точку термометра. Нужно иметь в виду, что жидкость часто переохлаждается. Поэтому температурой замерзания воды следует считать температуру, которая устанавливается в момент замерзания после некоторого скачка вверх ( 5. Вынуть пробирку 1 из прибора, растопить лед и еще раз определить температуру замерзания воды ( 6. Взвесить на аналитических весах бюкс, в котором находится 1,2-1,5 г мочевины ( 7. Всыпать 8. Взвесить бюкс с остатком мочевины ( 9. По разнице масс ( 10. Определить температуру замерзания раствора мочевины так, как это было описано в пункте 4. Измерения повторить еще раз ( 11. Рассчитать молярную массу мочевины по формуле (2). 12. Сопоставить данные расчетов с теоретическим значением молярной массы мочевины. Рассчитать относительную погрешность опыта по формуле:
13. Результаты опыта представить в виде таблицы:
14. Выводы.
Примеры решения задач
Пример 1: В каком отношении должны находиться массы воды и этилового спирта, чтобы при их смешении получить раствор, кристаллизующийся при -20 С? Решение: В соответствии со следствием из закона Рауля, понижение температуры замерзания раствора пропорционально моляльной концентрации растворенного неэлектролита:
По условию задачи
Иными словами в одном килограмме воды содержится 10,75 моль этилового спирта, масса которого равна:
Отношение масс воды и этилового спирта равно: 1000:494,5 = 2:1 Пример 2: В радиатор автомобиля налили 9 л воды и прибавили 2 л метанола (плотность 0,8 г/мл). При какой температуре можно после этого оставлять автомобиль на открытом воздухе, не опасаясь, что вода в радиаторе замерзнет? Решение: В соответствии со следствием из закона Рауля, понижение температуры замерзания раствора пропорционально моляльной концентрации растворенного неэлектролита:
Принимая во внимание, что плотность воды близка к 1 г/мл, а плотность метанола равна 0,8 г/мл, можно от объемов перейти к массам:
Учитывая, что
Таким образом вода в радиаторе будет замерзать при температуре -5,55
16.4 Необходимый уровень подготовки студентов
1. Знать коллигативные свойства растворов: осмос, повышение температуры кипения, понижение температуры замерзания растворов, понижение давления насыщенного пара растворителя над раствором. 2. Иметь представления о законе Рауля и законе Вант-Гоффа для осмотического давления. 3. Уметь применять изученные законы для вычисления давления насыщенного пара растворителя над раствором, повышения температуры кипения и понижения температуры замерзания растворов, величины осмотического давления.
Задания для самоконтроля
1. При растворении 3,24г серы в 40 г бензола температура кипения последнего повысилась на 0,81 К. Из скольких атомов состоит молекула серы в растворе бензола? 2. Температура кипения водного раствора сахарозы С12H22O11 равна 101,4 оС. Вычислить моляльную концентрацию и массовую долю сахарозы в растворе. При какой температуре замерзнет этот раствор? 3. В 60 г бензола растворено 2,09г некоторого вещества, элементный состав которого(в % по массе): С-50,69; Н - 4,23 и О - 45,08. Раствор кристаллизуется при 4,25 С. Установить молекулярную формулу вещества. Чистый бензол кристаллизуется при 5,5 С. 4. Водно-спиртовой раствор, содержащий 15% спирта (плотность 0,97 г/мл), кристаллизуется при - 10,26 С. Найти молярную массу спирта и осмотическое давление раствора при 293 К. 5. При растворении 13,0 г неэлектролита в 400 г диэтилового эфира (С2Н5)2О температура кипения раствора повысилась на 0,453 К. Определить молярную массу растворенного вещества. 6. При растворении 5,0 г вещества в 200 г воды получается не проводящий ток раствор, кристаллизующийся при -1,45 оС. Определить молярную массу растворенного вещества. 7. При одинаковой ли температуре замерзает речная и морская вода? Почему? 8. Почему тротуары зимой посыпают солью?
Лабораторная работа №17
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-13; просмотров: 869; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.136.95 (0.009 с.) |


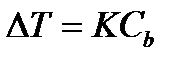
 - изменение температуры,
- изменение температуры,  - моляльная концентрация (моль/кг),
- моляльная концентрация (моль/кг),  - коэффициент пропорциональности, в случае повышения температуры кипения называется эбулиоскопической константой, а для понижения температуры замерзания – криоскопической. Эти константы, численно различные для одного и того же растворителя, характеризуют повышение температуры кипения и понижение температуры замерзания одномоляльного раствора, т.е. при растворении 1 моль электролита в 1000 г растворителя. Поэтому их часто называют моляльным повышением температуры кипения и понижением температуры замерзания раствора. Криоскопические и эбулиоскопические константы не зависят от природы растворенного вещества, а лишь зависят от природы растворителя и характеризуются размерность
- коэффициент пропорциональности, в случае повышения температуры кипения называется эбулиоскопической константой, а для понижения температуры замерзания – криоскопической. Эти константы, численно различные для одного и того же растворителя, характеризуют повышение температуры кипения и понижение температуры замерзания одномоляльного раствора, т.е. при растворении 1 моль электролита в 1000 г растворителя. Поэтому их часто называют моляльным повышением температуры кипения и понижением температуры замерзания раствора. Криоскопические и эбулиоскопические константы не зависят от природы растворенного вещества, а лишь зависят от природы растворителя и характеризуются размерность  . Ниже приведены криоскопические
. Ниже приведены криоскопические 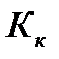 и эбулиоскопические
и эбулиоскопические  константы для некоторых растворителей:
константы для некоторых растворителей: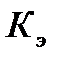

 - масса растворенного вещества в граммах,
- масса растворенного вещества в граммах,  - масса растворителя в граммах,
- масса растворителя в граммах,  - молярная масса растворенного вещества в г/моль, 1000- коэффициент пересчета от граммов растворителя к килограммам. Из (1) молярная масса неэлектролита выразится как:
- молярная масса растворенного вещества в г/моль, 1000- коэффициент пересчета от граммов растворителя к килограммам. Из (1) молярная масса неэлектролита выразится как: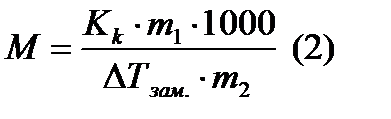
 Подготовку термометра начинают с погружения его в жидкость с температурой, равной температуре замерзания чистого растворителя. Если ртуть в капилляре рабочей части термометра займет положение между третьим и пятым градусами шкалы, то термометр готов к работе, в ином случае он должен быть отрегулирован. Для этой цели:
Подготовку термометра начинают с погружения его в жидкость с температурой, равной температуре замерзания чистого растворителя. Если ртуть в капилляре рабочей части термометра займет положение между третьим и пятым градусами шкалы, то термометр готов к работе, в ином случае он должен быть отрегулирован. Для этой цели: ).
). ).
). ).
). взвешенной мочевины через боковой отросток в пробирку 1 и растворить ее в находящейся там дистиллированной воде.
взвешенной мочевины через боковой отросток в пробирку 1 и растворить ее в находящейся там дистиллированной воде. ).
). ) вычислить массу растворенной мочевины.
) вычислить массу растворенной мочевины. ).
).

 мочевины, г/моль
мочевины, г/моль








 . Зная криоскопическую постоянную воды (1,86
. Зная криоскопическую постоянную воды (1,86 

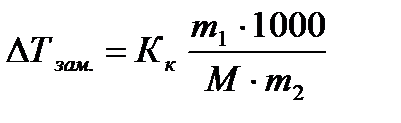
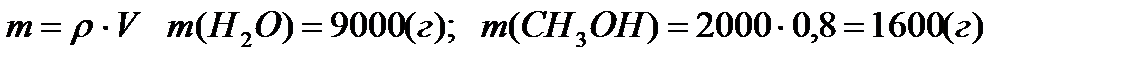

 имеем:
имеем:
 ,поэтому автомобиль не рекомендуется оставлять на открытом воздухе при данной и более низких температурах.
,поэтому автомобиль не рекомендуется оставлять на открытом воздухе при данной и более низких температурах.


