
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Взвешивание цинка на аналитических весахСодержание книги
Поиск на нашем сайте
1. Включить осветитель весов при помощи штепсельной вилки. 2. Привести весы в рабочее состояние, повернув рукоятку арретира, при этом автоматически включается лампочка осветителя. На экране вейтографа появляется движущееся изображение шкалы. 3. Установить нулевую точку весов, совместив неподвижную вертикальную линию на экране (риску) с нулевым делением шкалы. Этого можно добиться вращением регулировочного винта экрана. 4. Арретировать весы. 5. Открыв боковую дверцу, на левую чашку весов поместить кусочек цинка на предварительно взвешенной бумажке массой m1. Для взвешивания с точностью до 1 г на правую чашку весов помещают гирьки. Так как в данной работе предстоит взвесить с точностью до 0,0002 г навеску цинка массой около 0,02 - 0,03 г, а масса кусочка бумаги также меньше 1 г, то на правую чашку весов гирьки ставить не требуется. 6. Закрыв дверцу, приступить к взвешиванию. Поворачивая большой лимб, производят взвешивание с точностью до десятых долей грамма так, чтобы был недовес (риска находится в положительной части шкалы). Поворачивая малый лимб, производят взвешивание с точностью до сотых долей грамма. Взвешивание считается законченным, когда риска находится в пределах положительных значений шкалы от 0 до 10. Тысячные и десятитысячные доли грамма узнают по шкале после того, как колебания прекратятся. 7. Определить массу цинка с бумажкой т2,, суммируя показания по большому, малому лимбу и шкале весов. 8. Масса цинка определяется по разности т2 - m1. 9. Взвешенный кусочек цинка завернуть в бумагу, на которой написать его массу, и сохранить до следующей лабораторной работы.
1.5 Необходимый уровень подготовки студентов 1. Знать общие правила и технику безопасности при работе в химической лаборатории. 2. Уметь оказать первую помощь при несчастных случаях. 3. Знать назначение наиболее часто используемой химической посуды и лабораторного оборудования, правила пользования ими. 4. Уметь выполнять операции нагревания и охлаждения, фильтрования, взвешивания, измерения температуры. 5. Знать принципиальную схему устройства технохимических и равноплечих демпферных аналитических весов.
Вопросы для самоконтроля 1. Почему нельзя выливать в раковину концентрированные растворы кислот и щелочей, органические растворители, выбрасывать остатки щелочных металлов?
2. Какую последовательность следует соблюдать при приготовлении разбавленного раствора из концентрированной серной кислоты? 3. Почему запрещается проводить опыты в грязной посуде? 4. Что нужно предпринять при попадании капель концентрированной кислоты или щелочи на кожу? 5. Нарисуйте схему частей пламени спиртовки или горелки. В какой части пламени температура максимальна? 6. Какие правила необходимо соблюдать при нагревании жидкости в пробирке на пламени спиртовки и в стакане на электроплитке? 7. Какую посуду называют мерной, для чего она используется? 8. Какая фарфоровая посуда используется в лаборатории, и для каких целей? 9. Какие способы проведения фильтрования вы знаете? 10. Что такое арретир, для чего он нужен в весах?
Лабораторная работа №2 Тема: Определение молярной массы эквивалента цинка Цель работы: познакомиться с понятием химического эквивалента, определить молярную массу химического эквивалента цинка методом вытеснения водорода. Оборудование и реактивы: прибор для определения молярной массы эквивалента металла (см. рис. 1), термометр, барометр, 25%-ный раствор соляной кислоты, металлический цинк.
Теоретические пояснения Химическим эквивалентом (Э) называется реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалентна (равноценна) одному иону водорода в кислотно-основных и обменных реакциях, либо одному электрону в окислительно-восстановительных реакциях. Реальные частицы - это атомы, ионы, молекулы и т.д., а условные частицы - это, например, 1/2 (H2SO4), 1/4(С), 1/3(Fe3+). В общем случае эквивалент любого вещества X может быть записан в виде ЭХ =1/z(X), где z - число эквивалентности, или эквивалентное число, которое всегда > 1. Оно показывает, сколько эквивалентов содержится в одной формульной единице вещества. Для данного вещества z находится по конкретной реакции. В окислительно-восстановительных процессах z определяется числом электронов, принятых или отданных одной формульной единицей вещества, например, в реакции:
Mg + 2HCl → MgCl2 + H2 Z(Mg)=2, т.к. магний в ходе окислительно-восстановительной реакции отдает 2 электрона, а ЭMg =½ (Mg). В обменных процессах Z определяется стехиометрией и равно знаменателю правильной дроби, которая получается при делении коэффициента перед веществом на самый большой коэффициент в реакции: АI2O3 + 6HCI =2AICI3 +3H2O Z (АI2O3) = 6, т.к. при делении коэффициента перед АI2O3 на самый большой коэффициент в реакции - 6, получается правильная дробь Когда речь не идет о конкретной реакции, при определении z для сложных веществ можно воспользоваться следующими правилами: 1) для оксидов z равно числу атомов элемента, умноженному на степень окисления элемента; 2) для кислот z равно основности кислоты; 3) для оснований z равно кислотности основания; 4) для солей z равно числу катионов металла, умноженному на заряд катиона. Количество вещества эквивалента обозначается vЭ,единица измерения - моль. Один моль эквивалента вещества содержит 6,022-1023 эквивалентов. Молярная масса эквивалента MЭ - это масса 1 моль эквивалентов вещества, измеряется в г/моль. Связь между молярной массой эквивалента, количеством вещества эквивалента, массой и молярной массой вещества выражается соотношениями:
Экспериментальное определение молярной массы химического эквивалента цинка в данной работе основано на законе эквивалентов: Вещества реагируют друг с другом в равных количествах эквивалентов Из закона эквивалентов следует, что массы реагирующих друг с другом веществ, а также массы продуктов реакции относятся друг к другу как молярные массы их эквивалентов:
Если вещество находится в газообразном состоянии то для него справедливы соотношения: Методика проведения опыта Устройство прибора для определения молярной массы эквивалента металла представлено на рис.1. Бюретка (1) емкостью 50 мл соединена резиновыми трубками с воронкой (2) и пробиркой (3). В бюретку наливают воду, которая должна также заполнять часть воронки. Перед началом опыта необходимо убедиться в герметичности прибора. Для этого, пустую пробирку соединяют с бюреткой, и поднимают воронку так, чтобы уровень воды в ней был выше, чем в бюретке. При этом в приборе создается давление, превышающее атмосферное. Если уровень воды в бюретке не изменяется после незначительного первоначального повышения, то прибор герметичен и готов к работе. В противном случае следует исправить дефекты, допущенные при сборке прибора. При проведении опыта следует придерживаться следующей последовательности действий: 1. Влить в пробирку на 1/5 ее объема через воронку соляную кислоту. Стенки пробирки при этом должны остаться сухими.
Рис.1. Прибор для определения молярной массы эквивалента металла
2. Держа пробирку в наклонном положении, положить на ее стенку кусочек цинка, взвешенный в лабораторной работе №1 так, чтобы он не соприкасался с кислотой. 3. Присоединить пробирку к прибору, плотно закрыв ее пробкой. Убедиться, что герметичность прибора не нарушена.
4. Передвижением воронки привести воду в ней и бюретке к одному уровню. Отметить и записать уровень воды в бюретке V1, произведя отсчет по нижнему краю мениска (утолщенная поверхностная пленка воды в бюретке). Мениск должен находиться на уровне глаз. 5. Стряхнуть цинк в кислоту. По окончании реакции дать пробирке остыть до комнатной температуры, после чего снова привести воду в бюретке и воронке к одному уровню. Отметить и записать уровень воды в бюретке V2. Разность V1 - V2 равна объему выделившегося водорода в реакции: Zn + 2 HCl = ZnCl2 + H2 ↑ 6. Отметить показания термометра и барометра. 7. Результаты опыта занести в табл. 1.
Таблица 1. Результаты опыта.
Обработка результатов опыта 1. По разности уровней воды в бюретке до и после протекания реакции вычислить объем выделившегося водорода при температуре и давлении опыта. 2. Так как водород собирается над водой, то он насыщен водяным паром. Общее давление в приборе равно атмосферному и складывается из парциальных давлений водяного пара и водорода. Чтобы вычислить парциальное давление водорода, нужно из атмосферного давления Р вычесть величину давления насыщенного при температуре опыта водяного пара h. Для нахождения h следует воспользоваться данными табл.2. P(H2)=P-h Таблица 2. Давление насыщенного водяного пара при различных температурах.
3. Привести объем выделившегося водорода к нормальным условиям (Р0 -760 мм рт.ст., Т0 = 273 К), используя объединенное уравнение газового состояния:
4. Рассчитать экспериментальное значение молярной массы эквивалента цинка в г/моль по закону эквивалентов в соответствии с формулой:
где VЭ(H2) - объем, занимаемый одним моль эквивалента газообразного водорода, равный половине молярного объема водорода, т.е. 11,2 л/моль или 11200 мл/моль.
5. Рассчитать теоретическое значение молярной массы эквивалента цинка, зная молярную массу цинка и эквивалентное число z, численно равное числу электронов, отданных цинком в ходе окислительно-восстановительной реакции с соляной кислотой.
6. Вычислить относительную ошибку опыта по формуле:
Примеры решения задач Пример 1: На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 л водорода, измеренного при (н.у.). Вычислить молярные массы металла и оксида. Чему равна относительная масса металла? Решение: По закону эквивалентов массы веществ m1 и m2, вступающих в реакцию, пропорциональны молярным массам их эквивалентов
Если одно из веществ находится в газообразном состоянии, то как правило, его количество измеряется в объемных единицах (см3, л, м3). Формулу (2) преобразуем относительно объема водорода:
Находим молярную массу эквивалента металла:
По закону эквивалентов:
Относительную атомную массу металла определяем из соотношения:
Пример 2: Определить молярную массу эквивалента Fe2(SO4)3 в реакции ионного обмена: Fe2(SO4)3 + 6NaOH = 2 Fe(OH)3 + 3 Na2SO4. Решение: По стехиометрии реакции Z частицы Fe2(SO4)3 равно 6, т. к. при делении коэффициента перед Fe2(SO4)3 получается правильная дробь МЭ(Fe2(S04)3) = M(Fe2(SO4)3) /6 = 400/6 = 66,7 (г/моль).
2.5 Необходимый уровень подготовки студентов 1. Знать понятия: эквивалент, число эквивалентности, количество вещества эквивалента, молярная масса эквивалента. 2. Уметь выражать связь между молярной массой эквивалента, количеством вещества эквивалента, массой и молярной массой вещества. 3. Знать закон эквивалентов, уметь применять его для нахождения масс и молярных масс веществ, участвующих или образующихся в реакции. 4. Уметь определять молярную массу эквивалента элемента, эквивалент и молярную массу эквивалента вещества в реакции. Задания для самоконтроля 1. Когда количество вещества эквивалента равно количеству вещества? 2. Определить молярную массу эквивалента Fe(OH)2Cl в реакциях: a) Fe(OH)2Cl + NaOH = Fe(OH)3 + NaCl; 6) Fe(OH)2Cl + 2HCl = FeCl3 + 2 H2O. 3. Почему молярная масса элемента постоянна, а молярная масса его эквивалента может изменяться? 4. Может ли молярная масса эквивалента элемента или вещества быть больше его молярной массы и почему? 5. Почему при расчетах масс реагентов по молярным массам их эквивалентов не нужно знать значения коэффициентов в уравнении реакции? 6. Найти массу алюминия, если при его полном растворении в кислоте выделяется такое же количество водорода, что и при растворении 1,752 г цинка. Молярная масса эквивалента цинка равна 32,69 г/моль, молярная масса эквивалента алюминия - 8,99 г/моль. 7. Для нейтрализации кислоты гидроксидом калия на ее 1,866 г потребовалось 15 г гидроксида калия, молярная масса эквивалента которого равна 56 г/моль. Вычислите молярную массу эквивалента кислоты.
Лабораторная работа №3
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-13; просмотров: 321; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.131.37.220 (0.012 с.) |

 , знаменатель которой равен 6; Z(HCI) = 1, т.к. при делении коэффициента перед HCI на самый большой коэффициент в реакции - 6, получается 1.
, знаменатель которой равен 6; Z(HCI) = 1, т.к. при делении коэффициента перед HCI на самый большой коэффициент в реакции - 6, получается 1.

 .
.
 ;
;  ; где
; где  – количество вещества эквивалента; V – объем газообразного вещества в данных условиях;
– количество вещества эквивалента; V – объем газообразного вещества в данных условиях;  – молярный объем эквивалента вещества в тех же условиях; VM – молярный объем вещества; Z – число эквивалентности.
– молярный объем эквивалента вещества в тех же условиях; VM – молярный объем вещества; Z – число эквивалентности.







 ; (1)
; (1) (2)
(2)


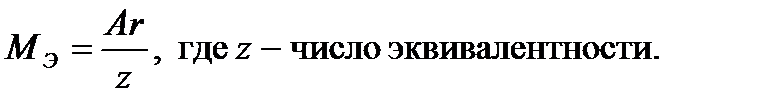

 , то молярная масса эквивалента сульфата железа (Ш) в данной реакции может быть вычислена по формуле
, то молярная масса эквивалента сульфата железа (Ш) в данной реакции может быть вычислена по формуле


