Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кислоты, их классификация и свойства на основе представлений об электролитической диссоциации.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Билет№15 Кислоты, их классификация и свойства на основе представлений об электролитической диссоциации. Кислоты – это электролиты, при диссоциации водных растворов которых в качестве катионов отщепляются только ионы водорода. HCl → H+ + Cl- H2SO4 → 2H+ + SO42- Отрицательные ионы, которые отщепляются от молекулы кислоты называются кислотными остатками. Кислоты классифицируют по нескольким признакам. По составу: Бескислородные HCl, HNO3 Кислородосодержащие H2SO4, H2CO3 По основности: Одноосновные HCl, HNO3 Двухосновные H2SO4, H2CO3 Трехосновные H3PO4 По силе: Сильные HCl, HNO3, H2SO4 Слабые H2S, H2CO3 Общие химические свойства кислот обусловлены наличием иона водорода. Для кислот характерны следующие химические свойства: 1. Взаимодействие с активными металлами. Zn + HCl = ZnCl2 + H2↑ 2. Взаимодействие с основными оксидами. CuO + H2SO4 = CuSO4 + H2O 3. Взаимодействие с основаниями. HCl + NaOH = NaCl + H2O H+ + Cl- + Na+ + OH- = Na+ + Cl- + H2O H+ + OH- = H2O 4. Взаимодействие с солями – такая реакция протекает только в том случае, е6сли образуется осадок, летучее вещество или слабый электролит. HCl + AgNO3 = AgCl↓ + HNO3 H+ + Cl- + Ag+ + NO3- = AgCl↓ + H+ + NO3- Cl- + Ag+ = AgCl↓ Глицерин – многоатомный спирт; состав молекулы, физические и химические свойства, применение. Глицери́н - химическое соединение с формулой HOCH2CH(OH)-CH2OH или C3H5(OH)3. Простейший представитель трёхатомных спиртов. Представляет собой вязкую прозрачную жидкость. Глицерин — бесцветная, вязкая, гигроскопичная жидкость, неограниченно растворимая в воде. Сладкий на вкус, отчего и получил своё название (гликос — сладкий). Хорошо растворяет многие вещества. Взаимодействие глицерином с натрием: 2СН2ОН – СНОН-СН2ОН + 6Nа = 2СН2ОNа –СНОNa- СН2ОNа +3 Н2 глицерат натрия.
Билет №16 Основания, их классификация и свойства на основе представлений об электролитической диссоциации. Основания -- вещества, диссоциирующие в водном растворе с образованием катионов металла и гидроксид-анионов ОН−. Основание -- NaOH: NaOH ↔ Na+ + OH- Существует также основание, в котором гидрокси-группа присоединена не к металлу, а к иону NH4+ (катиону аммония). Это основание называется гидроксидом аммония и имеет формулу NH4OH. Гидроксид аммония образуется в рекции присоединения воды к аммиаку, когда аммиак растворяют в воде: NH3 + H2O = NH4OH (гидроксид аммония). Основания бывают растворимыми и нерастворимыми. Растворимые основания называются щелочами. Растворы щелочей скользкие на ощупь ("мыльные") и довольно едкие. Они разъедают кожу, ткани, бумагу, очень опасны (как и кислоты) при попадании в глаза. Поэтому при работе со щелочами и кислотами необходимо пользоваться защитными очками. Лишь небольшую часть всех оснований называют щелочами. Это, например, KOH – гидроксид калия (едкое кали), NaOH – гидроксид натрия (едкий натр), LiOH – гидроксид лития, Ca(OH)2 – гидроксид кальция (его раствор называется известковой водой), Ba(OH)2 – гидроксид бария. Большинство других оснований в воде нерастворимы и щелочами их не называют. Щелочами называются растворимые в воде сильные основания. Свойства, характерные для всех оснований, проявляются благодаря присутствию в их растворах гидроксид- ионов OH-.. 1. Наиболее важное химическое свойство всех оснований – взаимодействие с кислотами – реакция нейтрализации. NaOH + HCl = NaCl + H2O Na+ + OH- + H+ + Cl- = Na+ + Cl- + H2O H+ + OH- = H2O 2. Взаимодействие щелочей с кислотными оксидами. NaOH + CO2 = Na2CO3 3. Взаимодействие щелочей с солями, если в результате реакции одно из веществ выпадает в осадок. 3NaOH + FeCl3 = Fe(OH)3↓ + 3NaCl 3Na+ + 3OH- + Fe3+ + 3Cl- = Fe(OH)3↓ + 3Na+ + 3Cl- 3OH- + Fe3+ = Fe(OH)3↓ Применение Глюкоза является ценным питательным продуктом. В организме она подвергается сложным биохимическим превращениям в результате которых образуется диоксид углерода и вода, при это выделяется энергия согласно итоговому уравнению: C6H12O6 + 6O2 → 6H2O + 6CO2 + 2800 кДж Так как глюкоза легко усваивается организмом, её используют в медицине в качестве укрепляющего лечебного средства при явлениях сердечной слабости, шоке, она входит в состав кровозаменяющих и противошоковых жидкостей. Широко применяют глюкозу в кондитерском деле (изготовление мармелада, карамели, пряников и т. д.), в текстильной промышленности в качестве восстановителя, в качестве исходного продукта при производстве аскорбиновых и глюконовых кислот, для синтеза ряда производных сахаров и т.д. Большое значение имеют процессы брожения глюкозы. Так, например, при квашении капусты, огурцов, молока происходит молочнокислое брожение глюкозы, так же как и при силосовании кормов. Если подвергаемая силосованию масса недостаточно уплотнена, то под влиянием проникшего воздуха происходит маслянокислое брожение и корм становится непригоден к применению. На практике используется также спиртовое брожение глюкозы, например при производстве пива. 3. Задача. Вычислите массу хлорида натрия и воды, необходимых для приготовления 500 г раствора, в котором содержание хлорида натрия 0, 05 или 5%.
ω = mр.в./mр-ра mр.в. = ω × mр-ра m(NaCl) = 0,05 × 500 = 25 (г) m(H2O) = mр-ра - mр.в. = 500 – 25 = 475 (г) Ответ: для приготовления 500 г раствора необходимо взять 25 г хлорида натрия и 475 г воды.
Билет №17 Нахождение в природе
Крахмал – основной источник резервной энергии в растительных клетках – образуется в растениях в процессе фотосинтеза и накапливается в клубнях, корнях, семенах:
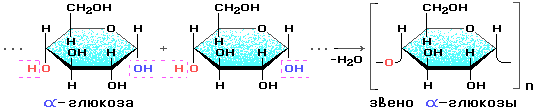
6CO2 + 6H2O свет, хлорофилл → C6H12O6 + 6O2 nC6H12O6 → (C6H10O5)n + nH2O глюкоза крахмал
Содержится в клубнях картофеля, зёрнах пшеницы, риса, кукурузы. Гликоген (животный крахмал), образуется в печени и мышцах животных.
Строение Состоит из остатков α - глюкозы.
В состав крахмала входят: · амилоза (внутренняя часть крахмального зерна) – 10-20% · амилопектин (оболочка крахмального зерна) – 80-90%
Применение
Крахмал широко применяется в различных отраслях промышленности (пищевой, бродильной, фармацевтической, текстильной, бумажной и т.п.). · Ценный питательный продукт. · Для накрахмаливания белья. · В качестве декстринового клея. Билет №18 Природные Их около 150, они были обнаружены в живых организмах, около 20 из них входят в состав белков. Половина этих аминокислот – незаменимые (не синтезируются в организме человека), они поступают с пищей. Синтетические Получают кислотным гидролизом белков, либо из карбоновых кислот, воздействуя на них галогенном и, далее, аммиаком. Физические свойства. Бесцветные. Кристаллические. Хорошо растворимы в воде, но нерастворимы в эфире. В зависимости от R могут быть сладкими, горькими или безвкусными. Обладают оптической активностью. Плавятся с разложением при температуре выше 200º. Химические свойства. Все аминокислоты амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так и основные свойства, обусловленные аминогруппой —NH2. 1. Аминокислоты взаимодействуют с кислотами и щелочами: NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH (хлороводородная соль глицина) NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая соль глицина) 2. Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов. Этерификация: NH2 —CH2 —COOH + CH3OH → H2O + NH2 —CH2 —COOCH3 (метиловый эфир глицина) Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона.
Реакция образования пептидов: HOOC —CH2 —NH —H + HOOC —CH2 —NH2 → HOOC —CH2 —NH —CO —CH2 —NH2 + H2O Основная биологическая роль аминокислот заключается в том, что они являются основными «кирпичиками» для построения белковых молекул. Некоторые аминокислоты используют в медицине в лечебных целях (при сильном истощении, после тяжелых операций). Некоторые аминокислоты используют в сельском хозяйстве для подкормки животных. Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона. Билет№15 Кислоты, их классификация и свойства на основе представлений об электролитической диссоциации. Кислоты – это электролиты, при диссоциации водных растворов которых в качестве катионов отщепляются только ионы водорода. HCl → H+ + Cl- H2SO4 → 2H+ + SO42- Отрицательные ионы, которые отщепляются от молекулы кислоты называются кислотными остатками. Кислоты классифицируют по нескольким признакам. По составу: Бескислородные HCl, HNO3 Кислородосодержащие H2SO4, H2CO3 По основности: Одноосновные HCl, HNO3 Двухосновные H2SO4, H2CO3 Трехосновные H3PO4 По силе: Сильные HCl, HNO3, H2SO4 Слабые H2S, H2CO3 Общие химические свойства кислот обусловлены наличием иона водорода. Для кислот характерны следующие химические свойства: 1. Взаимодействие с активными металлами. Zn + HCl = ZnCl2 + H2↑ 2. Взаимодействие с основными оксидами. CuO + H2SO4 = CuSO4 + H2O 3. Взаимодействие с основаниями. HCl + NaOH = NaCl + H2O H+ + Cl- + Na+ + OH- = Na+ + Cl- + H2O H+ + OH- = H2O 4. Взаимодействие с солями – такая реакция протекает только в том случае, е6сли образуется осадок, летучее вещество или слабый электролит. HCl + AgNO3 = AgCl↓ + HNO3 H+ + Cl- + Ag+ + NO3- = AgCl↓ + H+ + NO3- Cl- + Ag+ = AgCl↓
|
||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 6785; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.01 с.) |