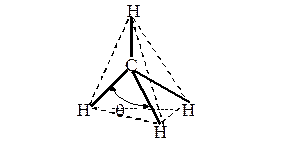Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Молекулярный уровень организации вещества. Кристаллы с ионной и металлической связьюСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Часто можно услышать: «молекула состоит из атомов» или «в состав молекулы входят атомы», и далее пишется формула органического или неорганического соединения. Например, СН4, С2Н6, Н2, Н2О. Общее, что объединяет соединения с молекулярной структурой, – это наличие в них ковалентных связей. В молекулах ковалентная связь образуется в результате перекрывания атомных орбиталей при участии пары электронов с противоположными спинами. В ионных кристаллах действуют силы электростатического притяжения между положительно и отрицательно заряженными ионами. В металлах положительно заряженные ионы удерживаются в узлах кристаллической решетки отрицательно заряженным «электронным газом». Такую функцию выполняют валентные электроны внешней оболочки атомов металлов. Химическая связь обусловлена электромагнитным взаимодействием, удерживающим систему ядер и электронов в молекулах или кристаллах. В молекулярных образованиях и кристаллических телах действуют не только силы притяжения противоположно заряженных частей системы (ядро – электрон) и силы отталкивания одинаковых по знаку заряженных частей (ядро – ядро, электрон – электрон). Уменьшение энергии системы при образовании химической связи не может быть описано только электростатической моделью и требует учета так называемых квантовых эффектов системы. С учетом квантовых эффектов силы притяжения и отталкивания уравновешены и обеспечивают устойчивость молекулярной и кристаллической системы.
Модели молекул. Ковалентная химическая Связь Рассмотрим молекулярные структуры с присущими им ковалентными связями. Ковалентная связь обусловлена электромагнитным взаимодействием, удерживающим положительно заряженные ядра отрицательным зарядом, сосредоточенным в области перекрывания атомных орбиталей. В атомах число атомных орбиталей, принимающих участие в образовании ковалентных связей, ограничено, следовательно для образования ковалентных связей характерна насыщаемость. Так, в молекуле Н2 (Н-Н) одна ковалентная связь между атомами водорода, и невозможно молекулярное образование Н4 в силу того обстоятельства, что пара электронов, участвующая в образовании ковалентной связи, заняла две s -орбитали, а в соответствии с принципом запрета Паули больше двух электронов с противоположными спинами на перекрывающихся орбиталях быть не может.
В атоме кислорода во внешней электронной оболочке две орбитали содержат по одному неспаренному электрону. Они принимают участие в образовании двух расположенных под некоторым углом друг к другу ковалентных связей в молекуле воды. Следовательно, ковалентные связи характеризуются не только насыщаемостью, но и направленностью. Молекула – микросистема, состоящая из двух или большего числа ядер и электронов, движущихся в поле ядер, и содержащая ковалентные связи. На рис. 8 представлены структурные модели молекул.
формулы формулы
  
  
Рис. 8. Модели молекул H2 и F2 с неполярными ковалентными связями и HF и Н2S с полярными ковалентными связями. В атомах фтора и серы изображены соответственно только внешние 2 р и 3 р -орбитали Область перекрывания атомных орбиталей несет отрицательный заряд (δ-), удерживающий положительно заряженные ядра на расстоянии, соответствующем длине химической связи (lсв). Длина ковалентной связи – это расстояние между ядрами ковалентно связанных атомов молекулы. Пара электронов ⇅, участвующая в образовании ковалентной связи (валентные электроны от лат. valentiа – сила), принадлежит обоим атомам. В молекулах водорода Н2 и фтора F2 распределение электронной плотности симметрично относительно ядер. Зона перекрывания атомных орбиталей расположена между ядрами атомов. В них электронная пара в равной степени принадлежит обоим атомам. Такую ковалентную связь называют неполярной. Центры тяжести положительных и отрицательных зарядов таких молекул совпадают. Это молекулы недиполи. В молекулах фтороводорода HF и сероводорода H2S зоны перекрывания атомных орбиталей несимметрично расположены между ядрами атомов. Электронная плотность в большей степени смещена к ядру атома фтора в HF и к ядру атома серы в H2S. Такие ковалентные связи называют полярными.
Гибридизация, s- и p-связи На рис. 9 представлена молекула метана СН4 с ковалентными s-связями. Ковалентная s-связь образуется между атомами при перекрывании орбиталей вдоль линии, проходящей через ядра атомов.
Рассмотрим структуру пятиатомной молекулы метана СН4. Четыре ковалентных связи (темные линии) расположены в пространстве симметрично (рис. 9). Если атом углерода поместить в центре тетраэдра, то химические связи, соединяющие атом углерода с атомами водорода, направленны к его вершинам. Как могли образоваться четыре равноценные связи в метане при наличии в атоме углерода двух электронов, расположенных на 2 р -орбиталях, напоминающих по форме спортивные гантели, и двух электронов на сферической 2 s -орбитали? Это возможно, если атом углерода переходит из основного 1s22 s 22 p 2 в возбужденное состояние 1s22 s 12 p 3, перестраивая внешние электронные оболочки (рис. 10). На рис. 11 показано sp3 гибридное состояние атома углерода в молекуле метана.
Рис. 9. Модель молекулы метана. Угол q между С—Н связями составляет 109.280
Рис. 10. Распределение электронов по энергетическим уровням (квантовым ячейкам) в атоме углерода: основное состояние С и возбужденное состояние С*
Гибридизация представляет собой способ описания перестройки атомных орбиталей в молекуле по сравнению со свободным атомом. Эта идея принадлежит выдающимся физикам Л. Полингу и Д. Слэтеру.

Рис. 11. Состояние атома углерода(sp3 гибридизация) в молекуле метана
Гибридизация позволяет объяснить существование не только одинарных, но двойных и тройных связей между атомами. В молекуле метана (рис. 11 и 12 а) sp3 -гибридизация атома углерода обеспечивает расположение ковалентных s-связей под углом 109.280. В молекуле этилена атом углерода существует в sp2 гибридном состоянии. Три sp2 -гибридные орбитали углерода расположены в одной плоскости под углом 1200 и одна р -орбиталь перпендикулярна плоскости. В молекуле этилена Н2С=СН2 между атомами углерода образуется двойная связь: одна – s (сигма) -связь, вторая – p (пи) -связь (рис. 12, б). p -Связь между атомами осуществляется таким образом, что образуются две области перекрывания р-орбиталей по обе стороны от оси s-связи. В молекуле ацетилена НС≡СН, имеющей тройную химическую связь, атомы углерода находятся в состоянии sр -гибридизации. В атомах углерода ацетилена существуют две взаимно перпендикулярные р -орбитали и две sp- гибридных орбитали, находящиеся под углом 1800 (рис. 12, в). а) б) в)
Рис. 12. Положение s- и p-связей в молекулах метана, этилена и ацетилена; s-связи представлены линиями, p-связи – перекрыванием р -орбиталей
Донорно-акцепторная связь Взаимодействия молекул с образованием донорно-акцепторной ковалентной связи широко распространены. Такие связи еще называются координационными. Донор электронов располагает атомом, одна из орбиталей которого содержит пару электронов. Акцептор электронов располагает атомом, одна из орбиталей которого вакантна, т.е. не заселена электронами. Когда взаимодействуют молекулы электроноакцепторы и электронодоноры, перекрывание орбиталей приводит к образованию донорно-акцепторной ковалентной связи. Донорно-акцепторная ковалентная связь образуется между атомами при участии пары электронов электронодонора и вакантной орбитали электроноакцептора.
На рис. 13 представлено образование донорно-акцепторной связи при взаимодействии газообразного аммиака и хлороводорода. Атом водорода с вакантной орбиталью соединяется с молекулой аммиака донорно-акцепторной связью, оставляя при этом свой электрон атому хлора.
Рис. 13. Механизм образования донорно-акцепторной связи
Азот в аммиаке выполняет функцию донора, а ион водорода – акцептора электронов. Переход водорода от хлороводорода без электрона компенсируется парой электронов атома азота. В образовавшемся ионе NH4+ все связи ковалентные и равноценные.
2.4. Ионная связь Случаю предельной поляризации ковалентной связи отвечает ионная связь. Ионная связь отличается от ковалентной тем, что при её образовании практически отсутствует перекрывание атомных орбиталей. Например, при сближении иона лития Li+ с ионом фтора F– происходит их объединение в ионную пару за счет электростатического притяжения (рис. 14). Ионная связь обусловлена взаимодействием противоположно заряженных сферических ионов, удерживающая их на расстоянии длины химической связи.
  
Рис. 14. Ионная связь во фториде лития Li+F-. Пунктиром обозначена 2 s -орбиталь, электрон с которой перешел на 2 р - орбиталь атома фтора; 2 s -орбиталь фтора не обозначена
Длина ионной связи соответствует расстоянию между центрами ионов. Ионная связь образуется между атомами, существенно отличающимися по электроотрицательности. Электроотрицательность атома – параметр, характеризующий способность атома притягивать к себе электрон. Расчеты электроотрицательности (ЭО) были выполнены Л. Полингом и Р. Малликеном. Большинство химиков пользуется шкалой электроотрицательности Полинга (табл. 2). Чем выше разность электроотрицательностей химически связанных атомов, тем полярнее связь, достигающая в пределе состояния ионной пары. Существует качественная оценка ионности связи (i): Таблица 2
|
||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 427; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.153.57 (0.011 с.) |


 Структурные Молекулярные
Структурные Молекулярные