
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Частина 2. Молекулярна фізика та основи термодинаміки.Содержание книги
Поиск на нашем сайте
Розділ 1. Основи молекулярно-кінетичної теорії газів. Основні положення МКТ.
На початку минулого століття англійський учений Д.Дальтон показав, що більшість закономірностей явищ природи можна пояснити, використовуючи уявлення про атоми і молекули, і науково обґрунтував молекулярну будову речовини. На початок нашого століття була врешті побудована і підтверджена багатьма дослідами МКТ будови речовини. МКТ – вчення, що пояснює будову і властивості тіл рухом і взаємодією атомів, молекул і іонів, з яких складаються тіла. В основі МКТ лежать 3 найважливіших положення, які повністю підтверджені експериментально і теоретично. І положення: Всі тіла складаються з частинок – атомів, молекул і іонів, в склад яких входять ще менші частинки, які умовно називають елементарними. Молекулою(від латинського „молес” – маса, „кула” – зменшувальний суфікс) називають найменшу частинку речовини, здатну до самостійного існування, яка зберігає хімічні властивості цієї речовини. Молекули складаються з атомів(від грецького „атомос” – неподільний). Якщо при деякому явищі природи молекули залишаються незмінними, то речовина зберігає свої хімічні властивості. Якщо ж молекули змінюють свою будову чи розпадаються на окремі атоми, що утворюються нові види речовини з іншими хімічними і фізичними властивостями. Речовини, які не можна розкласти на більш прості складові частини, називаються хімічними елементами. Кожному хімічному елементу відповідають атоми, які мають певне місце (номер) в таблиці Мендєлєєва. Кількість сортів(видів) атомів порівняно невелика і дорівнює числу хімічних елементів та їх ізотопів(на сьогодні відомо 108 елементів і Різні комбінації цих атомів і створюють всю множину видів молекул. Молекули, що утворюють дану речовину, однакові, але відрізняються швидкостями. Різні речовини складаються з різних молекул. Молекули характеризуються певними константами. До них відносяться розміри молекули; число Авогадро і маса молекул. Розміри молекул мають порядок 1 ангстрема.
Розмір молекул становить деяку умовну величину. Дійсно, молекула має певну форму, але оточена складним електромагнітним полем, яке простягається нескінченно, проте швидко зменшується з відстанню і на деякій відстані ним можна знехтувати. Ця відстань і називається радіусом молекули, а молекулі приписують форму кулі. Розміри атомів і молекул мають в середньому порядок Маси молекул дуже малі(у звичних для нас масштабах). Наприклад, маса молекули кисню
Тому була введена нова додаткова одиниця вимірювання – атомна одиниця маси. Атомною одиницею маси називається Маса молекули(атома), виражена в атомних одиницях маси, називається відносно молекулярною(атомною) масою А. Вона показує у скільки разів маса молекули речовини більша Атомна одиниця маси
Отже, масу молекули можна знайти за відомою відносною молекулярною масою.
Атоми різних хімічних елементів мають різну атомну масу, тому, наприклад, в 1 кг свинцю Pb і в 1 кг алюмінію Al міститься різна кількість атомів. Тому для кількісної характеристики однорідних тіл по кількості атомів і молекул, що містяться в них, вводиться поняття кількості речовини. Кількістю речовини називається фізична величина, що визначається кількістю специфічних структурних елементів, атомів, молекул або іонів, - з яких складається речовина. Так як маси окремих структурних елементів, наприклад, молекул, відрізняються, то однакові кількості різних речовин мають різну масу. Підкреслимо, що маса не є мірою кількості речовини. В СІ за одиницю вимірювання кількості речовини прийнято 1 моль – кількості речовини, що містить стільки ж молекул(атомів), скільки атомів міститься в 0,012 кг вуглецю Кількість атомів чи молекул, що містяться в 1 молі речовини, називається числом Авогадро(
Визначення числа Авогадро відноситься до числа особливо важливих подій в зв’язку з тим, що це число безпосередньо пов’язано з існуванням атомної будови речовини. Число Авогадро пов’язує мікроскопічний масштаб з макроскопічним, бо моль будь якої речовини як правило містить тіло звичних для нас розмірів, тобто макротіло. Наприклад, при нормальному атмосферному тиску і Масу однієї молекули чи атома можна отримати із співвідношення
ІІ положення: Між частинками любого тіла(атомами, молекулами і іонами) одночасно діють сили взаємного притягання і сили взаємного відштовхування. Закони сил, що діють між атомами, молекулами і іонами, зовсім не схожі на кулонівські, хоча ці сили врешті мають електромагнітне походження. Точний вигляд закону взаємодії частинок такого роду дуже складний. Зокрема, сила їх взаємодії виявляється залежно не тільки від відстані між частинками, що взаємодіють, але і від їх взаємної орієнтації. Однак, в більшості випадків достатньо знати силу взаємодії, середню по всім їх можливим орієнтаціям. Закон дії усереднених сил виявляється порівняно простим і має вигляд: 1) для сил притягання
2) для сил відштовхування
де a і b – коефіцієнти пропорційності, що залежать від будови молекул, які взаємодіють. Одночасне існування сил притягання і відштовхування означає, що на молекулу діє рівнодійна сила міжмолекулярної взаємодії.
Одну молекулу вважаємо нерухомою і розміщеною в початку системи координат Величина сил міжмолекулярної взаємодії не залежить від загального числа молекул. Наприклад, густина або пружні властивості рідини і твердих тіл не залежать від розмірів дослідного зразка: крапля води і вода в Дніпрі за однакової температури і однакового зовнішнього тиску мають рівну густину і стискуваність. Ця властивість міжмолекулярних сил називається насичуваністю. Цим міжмолекулярні сили принципово відрізняються від гравітаційних чи кулонівських сил, для яких рівнодійна визначається дією всіх тіл, що входять в систему. Сили міжмолекулярної взаємодії мають електромагнітну природу, зумовлену тим, що молекули складаються із електрично заряджених частинок, яки властива взаємодія. Правда, в цілому молекула електрично нейтральна, однак заряди в молекулі розміщуються в процесі її наближення до іншої молекули несиметрично. Завдяки цьому молекули виявляються полярними, подібними електричним диполям: між різнойменно зарядженими полюсами виникають сили притягання, що переважають сили відштовхування однойменних „полюсів”. Якщо ж молекули дуже близько підійдуть одна до одної, то вирішальну роль в їх взаємодії починають відігравати сили відштовхування між електронними оболонками атомів, що складають цю молекулу. ІІІ положення: Атоми, молекули і іони перебувають в неперервному хаотичному русі. Хаотичний рух частинок, що утворюють макроскопічне тіло, називається тепловим. Тепловий рух визначає внутрішній стан кожного макроскопічного тіла. За винятком особливих випадків, які мають місце в квантовій фізиці, тепловий рух є нерелятивістським, тобто швидкість молекул набагато менше швидкості світла. Відмітимо, що про тепловий рух можна говорити тільки в тих випадках, коли розглядувана фізична система є макроскопічною. Не має сенсу вести мову про тепловий рух, коли система, наприклад, складається з однієї чи кількох молекул(атомів чи іонів). Знаходячись у стані неперервного хаотичного руху молекули „зтикаються” одна з одною і змінюють свою швидкість як за напрямком, так і за величиною. Правда, зіткнення при цьому у звичайному розумінні цього слова не відбувається, бо безпосередньому зтиканню молекул заважають сили відштовхування, що різко зростають при їх наближенні. Але дія цих сил приводить до того ж результату, що при звичайному зіткненні, тобто відскакуванню молекул, що наблизились, одна від одної.
§2. Ідеальний газ. Основне рівняння МКТ газів(рівняння Клаузіуса).
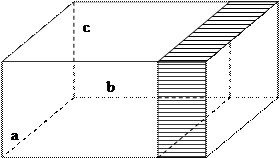
Перед тим як розпочати розгляд рівняння Клаузіуса, зробимо кілька попередніх припущень відносно самого газу: а) молекули – пружні кульки, розмірами яких можна знехтувати(матеріальні точки), що рухаються хаотично, при цьому між ними відбуваються пружні зіткнення; б) сили притягання між молекулами газу нехтовно малі бо молекули знаходяться на значних відстанях одна від одної. Сили відштовхування між молекулами виявляються тільки в моменти взаємозіткнень останніх; в) кількість взаємозіткнень між молекулами набагато менше в порівнянні з кількістю ударів об стінки посудини, в якій газ знаходиться. г) об’єм молекул газу в порівнянні з об’ємом посудини, в якій газ знаходиться, можна знехтувати. Газ, що задовольняє цим умовам, називається ідеальним. Реальні гази не задовольняють описаній моделі. Але реальний газ, що розміщений в досить великому об’ємі і перебуває не під дуже високим тиском(до 100 фізичних атмосфер – 1атм = 760 мм.рт.ст.) веде себе як ідеальний. Щоб проаналізувати тиск, що створюють молекули газу, кількісно, припустимо, що газ знаходиться в посудині, одна стінка якої є поршнем, здатний переміщуватися.
Знайдемо силу, з якою діють на поршень молекули, що знаходяться всередині посудини. В поршень вдаряються молекули, що рухаються всередині об’єму з різними швидкостями. Припустимо, що зовні посудини вакуум. Що відбудеться? Щоб утримати поршень, доведеться прикласти силу F. Тоді на поршень буде діяти тиск.
З якою силою треба діяти на поршень, щоб зрівноважити удари молекул? При кожному ударі поршню надається деякий імпульс. Отже, сила, яку ми визначили як добуток тиску на площу, дорівнює імпульсу, переданому поршню за 1 с всіма молекулами всередині посудини. Підрахунок імпульсу, що передається поршню за 1 с, виконаємо в дві статті: а) спочатку визначимо кількість співударянь молекул з одиницею поверхні поршня за 1 с. б) потім визначимо імпульс, переданий однією молекулою при зіткненні з поршнем. Сила, що діє на одиницю площі(тобто тиск) і буде добутком цих двох величин. Вважаємо всі напрямки руху молекул рівноцінними, тому в трьох напрямах, паралельно ребрам a, b, c, рухається 1/3 від загальної кількості молекул в посудині. Розглянемо молекули, що рухаються вздовж ребра b в напрямі поршня. За 1 с одна молекула зазнає З Тоді за 1 с вони зазнають Отже, за 1 с з одиницею площі поверхні поширення зіткнеться
Врахуємо, що молекули мають різні швидкості. Тоді в поршень за 1 с будуть ударяти різні групи молекул з швидкостями Врахуємо, що Тоді кількість зіткнень молекул з поршнем за 1 с буде дорівнювати б) визначимо імпульс, переданий однією молекулою поршню. Внаслідок абсолютно пружного зіткнення з поршнем молекула змінює свою швидкість за напрямком. Тоді зміна імпульсу молекули дорівнює А поршень змінює свій імпульс на величину Проводячи усереднення, отримаємо
Формули (1) і (2) і є основним рівнянням МКТ ідеального газу(рівняння Клаузіуса). Це рівняння пов’язує між собою макроскопічні характеристики газу з мікроскопічними характеристиками молекул.
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-13; просмотров: 389; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.106.79 (0.006 с.) |

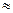 1,5 тисячі ізотопів).
1,5 тисячі ізотопів).
 . Розроблено значну кількість методів, за допомогою яких можна досить точно визначити розміри і масу молекули. Але ці способи, як правило, досить складні і громіздкі.
. Розроблено значну кількість методів, за допомогою яких можна досить точно визначити розміри і масу молекули. Але ці способи, як правило, досить складні і громіздкі. г
г г
г г
г маси ізотопу вуглецю
маси ізотопу вуглецю  .
.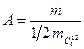
 кг
кг кг
кг ).
). моль-1
моль-1 , моль будь якого газу займає об’єм
, моль будь якого газу займає об’єм  л.
л. (1)
(1) (2)
(2) (2)
(2)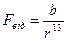 (3)
(3)
 , а друга молекула змінює свою відстань відносно першої вздовж осі
, а друга молекула змінює свою відстань відносно першої вздовж осі  .
.

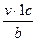 зіткнень з поршнем.
зіткнень з поршнем.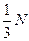 молекул в напрямі поршня рухається половина молекул, тобто
молекул в напрямі поршня рухається половина молекул, тобто  .
.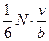 зіткнень.
зіткнень. молекул.
молекул. .
.

 .
.

 (1)
(1) (2)
(2)


