
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общие представления о системе правил GMPСодержание книги
Поиск на нашем сайте
Одним из основных показателей качества фармацев- тической продукции является безопасность для больного. Этот принцип осуществляется на всех этапах разработ- ки, испытания, производства и реализации ЛС (рис. 82). Правила GMP (в дословном переводе «Правила надлежащего, доброкачественного производства») на- правлены на решение двуединой задачи: (1) они явля- ются гарантами качества производимой продукции, (2) направлены на уменьшение риска, свойственного любой фармацевтической продукции, который не мо- жет быть полностью исключен при проверке на соот- ветствие стандартам качества. Некачественные лекарства не только представля- ют опасность для здоровья людей, но и наносят ма-
GMP — Good Manufacturing Practice GDP — Good Distribution Practice GPP — Good Pharmacy Practice териальный ущерб государству и индивидуальным потребителям. Некачественные лекарства могут содер- жать токсичные вещества, добавленные неумышлен- но. Препарат, не содержащий действующих веществ в достаточном количестве, не будет давать ожидаемого терапевтического эффекта. Правила GMP распространяются на все аспек- ты разработки нового препарата, проектирования, производства, начиная с исходных материалов, по- мещений и оборудования и заканчивая подготовкой персонала и его личной гигиеной. Для каждого про- цесса, способного влиять на качество готового про-
дукта, должны быть в наличии детальные инструк- ции. Правила GMP содействуют расширению возмож- ностей экспорта медикаментов. Большинство стран согласно импортировать и направлять на реализацию только лекарства, произведенные с соблюдением пра- вил GMP. В настоящее время к системе правил присоедини- лись 140 государств, в том числе и Россия. Основные положения GMP: 1. Четкое описание всех производственных эта- пов, их систематическая проверка. 2. Обоснование всех критических производ- ственных этапов и существенных изменений процес- сов в соответствии с НАССР. 3. Соблюдение требований к персоналу, услови- ям производства и помещениям, оборудованию, мате- риалам, емкостям и этикеткам. 4. Составление указаний и описание действий должны быть даны в ясной и однозначной письменной форме и относиться специально к имеющимся уста- новкам. 5. Составление протоколов ведется с указанием всех производственных ступеней, записью и провер- кой любых отклонений. 6. Сбыт продукции осуществляется таким обра- зом, чтобы любую угрозу качеству свести к минимуму. 7. Наличие системы отзыва продукции. 8. Проверка претензий и причин нарушения ка- чества для принятия соответствующих мер. Преимуществами GMP являются: 1) профилактический подход к проблеме обеспе- чения качества; 2) комплексный и системный подход; 3) улучшение имиджа производителя; 4) экономическая выгода в долгосрочном плане. Изготовление некачественных препаратов не при- водит к экономии средств. В долгосрочной перспек- тиве поиск и исправление ошибок требуют больших затрат, чем их предотвращение. Цель GMP — избежать ошибок. Внедрение GMP является инвестицией в высококачественные медика- менты. Изготовление и распространение низкокаче- ственных лекарств приводит к утрате доверия ко всем участникам лекарственного обеспечения, в том числе и к производителю. Российские правила GMP изложены в разделах ОСТ 42-510-98 «Правила правильного производства», они являются общим руководством, устанавливаю- щим порядок организации производственного процес- са и проведения контроля, и содержат минимальные практические указания по правильному ведению про- изводства. Они являются обязательными для всех про- изводителей лекарственных средств.
25.3 Микробиологические требования к организации производства фармацевтической продукции
Всю фармацевтическую продукцию по показа- телю микробиологической чистоты подразделяют на стерильную и нестерильную. Стерильные препараты производят в асептиче- ских условиях, которые должны исключать их загряз- нение микроорганизмами, пирогенными веществами и механическими частицами. Технологические процессы в производстве сте- рильных препаратов могут предусматривать проведе- ние стерилизации на завершающей стадии производства (финишная стерилизация) или стерилизацию на проме- жуточных стадиях. К последней группе относят: • термолабильные препараты, стерилизуемые методом мембранного фильтрования с последующим дозированием; • глазные мази, не стерилизуемые в конечной упаковке (алюминиевых тубах); • глазные капли с последующим заполнением стерильного раствора в тюбики-капельницы (предва- рительно простерилизованные ионизирующим излу- чением или химическим методом). К производству таких препаратов предъявляют особые требования по созданию асептических усло- вий, которые изложены в Приложении к правилам. Нестерильные препараты производят в неасеп- тических условиях, приближенных к асептическим. Требуемый уровень микробиологической чистоты обеспечивается проведением соответствующих меро- приятий, включающих организацию производствен- ных помещений, выбор и эксплуатацию оборудования, и микробиологический контроль производства и гото- вой продукции, подбор и гигиеническую подготовку персонала. Персонал фармацевтических предприятий являет- ся одним из основных источников контаминации ГЛС и полупродуктов механическими частицами и микро- организмами. Весь персонал, работающий на предприятии, дол- жен иметь знания и опыт, необходимые для выполне- ния соответствующих обязанностей, а также должен быть ознакомлен с правилами GMP. Состояние здоровья персонала является важ- ным фактором в системе обеспечения качества ГЛС, поскольку человек может быть источником инфек- ции или способствовать ее переносу. Весь персо- нал, занятый на производстве, должен проходить регулярные медицинские осмотры. К работе в чи- стых помещениях не должны допускаться люди, страдающие аллергическими и кожными заболева- ниями, повышенным отделением перхоти, а также курящие. Временно (до нормализации состояния здоровья) к работе не допускаются больные инфек- ционными заболеваниями и сотрудники, имеющие загар или различные повреждения кожи. Персо- нал должен ставить в известность руководителей о любых недомоганиях (острых респираторных, кожных) способных оказать нежелательное воздей- ствие на качество ЛС. Личная гигиена персонала. Персонал, работающий в производстве стерильных лекарственных средств, должен строго соблюдать правила личной гигиены: регулярно принимать душ, мыть голову не реже 2-х раз в неделю. Подготовка персонала к работе должна осуществляться в определенном порядке. Во время работы необходимо носить технологическую одежду, соответствующую выполняемым производственным операциям (ГОСТ Р 52538-2006). Во время работы запрещается использование кос- метики, а также запрещается носить часы и ювелир- ные изделия, вносить в производственные помещения личные вещи, запрещается принимать пищу и хранить еду, личные лекарства. Правила поведения персонала. В производстве стерильных лекарственных средств необходимо стро- го ограничивать число работающих до минимально необходимого уровня. Запрещается бесцельное хож- дение во время работы. Все движения должны быть медленными и плавными. Запрещаются разговоры на посторонние темы; устное общение с людьми, на- ходящимися вне производственных помещений, осу- ществляется через телефон или селектор. Запрещает- ся смех, крики, так как при этом увеличивается число выделяемых изо рта микроорганизмов. Нельзя подни- мать и использовать упавшие на пол во время работы предметы. Запрещается использование карандашей, перьевых ручек, разрешается применение шариковых ручек или фломастеров, которые один раз в смену про- тирают салфеткой из специальной ткани, смоченной этиловым спиртом. Обо всех нарушениях и неблагоприятных измене- ниях санитарного режима персонал должен сообщать руководителю. Неправильная подготовка и поведение персонала приводит к резкому снижению показателей микробио- логической чистоты.
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 118; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.188.105 (0.008 с.) |
|||||||||||||||||||||


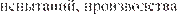
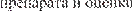
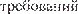

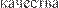

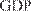
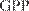


 Рис. 82. Этапы разработки, испытаний, производства и реализации ЛС-жизненный цикл лекарственного сред- ства.
Рис. 82. Этапы разработки, испытаний, производства и реализации ЛС-жизненный цикл лекарственного сред- ства.
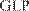
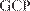


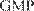



 GLP — Good Laboratory Practice GCP — Good Clinical Practice
GLP — Good Laboratory Practice GCP — Good Clinical Practice


