
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение эффективности консервантов лекарственных средств
Консерванты вводят в состав как стериль- ных, так и нестерильных лекарственных средств (табл. 32) для предотвращения роста микроорганиз- мов, попадающих в них во время технологическо- го процесса, или при неоднократном употреблении [28]. Они не должны использоваться, чтобы зама- скировать низкое качество производства. Учитывая возможность побочного действия, консерванты сле- дует применять только при строгой необходимости. Требования к консервантам: • широкий спектр антимикробной активности; • быстрота биоцидного действия; • отсутствие взаимодействия с компонентами лекарственного средства; • стабильность; • отсутствие раздражающего или токсического действия биоцида или продуктов его распада. Однако немногие вещества отвечают этим иде- альным требованиям. При использовании консерванта следует учитывать ряд факторов, влияющих на эффек- тивность его действия: микробная нагрузка, темпера- тура, рН, состав лекарственного средства. В мультифазной системе консервант распределя- ется неравномерно в соответствии с его гидрофиль- ной или гидрофобной природой. Консервант может адсорбироваться на материале первичной упаковки, что снижает его активность. Концентрация летучих ве- ществ (хлороформа) может снижаться при повторном открывании контейнера. Все лекарственные препараты, в состав которых входят консерванты, разделяются на категории, пред- ставленные в таблице 33. Категории лекарственных препаратов, в состав которых входят консерванты
Таблица 33. 1 Инъекционные и другие парентеральные лекарственные препараты, включая эмульсии. Лекарственные препараты для введения в полость уха, носа (стерильные), офтальмологические средства, водорастворимые или приготовленные на водной основе 2 Лекарственные препараты, применяемые местно, нестерильные лекарственные препараты для введения в полость носа, эмульсии, в том числе и на слизистые 3 Лекарственные препараты для приема внутрь, за исключением антацидов, водорастворимые или приготовленные на водной основе
4 Антацидные лекарственные препараты, приготовленные на водной основе Парентеральные, офтальмологические, внутриматочные и интрамаммарные лекарственные препараты
Лекарственные препараты для введения в полость уха, носа, лекарственные препараты, используемые в виде кожных аппликаций и для ингаляций Лекарственные препараты для приема внутрь, ректального введения, для нанесения на слизистую оболочку рта -
Условия культивирования тест-микроорганизмов для приготовления инокулята
Таблица 34. Тест-штамм Питательная среда* Температура инкубации Время инкубации
25922 Pseudomonas аeruginosa АТСС 9027 Staphylococcus aureus АТСС 6538 Candida albicans АТСС 10231 (или NCTC 885-653) Соево-казеиновый агар или среда № 1
Соево-казеиновый бульон или среда № 8
Агар Сабуро с глюкозой или среда № 2, жидкая среда Сабуро или соево-казеиновый бульон (32,5 ± 2,5)°C 18-24 ч
(22,5 ± 2,5)°C 48 ч Aspergillus brasiliensis АТСС 16404 (или АТСС 9642) Агар Сабуро с глюкозой или среда № 2 (22,5 ± 2,5)°C 6-10 сут
* — допускается использование альтернативных жидких и агаризованных питательных сред отечественно- го и зарубежного производства.
Определение эффективности антимикробных консервантов в настоящее время выполняют в соот- ветствии с ОФС 42-0069-07 «Определение эффектив- ности антимикробных консервантов лекарственных средств» ГФ XII изд., ч. 1, с. 216-219. Эффективность консервантов определяют в отно- шении определенных видов бактерий и грибов. В ка- честве тест-микроорганизмов используют виды бак- терий и грибов, которые являются наиболее частыми контаминантами ЛС: Escherichia coli АТСС 8739 (или АТСС 25922), Pseudomonas aeruginosa АТСС 9027, Staphylococcus aureus АТСС 6538, Candida albicans АТСС 10231 (или NCTC 885- 653), Aspergillus brasiliensis АТСС 16404 (или АТСС 9642). Помимо перечисленных тест-штаммов можно использовать и другие микроорганизмы, которые должны быть типичными по культурально-морфо- логическим, тинкториальным и биохимическим свойствам. Набор тест-штаммов микроорганизмов может быть уменьшен или увеличен в зависимости от способа применения или состава испытуемого ЛП. Все тест-штаммы микроорганизмов, получен-
ные из Государственных коллекций с сертификатом производителя в ампулах, на дисках или в другом виде следует восстанавливать способами, описан- ными в прилагаемых к тест-штаммам инструкциях или в соответствии с ГФ XII изд. ОФС «Микро- биологическая чистота». Условия культивирования тест-штаммов для приготовления инокулята пред- ставлены в таблице 34. Контроль ростовых свойств используемых пита- тельных сред проводят в соответствии с ГФ XII изд. ОФС «Микробиологическая чистота». При приготовлении инокулята суточные куль- туры тест-штаммов бактерий и C. albicans смывают с поверхности скошенного агара стерильным 0,9% раствором натрия хлорида. Концентрацию клеток бактерий доводят до 109 КОЕ/мл, а C. albicans — до 107 КОЕ/мл, используя стандартный образец мут- ности или инструментальные методы, в том числе турбодиметрический. Для смыва конидий A. brasiliensis используют сте- рильный 0,9% раствор натрия хлорида, содержащий 0,05% твина-80. Количество конидий A. brasiliensis в 1 мл смыва определяют с помощью камеры Горяева или чашечным агаровым методом. Полученную взвесь разводят до концентрации 107 конидий в 1 мл. Стандартизованные суспензии всех тест- штаммов микроорганизмов разводят до концентра- ции 107-108 КОЕ/мл, а для препаратов 4 категории — 105-106 КОЕ/мл. Для определения эффективности консервантов ис- пользуют готовые ЛП в неповрежденной упаковке. В 5 стерильных флаконов помещают достаточное количество испытуемого препарата. В каждый флакон вносят по 0,1 мл (но не менее 0,5% от объема иссле- дуемого препарата) одного из приготовленных иноку- лятов тест-штаммов (Е. coli, Р. aeruginosa, S. aureus, C. albicans, A. brasiliensis) для получения концентра- ции 105-106 КОЕ в 1 мл или 1 г испытуемого образца и перемешивают. Образцы лекарственных препаратов на твердой ма- зевой основе нагревают до температуры (47,5±2,5)°С. Смешивают инокулят каждой стандартизованной ми- кробной суспензии с образцом препарата в течение щее измерение не отличается от предыдущего более, чем на 50%. Антимикробные консерванты лекарствен- ных средств считают эффективными, если наблюдают уменьшение количества клеток бактерий в соответ- ствии с критериями, описанными в таблице 35. В период с 7 до 14 сут. не должно наблюдаться увеличения числа бактерий. Количество клеток дрож- жеподобных и плесневых грибов не должно увеличи- ваться на протяжении всего срока исследования для всех категорий лекарственных средств.
Критерии оценки эффективности антимикробных консервантов лекарственных препаратов в отношении бактерий Таблица 35.
Категория Уменьшение количества клеток бактерий, log10
препарата 7 сут. 14 сут 28 сут 1 1 3 Не должно не менее 1 минуты до достижения гомогенной эмуль- 2 - 2 3 - 1 быть увеличения сии. Для улучшения смешивания можно добавить
определенное (валидированное) количество стериль- ного поверхностно-активного вещества, например, твина-80, если оно не влияет на жизнеспособность микроорганизмов или на эффективность консерванта. Фактическую исходную концентрацию бактерий и грибов в контаминированных образцах определяют сразу после контаминации. Для этого чашечным ага- ровым методом делают посев на соответствующие пи- тательные среды (таблица 34), используя подходящие разведения для получения на чашке от 30 до 300 ко- лоний бактерий и от 10 до 100 колоний грибов. Для этой цели также можно применять метод мембранной фильтрации при условии растворимости ЛП в водных растворителях или изопропилмиристате. Контаминированные образцы препаратов выдер- живают при температуре (22,5±2,5)°C в защищенном от света месте в течение определенного времени. Через 7, 14 и 28 сут. после инокуляции образцов препаратов 1 категории и через 14, 28 сут. препаратов 2 и 3 катего- рий определяют количество жизнеспособных микроор- ганизмов в 1 мл образца, делая высев на чашки Петри. В случае необходимости в чашки с питательной средой или в соответствующее разведение лекарствен- ного средства перед посевом вводят инактиватор (ней- трализатор) антимикробного действия определенного вещества, указанный в ОФС «Микробиологическая чистота». Учет результатов испытания проводят после посева чашечным агаровым методом, определяя ко- личество КОЕ/мл для каждого тест-штамма через ука- занные выше сроки инкубации контаминированного образца. Изменение количества микробных клеток по сравнению с исходной концентрацией в 1 мл вы- ражают в десятичных логарифмах (lg). При оценке эф- фективности антимикробного действия консервантов увеличение КОЕ/мл не фиксируется, если последую- Уменьшение количества клеток грибов, log10 1, 2, 3 Не должно быть увеличения 4 По сравнению с исходной концентрацией через 14 и 28 сут не должно быть увеличения
Испытание проводят с использованием следую- щих питательных сред: • Соево-казеиновый агар (Casein Soya Bean Digest agar)
Панкреатического гидролизата казеина 15,0 г Папаинового гидролизата бобов сои 5,0 г Натрия хлорида 5,0 г
Агара бактериологического 15,0 г Воды очищенной 1000 мл рН после стерилизации 7,3±0,2
Альтернативная отечественная среда для выра- щивания аэробных бактерий — Среда № 1 для контро- ля микробной загрязненности • Соево-казеиновый бульон (Casein Soya Bean Digest Broth)
Панкреатического гидролизата казеина 17,0 г Папаинового гидролизата бобов сои 3,0 г Натрия хлорида 5,0 г Калия фосфата двузамещенного 2,5 г Глюкозы моногидрата 2,5 г Воды очищенной 1000 мл рН после стерилизации 7,3±0,2
Альтернативная отечественная среда для выра- щивания бактерий — Среда № 8 для контроля микроб- ной загрязненности • Бульон Сабуро (Sabouraud- 2% Dextrose Broth)
Пептона (мясного) 5,0 г Пептона (казеинового) 5,0 г Глюкозы моногидрата 20,0 г Воды очищенной 1000 мл рН после стерилизации 5,6±0,2 • Агар Сабуро с глюкозой (Sabouraud 4% Glucose Agar) Альтернативная отечественная среда для выра- щивания дрожжевых и плесневых грибов — Среда № 2 Пептона (мясного или казеинового) Глюкозы моногидрата Агара бактериологического Воды очищенной 10,0 г
40,0 г
15,0 г
1000 мл (агар Сабуро с глюкозой) для контроля микробной за- грязненности
рН после стерилизации 5,6±0,2 ров. Глава 18. МЕХАНИЗМ ДЕЙСТВИЯ ДЕЗИНФЕКТАНТОВ
|
||||||||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 305; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.1.136 (0.031 с.) |

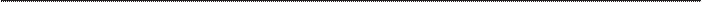
 Категория Лекарственные препараты
Категория Лекарственные препараты ГФ XII, ч. 1, ОФС 42-0069-07 USP 33 Eвропейская фармакопея 7.0
ГФ XII, ч. 1, ОФС 42-0069-07 USP 33 Eвропейская фармакопея 7.0

 Escherichia coli АТСС 8739 или АТСС
Escherichia coli АТСС 8739 или АТСС





 Для предотвращения роста бактерий перед стери- лизацией добавляют 50 мг хлорамфеникола (левоми- цетина) на 1 л среды или перед использованием добав- ляют 0,1 г натриевой соли бензилпенициллина и 0,1 г тетрациклина на 1 л среды в виде стерильных раство-
Для предотвращения роста бактерий перед стери- лизацией добавляют 50 мг хлорамфеникола (левоми- цетина) на 1 л среды или перед использованием добав- ляют 0,1 г натриевой соли бензилпенициллина и 0,1 г тетрациклина на 1 л среды в виде стерильных раство-



