Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные принципы хирургического устранения челюстно-лицевых дефектов и деформаций у леченных онкологических больных. Лечение лучевых некрозовСодержание книги
Поиск на нашем сайте Общие сведения Хирургические вмешательства по поводу злокачественных опухолей челюстно-лицевой области приводят обычно к значительному обезображиванию лица и резким нарушениям функции речи, глотания, жевания и дыхания. Это обязывает хирурга планировать не только удаление опухоли, но и одномоментное устранение образующегося дефекта с целью полного или частичного сохранения указанных функций, обеспечения социальной реабилитации бального. Поэтому в последнее время все большее число хирургов склоняется к мысли о необходимости одновременно с удалением опухали производить пластическую операцию для замещения образующихся дефектов костей и мягких тканей лица, языка (А. Т. Аббасов, 1967; Н. М. Александров, 1969; Д. А. Алиев, 1977; В. А. Дунаевский, 1976; А. И. Неробсев и соавт., 1982; Н. Н. Блохин и соавт.. 1988 и др.). Опыт многих чслюстно-лицевых клиник убедительно доказал, насколько остро необходима первичная пластическая операция. Впоследствии, из-за происходящего рубцевания и перемещения тканей, не только усиливаются функциональные нарушения, но и существенно ухудшаются условия для пластических, реконструктивных и восстановительных хирургических операций. Состоявшиеся в 1979-1996 годах конгрессы Международной, Европейской и национальных Ассоциаций чсрепно-челюстно-лицевых хирургов четко определили главную цель челюстно-лицевой онкологии — усовершенствование методов ликвидации опухоли в сочетании с пластическим или ортопедическим устранением образующихся послеоперационных дефектов как мягких, так и костных тканей. Нам пред ставляется остро необходимым: 1) совершенствование микрохирургической техники пересадки свободных кожных, кожно-жировых, кожно-мышечных лоскутов в области лица; 2) изыскание новых более совершенных (в косметическом и функциональном отношениях) пластических масс и других материалов для сложных челюстно-лицевых замещающих протезов больным, которым временно или постоянно противопоказаны сложные и многоэтапные восстановительные хирургические вмешательства. В настоящее время доказано, что первично произведенные восстановительные операции не способствуют возникновению рецидивов опухолей. Более того, процент рецидивов при первичной пластике значительно ниже, чем при отсроченных операциях. Эти рецидивы развиваются только по краю кожного трансплантата, не прорастая в него. По мнению многих авторов, производимая до и после операции лучевая терапия лишь незначительно влияет на заживление послеоперационной раны и приживление кожных трансплантатов. Однако, по нашему мнению, при планировании пластической операции следует всегда учитывать как степень обширности и глубины дефекта, давность его, так и сам факт имевшей место предоперационной лучевой терапии. Последняя, судя по нашему опыту, существенно снижает регенеративные способности тканей и отрицательно сказывается на результатах пластики. Требуется использование специальных мероприятий, известных из общей хирургии, для поднятия тонуса облученных тканей и всего организма. Мало того, как показали некоторые клинические наблюдения и экспериментальные исследования, предоперационная лучевая терапия Часть VI. Злокачественные новообразования челюстно-лицевой области злокачественных опухолей лица и челюстей иногда не только малоэффективна, но и безрезультатна. Наряду с этим она заметно повреждает ткани, что затрудняет проведение первичных восстановительных операций, особенно если возникает необходимость в перемещении тканей, связанном с ухудшением или временным прекращением кровоснабжения в трансплантатах. Применение двукратного (до- и послеоперационного) облучения значительно задерживает реактивную фазу в тканях ложа и трансплантатов, удлиняя сроки приживления их. Наиболее эффективной и наименее повреждающей является послеоперационная лучевая терапия. Что касается влияния цитотоксических веществ, применяемых при химиотерапии злокачественных опухолей в челюстно-лицевой области, то необходимо отметить, что они ухудшают процессы заживления послеоперационных ран (чаще бывают нагноения их, расхождения швов, а созревание соединительно-тканного рубца, костной мозоли в челюсти, дериватов в кожном трансплантате заметно тормозится). Как лучевая терапия, так и химиотерапия не только подавляют рост опухоли, но и замедляют репаративные процессы. Небезразличным для тканей является способ иссечения опухоли. Так, установлено (Г. Леви-ке, 1979), что между силой электрического тока и степенью термического повреждения ткани при воздействии электроножом есть прямо пропорциональная зависимость и что первичным натяжением заживают лишь те элсктрохирурги-ческие раны, края которых хорошо кровоточат. Следовательно, приступая к операции удаления опухоли, хирург должен учитывать факт предшествовавшего облучения, его давность, состояние мягких и костных тканей после этого облучения и т. д. Классификация дефектов и деформаций Дополняя классификацию, предложенную П В Наумовым (1966), мы делим все дефекты и деформации челюстно-лицевой области у оперированных онкологических больных и у больных, подлежащих операции (удаление опухоли), на следующие группы: А. По локализации: 1) в мягких тканях; 2) в костных, 3) в мягких и костных тканях, а также в хрящевом отделе носа. Б. По характеру предшествовавшего лечения 1) после лучевой терапии; 2) после операции обычным способом; 3) после электрохирургической операции; 4) после облучения и операции; 5) после химиотерапии и операции; 6) после тройного воздействия — химиотерапии, облучения и операции. В. По времени произведенного хирургического удаления опухоли: I) операция произведена давно; 2) операция произведена сегодня (больной еще находится на операционном сто ле). Лечение В отношении больных, которым ранее производили лучевую или химиотерапию массивными дозами, необходимо особенно тщательно следить за состоянием лейко- и эритропоэза до и после операции, проводя общетерапевтическую (стимулирующую) подготовку и заботясь об особенно высокой энергетической и витаминной ценности питания. В этом отношении большую положительную роль может сыграть применение специализированных продуктов питания — энпитов, которые показали их хорошую переносимость онкологическими больными, надежность полного введения диеты, возможность дозирования, высокую эффективность. Энпиты более полно удовлетворяют потребности больных, чем обычная больничная «трубочная» диета. Например, потеря в массе тела больных, питающихся энпитами, не превышает 1.5-2 кг, а питающиеся обычной «трубочной» больничной пищей — 5-6 кг. Азотистый баланс с 6-го послеоперационного дня бывает у первых, как правило, положительным и составляет от +1 23 до +2 22 г/сут, а у вторых — отрицательным (от -8.1 до 0.32 i/сут) Уровень общего белка у 1-й группы снижается на 6-8 сутки на 9-13%, а у 11-й группы на 15-16%, восстановление его уровня происходит соответственно на 12-е и на 20-е сутки. Следовательно, при использовании больничной «трубочной» диеты наблюдается частичное голодание больных, что объясняется следующим: 1) малым набором традиционных продуктов, годных для прохождения через трубку-зонд; 2) отсутствием в пищеблоках больниц специальной техники для гомогенизации блюд и продуктов; 3) высокими потребностями больных в энергии, белке и других нутриентах вследствие катаболической фазы обмена веществ в послеоперационном периоде; 4) длительным однообразием питания с определенным дефицитом биологически важных нутриентов, которых съедал бы больной с большим аппетитом; 5) нерационально высоким назначением в «трубочный» стол жира. Установлено, что адекватное питание энпитами играет существенную роль в повышении сопротивляемости организма за счет, в частности, продукции Т- и В-лимфоцитов; больные, питающиеся диетой с включением энпитов, не испытывают чувство голода, нс страдают дис-пептическими расстройствами (Ю. К. Сызран-цев, Ю. И. Травникова, 1983). Во время мсстно-пластической операции у таких больных нужно стремиться к особенно хорошей мобилизации перемещаемых тканей и сближению их без какого-либо натяжения; Ю И Вернадский Основы челюстно-лчцевой хирургии и хирургической стоматологии нельзя травмировать перемешаемые ткани (пинцетами, зажимами, крючками, салфетками и т п) Простое сближение краев изъяна после облучения и удаления опухоли применять не следует, так как при этом не происходит рассредоточения патологически измененных тканей. Подавляющее большинство изъянов и дефектов, возникающих в связи с хирургическим удалением опухоли, можно и нужно устранять одновременно, то есть сразу же после удаления опухоли. Например, по данным П. В Наумова, операция удаления опухоли была совмещена с восстановительной операцией у всех 236 больных, оперированных автором При этом у 180 человек применены местно-пластические операции, у 10 — филатовский стебель, у 31 — свободная пересадка кожи, у 13 — пересадка кожно-жировых лоскутов, у 2 человек — миопластика При удалении поверхностных опухолей кожи лица с большой площадью поражения возникающие изъяны П В. Наумов (1966) рекомендует замешать одномомснтно пересаживаемыми кожными лоскутами (расщепленными или во всю толщину) При более глубоких дефектах — кожно-жировыми лоскутами Если дефект невелик, желательно заместить его лоскутом кожи на ножке Для закрытия глубоких дефектов мягких тканей челюстно-лицевой области после онкологических операций в последние годы начинают применять кожно-мышечные лоскута с включением большой грудной мышцы как на стороне опухоли, так и на противоположной Кожно-мышечные лоскуты выкраиваются по островко-вому типу на сосудистой питающей ножке и по туннелю под мягкими тканями шеи перемещаются в область послеоперационного дефекта (А И. Неробесв, 1982, S. M Back и соавт., 1982, D F Hodkmson, 1982 и др.) Развивая идею Pichler (1923) и Н. Н Соколова (1939), Н. M. Александров и И П Голян (1966) разработали методику закрытия раны, остающейся на месте резецированной верхней челюсти, посредством тонкого кожного лоскута размером 15х5 см. Лоскут фиксируют кетгуто-выми швами по краям раны, прижимают матрацным швом (через толщу щеки) и йодоформ-ной марлей. В результате этого создаются благоприятные условия для последующего протезирования дефекта, образующегося на месте удаленной челюсти Н М Александров (1969).утверждает, что первичная пластика не влияет на частоту возникновения рецидивов злокачественных опухолей и не ограничивает применение лучевой и химиотерапии. Если предоперационная лучевая терапия увеличивает число послеоперационных осложнений, то проводимая после операции (начиная с 6-7-го дня) — не влияет на репара- тивные процессы По его данным, план первичной местной пластики должен учитывать пониженную жизнеспособность тканей, облученных или подвергшихся воздействию химиопрепара-тов, в частности, нужно брать более широкие у основания и менее длинные, чем обычно, лоскуты мягких тканей. После операции необходимо обеспечить хороший уход за больным, применять антибиотики и гипотермию, чтобы не допустить отторжения пересаженных тканей на лице При пластике местными тканями следует производить разрезы с учетом перекрытия полей облучения, в пределах которых жизнеспособность ткани более понижена, а после операции осуществлять тщательный уход за раной и активную противовоспалительную медикаментозную терапию, чтобы предупредить развитие присоединяющейся вторичной инфекции в зоне возможного некроза перемещенного лоскута. Присоединение вторичной инфекции, особенно синегнойной палочки, усиливает некротический распад тканей (И И Ермолаев, Н М Александров, 1978) Перспективным является свободная пересадка кожно-жировых трансплантатов с использованием успехов микрососудистой хирургической техники. При выборе места формирования лоскута, его размеров и формы учитывают положение основных подкожных сосудов, которые должны включаться в трансплантат. М М Соловьев (1976) для восстановления дна полости рта при радикальных операциях по поводу рака слизистой оболочки рта и языка использовал грудино-ключично-сосцевидную мышцу в том или ином варианте Это способствовало более раннему и совершенному восстановлению функции глотания, речи, обеспечивало лучший косметический результат, создавало благоприятные условия для проведения последующих костнопластических операций Некоторые авторы используют массивный дельто-пекторальный лоскут, описанный V Bakamjian (1964). А. И. Неробеев (1982) значительно усовершенствовал методику применения дельто-пекторального лоскута при обширных послеоперационных дефектах дна полости рта и подбородочного отдела нижней челюсти он выкраивает на передней поверхности шеи языкообразный лоскут (с основанием к подбородку) и использует его в дальнейшем для создания внутренней выстилки дна полости рта Для формирования подбородка и кожной выстилки дна рта использует дельто-пекторальный лоскут. Метод А. И. Неробеева значительно ускоряет и упрощает пластику дна рта, а косметический результат операции получается весьма хороший. Г. Лсвике (1978) рекомендует после электрохирургического иссечения опухолей на лице за- Часть VI Злокачественные новообразования челюстно-лицевои области крывать возникающие при этом дефекты либо ротационным лоскутом, либо лоскутом на широкой ножке Чтобы повысить жизнеспособность их, предлагает применять местную гипо-термию
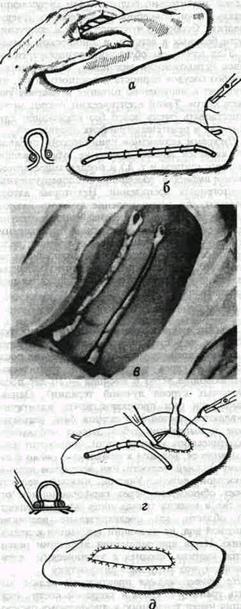
Рис. 134 Способ формирования широких и длинных стебельчатых лоскутов по Ю. И. Вернадскому (объяснения в тексте). Применение филатовского стебля для первичного замещения дефектов мягких тканей возможно лишь в случаях, когда опухоль добро качественная и не имеет тенденции к быстрому росту, а удаление ее можно отложить (на время формирования и миграции стебля к месту будущего дефекта) без ущерба для исхода операции. Чтобы снизить риск циркуляторных расстройств в филатовском стебле и в прилежащих к нему участках донорской почвы, предложен (Ю. И. Вернадский, ас №360936, 1972) и применяется специальный способ подготовки до морской почвы к формированию стебля за 7-8 дней до формирования стебля хирургом захва тывается максимально широкая складка кожи (рис 134 а) и прошивается (желательно под наркозом) у ее основания непрерывным П-образным швом из толстой капроновой нити (рис. 134 б). Чтобы предупредить прорезывание шва, по обе стороны кожной складки под стяжки шва укладывается резиновая дренажная трубка (рис 134 б) обернутая несколькими слоями марли Спустя 7-8 дней (в течение которых постепенно уменьшается тургор донорской кожи, а в самой складке кожи налаживается крово- и лимфообращение) производятся разрезы кожи по обеим сторонам кожной складки, чтобы отсечь ее от донорской почвы По мере отсечения складки на ее края и края донорской почвы немедленно накладываются швы (рис 134 г) При этом отсепаровка краев кожи на донорской почве совсем или почти совсем не нужна Благодаря последнему обстоятельству и немедленному наложению швов кровопотеря. а также расход времени на операцию сводятся до минимума, что имеет особое значение для ослабленных онкологических больных Метод имеет следующие преимущества: а) до операции формирования стебля хирург снижает тургор донорской кожи, что облегчает наложение швов и уменьшает угрозу последующего значительного натяжения в кожных швах как на донорском участке кожи, так и на самом стебле Филатова; б) еще до формирования стебля из кожной складки в ней в определенной степени налаживается крово- и лимфообращение через будущие ножки стебля, что снижает угрозу возможных впоследствии циркуляторных расстройств в будущем стебле, в) в процессе формирования стебля нет нужды в обширной и, следовательно, травматичной отсепаровке кожной ленты, а также в выкраивании дополнительных треугольных лоскутов у основания ножек стебля Все особенности операции обусловливают снижение степени травматичности хирургического вмешательства в целом, что имеет исключительно важное значение для онкологических больных. Ю И Вернадский Основы челюстно-лчцевой хирургии и хирургической стоматологии Недостатком описанного метода является только то, что линия швов на стебле находится напротив линии швов на донорской почве (рис 134 д). Поэтому, во избежание раздражения кожи усиками узловатых швов, мы подкладываем под стебель на 8-10 дней (до снятия швов) полоску из йодоформной марли. Первичную остеопластику нижней челюсти желательно производить только методом ауто-трансплантации и лишь при доброкачественных опухолях, а также при раковом поражении 1—11 стадии, когда нет еще метастазов, или они имеются, но пока еще единичные (в подчелюстной области, на шее), не инфильтрирующие окружающую ткань. Первичная костная пластика нижней челюсти создает благоприятные условия для быстрейшего восстановления функции жевания, речи и дыхания. Однако, при значительном распространении опухолевого процесса, требующего не только резекции челюсти, но и иссечения обширных участков прилежащих мягких тканей, а также при отсутствии уверенности в возможности полного удаления злокачественной опухоли, следует от первичной ос-теопластики воздержаться и ограничиться введением в дефект какого-либо имплантата до выяснения исхода. Минимальным сроком выжидания до одно-моментной костной пластики после облучения является период в 3 недели (по П. В Наумову) Мы в своей практике обычно после лучевой терапии выжидаем 4-5 недель. Имплантация металлических распорок, им-медиатпротезы и ксснопластика нижней челюсти могут быть использованы у лиц престарелого возраста или ослабленных онкологическим заболеванием. Таким образом, приступая к удалению опухоли, хирург должен тщательно продумать план непосредственных и отсроченных восстановительных операций, методикой которых сам обязан владеть. Одно лишь удаление опухоли не отвечает уровню развития современной челюстно-лицевой хирургии. ЛУЧЕВЫЕ НЕКРОЗЫ Общие сведения Частота лучевых нскрозов нижней челюсти достигает 3.6-37%. Лучевые остеомиелиты верхней челюсти Ю. И. Воробьев (1978) наблюдал у 13 из 18 больных, получивших курс лучевой терапии при суммарных очаговых дозах 35-60 Гр (продолжительность курса 3 недели). Возникли лучевые остеомиелиты в течение первого — второго года после окончания лучевой терапии. Могут они у некоторых больных возникать совсем рано после окончания облучения (через несколько недель) или более поздно — через 3 года и более. Патогенез Патогенез остеонекрозов челюстей объясняется (по В. А Петрову) следующим образом: содержащиеся в кости минеральные вещества обладают значительно большей, чем окружающие мягкие ткани, способностью поглощать лучевую энергию. Особенно чувствительны к облучению кости больных в детском и юношеском возрасте Под влиянием облучения возникает гиали-новое перерождение эндотелия, облитерация и тромбоз сосудов периоста и костного мозга, что приводит к нарушению питания и некрозу участков кости. Такой асептический некроз может существовать очень долго без каких-либо клинических и рентгенологических проявлений Пусковым механизмом клинического проявления является травма (удаление зуба, давление съемного протеза и т д) и последующее присоединение инфекции, обострение околоверхушечных одонтогенных воспалений Некоторые авторы полагают, что возникновение лучевого некроза челюсти к большинстве случаев вызывается нарушением методики облучения: превышение допустимой толерантной дозы облучения, недооценка сопутствующих местных или общих заболеваний (хронический периодонтит, абсцеди-рующая форма пародонтита, мигрирующая подкожная гранулема, диабет и др.). Клиника Лучевые некрозы одновременно мягких тканей лица, челюстей и скуловых костей делятся на острые (возникающие через 2-3 месяца после окончания курса облучения) и хронические (возникающие через 6 месяцев — 10 лет после повторных курсов лучевой терапии). Однако клинически они протекают почти идентично появляются постоянная острая боль, расшатывание и выпадение зубов; вокруг небольшого некротического участка кости происходит рассасывание ее, ведущее к появлению свища и перелому нижней челюсти или вскрытию верхнечелюстной пазухи. Участок нижней челюсти может обнажиться через перфорационное отверстие в мягких тканях лица или подчелюстной области, где предварительно возникает свищевой ход, не имеющий тенденции к заживлению. Из-за присоединения инфекции развивается картина, сходная с хроническим остеомиелитом, что затрудняет диагностику На рентгенограмме практически нельзя выявить границу некроза и здоровой кости: деструкция имеет тенденцию к диффузному распространению по кости; периостальная реакция отсутствует. Если есть секвестры, то это вовсе не говорит об ограничении и разрешении гнойно-некротического разрушения кости, т. к. спустя Часть VI. Злокачественные новообразования челюстно-дицевой области непродолжительное время появляются новые очаги некротической деструкции рядом с участками секвестрации. Дифференциальный диагноз Дифференциальный диагноз должен предусматривать отличие лучевого некроза от хронического остеомиелита на основании характерного для некроза анамнеза (факт облучения), объективной картины и торпидного клинического течения. Большие затруднения вызывает дифференциация лучевого некроза и рецидива опухоли. Для решения этих вопросов следует прибегать к консультации опытного рентгенолога. Лечение Лечение остеонекрозов — крайне трудное. Оно может быть хирургическим и консервативным. Хирургический состоит в том, что иссекают пораженные мягкие ткани, резецируют участки костной ткани. Дефект мягких тканей замещают местными тканями (лоскутами на ножке) или филатовским стеблем, а дефект кости — свободно пересаживаемыми костными трансплантатами. Рекомендуемое некоторыми авторами консервативное лечение (промывание свищей, кю-ретаж, применение анальгетиков, наркотиков, общеукрепляющей терапии и т. д.) приносит успех лишь при легких формах процесса, не сопровождающихся обнажением кости и патологическими переломами ее. В тяжелых случаях консервативная терапия должна быть направлена на повышение общей сопротивляемости организма больного и повышение локальной противовоспалительной резистентности, ускорение образования секвестров из нежизнеспособных участков кости и отторжения их. Для этих целей применять можно пентоксил, неробол, элеуте-рококк и т. п. В клинике ММСИ с успехом применяестя тирокальцитонин (ТКТ) в сочетании с анаболи-ческими стероидами, в частности — нероболи-лом. Основанием к такой комбинации являются данные литературы об усилении репаративных процессов в костной ткани и снижении проницаемости -клеточных мембран под влиянием ТКТ, а также активации синтетических процессов (в том числе создании костной матрицы) под воздействием анаболических стероидов, действием которых усиливается ТКТ. В этой клинике в первые 5 дней больные получают ТКТ по 50 ед MRC в сутки внутримышечно. С 6-го дня дозу снижают до 30 ед MRC, а с 14-го — до 15 ед MRC в сутки. Перед введением ТКА больные принимают внутрь 1.0 г глюконата кальция, на 6-ой день вместе с ТКТ больным вводят масляный раствор нероболила по 1.0 мл на инъекцию (2 раза в неделю). Эта комбинация (ТКТ + нероболил) вводится в течение 20 дней. Препараты применяют до и после операции в виде повторных курсов с перерывом между курсами 1-1 Уг мес- Если возникла необходимость в операции, ее проводят по типу некроэк-томии с внутриротовым подходом. Под влиянием такого комплексного лечения значительно улучшается общее состояние больных, уменьшаются или исчезают изнуряющие боли, значительно уменьшается выделение гноя из свищей, ускоряется образование секвестров, сокращается продолжительность пребывания больных в клинике — до 61.3 койко-дня (вместо 86.6 койко-дней у больных, леченных обычным консервативным методом). Остсорадионскрозы беззубых челюстей протекают благоприятнее и в большинстве случаев завершаются секвестрацией альвеолярного отростка с сохранением непрерывности тела челюсти; при наличии зубов в зоне радионекроза процесс протекает тяжелее, с отторжением больших участков тела кости. При анализе отдаленных (до 5 лет) результатов описанного комплексного лечения рецидивы болезни были выявлены лишь у 13% наблюдавшихся больных (П. Н. Лаптев, 1979). Выжидательно-консервативная тактика обусловливает смертность от лучевых нскрозов (без рецидивов опухолей) в 21.6% случаев (Marchetta и соавт., 1978), а резекция или экзартикуляция пораженной части нижней челюсти приводит к прекращению процесса и выздоровлению больных. После резекции некротического фрагмента нижней челюсти наиболее совершенным методом фиксации следует считать способы внутреннего остеосинтеза — гвозди, спицы, металлические или пластмассовые пластинки, применяемые в качестве временных иммедиат — протезов. Одна из сложностей лечения остеонекроза состоит в том, что рентгенографически бывает трудно установить границу здоровой и пораженной костной ткани, чем должен определяться размер нскрэктомии и длина трансплантата. В связи с этим рекомендуется выполнять остеотомию отступив на 2 см от видимой границы поражения кости.
|
|||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 670; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.012 с.) |