Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Подбор пары реципиент - донорСодержание книги
Поиск на нашем сайте Печень, как трансплантируемый орган, считается наиболее удобным с точки зрения тканевой совместимости. Это объясняется известной иммуноком-петентностью печени, в некоторой степени подавляющей иммунный ответ организма реципиента. Поэтому для подбора донорской печени конкретному реципиенту необходимым является лишь совпадение с донором по группе крови без учета совместимости по антигенам системы HLA. В педиатрической практике особое значение приобретает подбор органа по антропометрическим параметрам, что становится более трудным по мере уменьшения массы тела реципиента. В связи с крайним дефицитом трансплантатов малых размеров возникает необходимость использования различных модификаций печеночных трансплантатов. Хирургическая техника ортотопической трансплантации печени Ортотопическая трансплантация печени представляет собой весьма обширное многоэтапное хирургическое вмешательство, которое справедливо считается наиболее сложным в абдоминальной хирургии. Классическая методика ОТП с использованием печени трупного донора была разработана еще в 60-х годах T.Starzl и с тех пор не претерпела каких-либо принципиальных изменений. Она заключается в том, что пораженная печень реципиента, включая позадипеченочный отдел нижней полой вены, полностью удаляется и замещается целым донорским органом. Однако на протяжении уже более чем 30 лет методика ОТП подвергается различным модификациям для оптимизации решения конкретных технических задач, в частности в области педиатрической трансплантации. В 80-х годах именно дефицит донорских органов малых размеров обусловил почти 40% летальность потенциальных реципиентов-детей, состоявших в листе ожидания ОТП в США и странах Европы. Модификация операции, при которой большая донорская печень уменьшалась за счет удаления боковых сегментов для получения необходимого ребенку размера органа, резко уменьшила смертность детей в листе ожидания - с 15 до 5%. Проблема дефицита донорских органов обусловила развитие метода разделения донорской печени при ОТП, когда один донорский орган используется для двух реципиентов. Дальнейшие поиски решения проблемы дефицита донорских органов привели к использованию живых родственных доноров. Главным преимуществом данного способа является возможность планирования времени трансплантации с соответствующей предоперационной подготовкой больного, а также заведомо хорошее качество трансплантата. Существенным практическим вкладом в развитие родственной трансплантации явилась оригинальная методика использования правой доли печени живого донора, разработанная в РНЦХ РАМН и имеющая мировой приоритет. абдоминальная хирургия
1. Гепатэктомия (удаление собственной печени 2. Имплантация донорской печени (реваскуляри- 3. Реконструкция желчеотведения. является комбинация билатерального субкостального разреза с вертикальным разрезом в проекции белой линии до мечевидного отростка в модификации RCalne (рис. 1). Гепатэктомия - наиболее травматичный этап ОТП. Степень сложности гепатэктомии увеличивается с возрастом реципиента и длительностью существования болезни в связи с наступающими выраженными склеротическими изменениями тканей на фоне портальной гипертензии и хронического лимфостаза. Длительное существование портальной гипертензии приводит к развитию множественных забрюшинных коллатералей, что затрудняет хирургические манипуляции при мобилизации печени. Для выполнения гепатэктомии сначала выделяют общую и собственно печеночные артерии и производят их препарирование от верхнего края двенадцатиперстной кишки до бифуркации в воротах печени. При этом целесообразно выделить место отхождения желудочно-двенадцатиперстной артерии, которое затем удобно использовать для формирования артерио-артериального анастомоза при реваскуляризации трансплантата. Необходимо помнить о возможности наличия артериальной ветви от верхней брыжеечной артерии, которая обычно располагается позади гепатикохоледоха рядом с воротной веной. Эта артерия может оказаться более удобной для реваскуляризации будущего трансплантата и поэтому она также пересекается ближе к воротам печени. Гепатикохоледох выделяют из состава печеноч-но-двенадцатиперстной связки и пересекают его, а проксимальную культю его лигируют. Мобилизация гепатикохоледоха не предусматривает его ске-
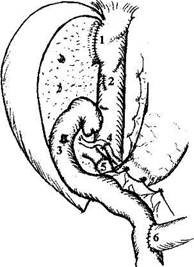
летизации, так как чрезмерная скелетизация гепатикохоледоха может привести к нарушению кровоснабжения его стенки. Уровень пересечения протока зависит от планируемого вида билиарной реконструкции. Пересечение гепатикохоледоха и его мобилизация создают благоприятные условия для дальнейшего препарирования печеночно-две-надцатиперстной связки, в частности ствола воротной вены. Результатом манипуляций на печеночно-двенад-цатиперстной связке является скелетирование как печеночной артерии на всем протяжении от двенадцатиперстной кишки до ворот печени, так и воротной вены, пересечение гепатикохоледоха и полное удаление клетчатки и лимфатических узлов. После рассечения круглой, серповидной, правой и левой треугольных связок печени выделяют переднюю поверхность поддиафрагмального отдела нижней полой вены. Рассечением париетальной брюшины по нижней поверхности правой доли печени начинается ретропеченочная мобилизация органа, при которой обнажается позадипеченоч-ный отдел нижней полой вены, который выделяют со всех сторон книзу до устьев почечных вен. При этом выполняется выделение, перевязка и пересечение вены (или вен) правого надпочечника. При гепатэктомии с сохранением нижней полой вены мобилизация последней также целесообразна для профилактики кровотечения из мелких ветвей в ее просвет. После полной мобилизации печени приступают к ее удалению. Долевые печеночные артерии перевязывают и пересекают, затем наложением сосудистого зажима прекращают кровоток по воротной вене, дистальный участок воротной вены перевязывают в воротах печени и пересекают. Нижнюю полую вену пережимают ниже и выше печени. Печень удаляют либо вместе с участком нижней полой вены, либо с сохранением последней. Сохранение позадипеченочного отдела нижней полой вены при гепатэктомии необходимо в тех случаях, когда в качестве трансплантата используется левая доля или левый латеральный сектор трупной печени, а также фрагмент печени от живого родственного донора. Уже в конце первого этапа начинается так называемый беспеченочный период. Этот период подразумевает выключение печени из кровообращения и прекращение кровотока по нижней полой вене. Он продолжается до момента реперфузии трансплантата портальной кровью в процессе имплантации. Общепринятой методикой для стабилизации состояния реципиента в беспеченочном периоде является проведение порто-бедренно-аксиллярного шунтирования, при котором забираемая отдельно из портального бассейна (2) и отдельно из бассейна нижней полой вены (1-3) кровь с помощью специального центрифужного насоса (5) принудительно вливается в систему верхней полой вены (4) через левую аксиллярную вену (рис.2). Однако проведение вено-венозного шунтирования у реципиентов с массой тела менее 20 кг весьма затруднено и в настоящее время не используется. С учетом накопления хирургического и анестезиологического опыта при ОТП, а также в связи с организационными, техническими и финансовыми проблемами, абдоминальная хирургия
Завершающим этапом гепатэктомии, выполняемой по любой методике, является контроль гемостаза и подготовка поддиафрагмалъной культи нижней полой вены реципиента для анастомоза с нижней полой веной трансплантата либо подготовка сохраненной нижней полой вены реципиента, заключающаяся в ушивании мелких отверстий в ее стенке после удаления печени. Имплантация донорской печени Результат ортотопической трансплантации печени в значительной степени зависит от того, насколько хирургу удастся воссоздать естественные условия, приемлемые для функционирования трансплантата в организме реципиента. В связи с этим методика имплантации варьирует в зависимости от разновидности используемого трансплантата. Такими разновидностями являются: 1) трупная печень (целая); 2) «уменьшенная» трупная печень; 3) анатомические доли или левый латеральный 4) анатомические доли или левый латеральный Методика имплантации целой трупной печени является основой для всех других модификаций. Трансплантат ортотопически располагают в брюшной полости. Первым накладывается верхний (поддиафрагмальный) анастомоз между культей нижней полой вены реципиента и донорским фрагментом того же сосуда. Он представляет наибольшие трудности в связи с ограничением возможности манипулирования и обзора в этой области. Затем накладывается нижний (подпеченоч-ный) кава-кавальный анастомоз. При этом восстанавливается непрерывность нижней полой вены. В случае использования вено-венозного шунтирования канюлю из воротной вены реципиента извлекают, и воротную вену пережимают сосудистым зажимом. Анастомоз между воротной веной реципиента и воротной веной трансплантата накладывается конец в конец с учетом возможного несовпадения диаметров этих сосудов, что корригируется различными вариантами сосудистого шва. Наложение трех описанных анастомозов обеспечивает возможность возобновления портального и кавального кровотоков. Анестезиологическая бригада должна быть заранее информирована о пуске портального кровотока через трансплантат, чтобы своевременно корригировать гемодинамические изменения и нарушения гомеостаза. Реперфузии трансплантата должно предшествовать внутривенное введение метилпреднизолона из расчета 20 мг/кг массы тела реципиента (но не более 1000 мг). Для реперфузии трансплантата первым снимают зажим с надпеченочного участка нижней полой вены, а затем с воротной вены. Последним снимается зажим с подпеченочного отдела нижней полой вены, что восстанавливает кавальный кровоток (рис.3). Методика венозной реконструкции при имплантации «уменьшенной» печени, равно как и правой доли от разделенной печени трупа и последовательность действий идентичны описанным выше. Рис. 2. Схема порто-бедренно-аксиллярного шунтирования в беспеченочном периоде. 1 - нижняя полая вена, 2 - канюля в воротной вене, 3 - канюля в левой подвздошной вене, 4 - канюля в левой подмышечной вене, 5 - центрифужный насос.
1 - верхний (поддиафрагмальный) кава-кавальный анастомоз, 2 - нижний (подпеченочный) кава-кавальный анастомоз, 3 - порто-портальный анастомоз, 4 - артериальная реконструкция с использованием общей печеночной артерии реципиента, 5 -билиарная реконструкция - холедохо-холедохоана-стомоз на Т-образном дренаже, 6 - ушитое ложе желчного пузыря.
абдоминальная хирургия
1 - сохраненный позадипеченочный отдел нижней
Рис. 5. Печеночно-кавальная реконструкция при имплантации левой доли печени. 1 - нижняя полая вена реципиента после гепатэк-томии: отверстие в передне-левой боковой стенке анастомозируется с устьем общего ствола левой и срединной печеночных вен трансплантата, 2 - устье общего ствола левой и срединной печеночных вен трансплантата, 3 - воротная вена трансплантата, 4 - артерия трансплантата, 5 - желчный проток трансплантата.
Венозная реконструкция при использовании в качестве трансплантата левой доли или левого латерального сектора трупной печени, а также анатомических долей и левого латерального сектора печени живого родственного донора имеет ряд особенностей. Во всех указанных случаях при гепатэк-томии у реципиента необходимо сохранить позадипеченочный отдел его нижней полой вены. В отличие от предыдущих видов донорской печени, трансплантаты данной группы не имеют собственного донорского участка нижней полой вены. Поэтому восстановление венозного оттока выполняется путем соединения печеночной вены трансплантата с нижней полой веной реципиента в виде печеночно-кавального анастомоза конец в бок или в виде печеночно-печеночного анастомоза конец в конец с культей одноименной печеночной вены реципиента. Основной задачей при этом является профилактика нарушения венозного оттока при возможных смещениях трансплантата в брюшной полости. В связи с этим предпочтительным является печеночно-кавальная реконструкция конец в бок (рис.5). В этой связи заслуживает внимания методика имплантации правой доли печени от живого родственного донора, разработанная и применяемая в РНЦХ РАМН с 1997 г. Суть методики - в со- здании как можно более широкого печеночно-кавального анастомоза, что достигается искусственным расширением устьев правых печеночных вен трансплантата и реципиента (рис.6). Особенностью портальной реконструкции при использовании указанных трансплантатов является то, что порто-портальный анастомоз накладывают между стволом воротной вены реципиента и воротной веной трансплантата, которая является долевой (правой или левой) ветвью воротной вены донора. Возможности артериальной реконструкции, то есть воссоздания артериального притока к трансплантату также зависят от вида используемого трансплантата. Так, все виды трупных трансплантатов, кроме левой доли и левого латерального сектора, при соблюдении правил изъятия донорской печени располагают неограниченной длиной артериального сосуда вплоть до фрагмента аорты. В то же время родственные трансплантаты и левые фрагменты трупной печени, как правило, имеют только долевую артерию, длина которой не превышает 3—4 см. Артериальная реконструкция, чаще всего, выполняется путем анастомозирования общей или собственно печеночной артерий трансплантата конец в конец с общей печеночной артерией реципиента в месте отхождения желудочно-двенадцатиперст-ной артерии. Существует множество других, более сложных вариантов в зависимости от анатомических особенностей (рис.7). Артериальную реваску-ляризацию трансплантатов у совсем маленьких детей можно выполнять непосредственно от аорты, используя либо трупный донорский сосуд, включающий участок аорты, либо артериальную или венозную донорскую вставку. Анастомоз с аортой реципиента в таких случаях накладывается либо выше отхождения чревного ствола, либо ниже почечных артерий. Однако за последние 10 лет методика абдоминальная хирургия
1 - нижняя полая вена реципиента после гепатэк-томии: искусственно сформированное отверстие в стенке нижней полой вены после иссечения устья правой печеночной вены, 2 - устье печеночной вены трансплантата увеличено за счет рассечения боковой стенки сосуда вдистальном направлении, 3 - воротная вена трансплантата, 4 - артерия трансплантата, 5 - желчный проток трансплантата. Рис. 7. Вариант артериальной реконструкции при имплантации трупной печени. Слева - анатомический вариант артериального кровоснабжения печени донора. Справа - артериальная реконструкция в организме реципиента. 1 - правая печеночная артерия трансплантата (ветвь верхней брыжеечной артерии), 2 - собственно печеночная артерия трансплантата (из системы чревного ствола), 3 - верхняя брыжеечная артерия, 4 - собственно печеночная артерия реципиента, 5 - чревный ствол и его ветви, 6 - двенадцатиперстная кишка реципиента.
Выбор способа билиарной реконструкции зависит от конкретных обстоятельств, складывающихся в результате имплантации донорской печени, в частности от характеристик желчного протока (или протоков) конкретного трансплантата и реципиента. Наиболее физиологичным считается восстановление непрерывности гепатикохоледоха путем анастомозирования донорского и собственного фрагментов протока конец в конец (см. рис.3)- Такой билиобилиарный анастомоз принято формировать на каркасном Т-образном дренаже, который одновременно служит для декомпрессии. Причинами отказа от такой реконструкции могут явиться несовпадение диаметров протоков, чрезмерное натяжение, а также сомнения в адекватности кровоснабжения стенок протоков как у донора, так и у реципиента. Кроме того, при исходном заболевании печени, связанном с болезнью протоков, например при первичном склерозирующем холангите, показания к использованию дисталь-ной культи холедоха реципиента весьма противоречивы. Таким образом, при наличии сомнений в адекватности желчных протоков донора и/или реципиента для наложения билиобилиарного соустья методом выбора становится билиодигестив-ный анастомоз, т.е. холедохо(гепатико)еюносто-мия с петлей кишки, выключенной по Roux. Реконструкция желчеотведения при использовании родственных трансплантатов или левосторонних фрагментов трупной печени связана с дополнительными трудностями, так как эти трансплантаты, как правило, не имеют каких-либо значимых по длине отрезков желчных протоков вне паренхимы трансплантата. Устья таких протоков зияют на поверхности среза паренхимы (рис.8). Их число варьирует от 1 до 4. Это требует наложения соответствующего числа билиодигестивных анастомозов, что предусматривает использование весьма прецизионной хирургической техники при оптическом увеличении (рис.9). Посттрансплантационный период Под посттрансплантационным периодом следует понимать жизнь реципиента с функционирующим трансплантированным органом (в данном случае - донорская печень) независимо от ее продолжительности. Нормальное течение этого периода у взрослого реципиента подразумевает выздоровление от болезни печени и ее осложнений, физическую и социальную реабилитацию, а у детей посттрансплантационный период должен гарантировать ряд дополнительных условий, таких как физический рост, интеллектуальное развитие и половое созревание. Реакция отторжения и иммуноподавляющее лечение Неотъемлемой частью течения посттрансплантационного периода является реакция отторжения. Определяющую роль в том, как будет протекать посттрансплантационный период, играет медикаментозная иммуносупрессия. Главным принципом проведения медикаментозной иммуносу-прессии является использования минимально допустимых доз иммунодепрессантов, обеспечивающих удержание реакции клеточного отторжения трансплантата в пределах слабой степени. Основными видами протоколов иммуносупрессии при трансплантации печени являются 2-компонент-ный (кортикостероиды + циклоспорин А) и 3-ком-понентный {кортикостероиды, циклоспорин А и азатиоприн). £ 1994 г. в клинической практике ряда стран используется разработанный в Японии препарат FK- абдоминальная хирургия
1 - порто-портальный анастомоз, 2 - артерио-ар-териальный анастомоз, 3 - зияющее устье печеночного протока трансплантата перед наложением билиодигестивного анастомоза.
Рис. 9. Имплантация правой доли печени живого родственного донора закончена (схема): 1 - печеночно-кавальный анастомоз, 2 - ушитые дефекты в стенке нижней полой вены после гепа-тэктомии, 3 - проекция гепатико-еюноанастомоза, расположенного на задней стенке кишки, 4 - арте-рио-артериальный анастомоз, 5 - порто-портальный анастомоз, 6 - межкишечный анастомоз (по Roux).
506 (Такролимус), который является альтернативой циклоспорину А. Механизм действия FK-506 и циклоспорина А аналогичен, однако имеются некоторые отличия, которые позволяют в ряде случаев, заменив один препарат другим, добиваться более успешного подавления реакции отторжения. Несмотря на то что использование цитостатика азатиоприна в качестве третьего компонента им-муносупрессии вполне традиционно, опыт показывает, что при благоприятном течении посттрансплантационного периода использование 2-ком-понентного протокола предпочтительнее. При использовании трупного трансплантата уже с третьих суток имеется вероятность развития криза отторжения. Выход морфологической картины реакции отторжения за рамки слабой степени означает наличие криза отторжения, что требует назамедлительного повышения доз иммунодепрессантов и проведения серийного морфологического контроля эффективности лечения. Использование родственных трансплантатов значительно упрощает проведение медикаментозной иммуносупрессии. Это особенно заметно, когда донорами становятся ближайшие родственники реципиента: родители или сибсы. В таких случаях наблюдается совпадение донора и реципиента по трем или четырем антигенам HLA. Несмотря на то что при этом реакция отторжения, безусловно, присутствует, ее проявления настолько незначительны, что могут быть купированы меньшими дозами иммунодепрессантов. Вероятность возникновения криза отторжения родственного печеночного трансплантата весьма мала и может быть спровоцирована лишь самовольной отменой иммунодепрессантов. Занимаясь родственной трансплантацией печени с 1997 г. и прооперировав более 50 пациентов в возрасте от 3 до 55 лет, мы не наблюда- ли у них кризов отторжения при использовании 2-компонентного протокола иммуносупрессии. Кроме того, возможность поддержания низких концентраций циклоспорина и малых дозировок кор-тикостероидов у реципиентов родственных трансплантатов позволяет минимизировать побочные эффекты препаратов. Общеизвестно, что трансплантация органов предполагает проведение иммуноподавляющего лечения в течение всего периода существования донорского органа в организме реципиента. По сравнению с другими трансплантируемыми органами, такими как почка, поджелудочная железа, легкое, сердце и др., печень занимает особое положение: являясь иммунокомпетентным органом, она обладает толерантностью к иммунному ответу реципиента. Как показал более чем 30-летний опыт трансплантации, при правильном проведении иммуносупрессии средний срок выживания печеночного трансплантата значительно превышает таковой для других трансплантируемых органов. Около 70% реципиентов донорской печени демонстрируют десятилетнее выживание. Длительное взаимодействие печеночного трансплантата с организмом реципиента создает благоприятные условия для постепенного снижения доз иммунодепрессантов вплоть до отмены кортикосте-роидов, а затем, в ряде случаев, до полной отмены медикаментозной иммуносупрессии, что более реально для реципиентов родственных трансплантатов в связи с заведомо большей исходной тканевой совместимостью донора и реципиента.
|
||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 482; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.62 (0.015 с.) |

 Хирургическая операция ОТП состоит из трех основных этапов.
Хирургическая операция ОТП состоит из трех основных этапов. Рис. 1. Хирургический доступ для выполнения ортотопической трансплантации печени (модификация R.Calne).
Рис. 1. Хирургический доступ для выполнения ортотопической трансплантации печени (модификация R.Calne).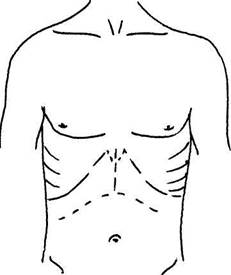





 присущими использованию вено-венозного шунтирования, в ряде трансплантационных центров наблюдается тенденция к постепенному отказу от его проведения не только у детей, но и у взрослых.
присущими использованию вено-венозного шунтирования, в ряде трансплантационных центров наблюдается тенденция к постепенному отказу от его проведения не только у детей, но и у взрослых.

 Рис. 3. Окончательный вид имплантированной трупной печени.
Рис. 3. Окончательный вид имплантированной трупной печени.
 239
239




 Рис. 4. Вариант имплантации трупной печени при сохранении нижней полой вены реципиента.
Рис. 4. Вариант имплантации трупной печени при сохранении нижней полой вены реципиента.


 Разновидностью методики кавальной реконструкции при использовании этих трех видов трансплантатов является наложение единственного кава-кавального анастомоза. Это бывает возможно в случаях, когда гепатэктомия у реципиента выполняется с сохранением позадипеченочного фрагмента нижней полой вены. Для осуществления методики надпеченочное отверстие нижней полой вены трансплантата анастомозируется с отверстием в передней стенке нижней полой вены реципиента, образованным при иссечении устьев печеночных вен. При этом дистальный отдел нижней полой вены трансплантата просто перевязывается (рис.4).
Разновидностью методики кавальной реконструкции при использовании этих трех видов трансплантатов является наложение единственного кава-кавального анастомоза. Это бывает возможно в случаях, когда гепатэктомия у реципиента выполняется с сохранением позадипеченочного фрагмента нижней полой вены. Для осуществления методики надпеченочное отверстие нижней полой вены трансплантата анастомозируется с отверстием в передней стенке нижней полой вены реципиента, образованным при иссечении устьев печеночных вен. При этом дистальный отдел нижней полой вены трансплантата просто перевязывается (рис.4).




 Рис. 6. Печеночно-кавальная реконструкция при имплантации правой доли печени от живого родственного донора по методике РНЦХ РАМН.
Рис. 6. Печеночно-кавальная реконструкция при имплантации правой доли печени от живого родственного донора по методике РНЦХ РАМН.


 артериальной реваскуляризации трансплантатов у маленьких детей возвращается к традиционному способу анастомозирования печеночных артерий донора и реципиента с помощью микрохирургической техники.
артериальной реваскуляризации трансплантатов у маленьких детей возвращается к традиционному способу анастомозирования печеночных артерий донора и реципиента с помощью микрохирургической техники.



 Рис. 8. Имплантация правой доли печени живого родственного донора (интраоперационная фотография). Сосудистая реконструкция закончена.
Рис. 8. Имплантация правой доли печени живого родственного донора (интраоперационная фотография). Сосудистая реконструкция закончена.