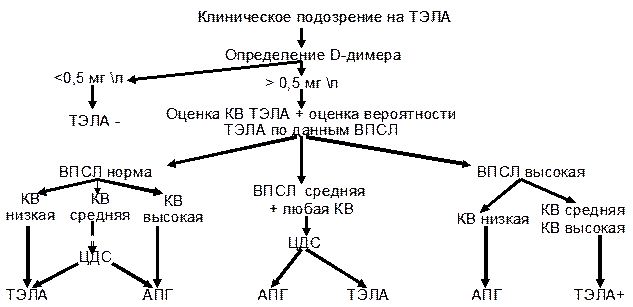Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Обследование больных с подозрением на немассивные тэлаСодержание книги
Поиск на нашем сайте
Для больных с подозрением на немассивные ТЭЛА наиболее рациональным подходом к диагностике является двухэтапный алгоритм обследования (рис. 7.1): – 1 этап: клиника, ЭКГ, рентгенография грудной клетки, определение D-димера. – 2 этап: вентиляционно-перфузионная сцинтиграфия легких, исследование вен нижних конечностей (цветное допплеровское сканирование, контрастная флебография, флебосцинтиграфия с Tc99m), ангиопульмография. ЭКГ при диагностике ТЭЛА. Не является информативным методом обследования, отсутствие изменений на ЭКГ не исключает диагноз ТЭЛА. При массивных ТЭЛА выявляются признаки перегрузки правых отделов сердца. Применяют с целью исключения инфаркта миокарда, сердечной недостаточности, перикардита. рентгенография при диагностике ТЭЛА. Как самостоятельный метод обследования больных с подозрением на ТЭЛА имеет существенные ограничения.Косвенные признаки: симптом Вестермарка, высокое стояние купола диафрагмы, острое легочное сердце, расширение корня легкого, плевральный выпот, дисковидные ателектазы, инфарктная пневмония. Применяют с целью исключения пневмонии, сердечной недостаточности, рака легкого, пневмоторакса, перикардита. Определение уровня D– димера при диагностике ТЭЛА. Является высокочувствительным, но неспецифическим методом диагностики венозных тромбозов, так как повышение D-димера отмечается при различных состояниях – после хирургических операций, кровотечений, травм, при онкологических заболеваниях, сепсисе. Используется в качестве скрининга при немассивных ТЭЛА. Норма- 0,5 мкг\мл. Рисунок 7.1. Алгоритм диагностики немассивной ТЭЛА
КВ – клиническая вероятность; ВПСЛ – вентиляционно-перфузионная сцинтиграфия легких; АПГ – ангиопульмонография; ЦДС – цветное доплеровское сканирование. Вентиляционно-перфузионная сцинтиграфия легких в диагностике ТЭЛА. При сегментарном отсутствии кровотока в легких и нормовентиляции в этом сегменте – вероятность ТЭЛА высока; при множественности перфузионных дефектов вероятность ТЭЛА средняя. При противоречии данных сканирования легкого и клиники - дальнейшая диагностика обязательна. При таком подходе к диагностике чувствительность метода составляет 91%, а специфичность- 80%.
Степень нарушения перфузии легких по данным сцинтиграфии определяется следующим образом: I степень (легкая) перфузионный дефицит до 29% II степень (средняя) -//- 30-44% III степень (тяжелая) -//- 45-59% IV степень (крайне тяжелая) -//- 60% и более. Ангиопульмонография при ТЭЛА. Метод, обладающий наиболее высокой чувствительностью (98%) и специфичностью (95-98%) при диагностике ТЭЛА и являющийся достаточно безопасным (риск летальных осложнений – около 0,1%, других осложнений – 1,5%). Вероятность диагноза составляет 100% при наличии внезапного обрыва ветви легочной артерии или визуализации тромба; диагноз вероятен при резком сужении ветви легочной артерии или медленном вымывании контраста. Показаниями к проведению ангиопульмонографии являются: – подозрение на массивное эмболическое поражение сосудов легких (среднее артериальное давление менее 90 мм. рт. ст. в течение часа, систолическое давление в легочной артерии более 60 мм. рт. ст., перфузионный дефицит более 30%); – сомнительный диагноз ТЭЛА после проведения неинвазивных методов исследования; – наличие рака легких или предшествующей ТЭЛА; – необходимость проведения дифференциального диагноза между истинным рецидивом ТЭЛА и дефрагментацией тромба. Эхокардиография в диагностике ТЭЛА. ЭхоКГ-исследование проводится для определения тактики лечения (решения вопроса о необходимости проведения тромболизиса); проведения диференциальной диагностики с инфарктом миокарда, инфекционным эндокардитом, расслаивающейся аневризмой, дилятационной кардиомиопатией, тампонадой сердца и другими. ЭхоКГ- признаки ТЭЛА: расширение и гипокинез правого желудочка, изменение отношения объемов правого и левого желудочка (обусловленное выбуханием межжелудочковой перегородки в левый желудочек), расширение проксимальной части легочной артерии, увеличение скорости трикуспидальной регургитации, нарушение спектральных характеристик потока в выходном тракте правого желудочка, расширение нижней полой вены и ее коллабирование на входе менее чем на 50%. Дополнительные методы в диагностике ТЭЛА. Чреспищеводная ЭхоКГ - проводится для исключения локализации источника ТЭЛА в предсердиях; прежде всего, метод показан при мерцательной аритмии и дилатации предсердий.
Спиральная компьютерная томография с контрастированием информативна и экономически оправдана при выявлении поражения долевых и сегментарных артерий. План обследования при подозрении на массивные ТЭЛА Начинают с ЭхоКГ (проводится дифференциальная диагностика между кардиогенным шоком, расслаивающейся аневризмой аорты и тампонадой сердца). Выявление признаков острой правожелудочковой недостаточности и косвенных признаков ТЭЛА может служить поводом к началу тромболитической терапии без проведения дополнительных инструментальных методов обследования. При отсутствии признаков острой правожелудочковой недостаточности проводят дополнительные исследования (рис. 7.2). При стабильном состоянии пациента - вентиляционно-перфузионную сцинтиграфию или компьютерную томографию с контрастированием; при нестабильной гемодинамике – ангиопульмографию. Лечение ТЭЛА Антитромботическая терапия при ТЭЛА является высокоэффективным методом лечения, позволяющим снизить летальность с 30% до 2-8% (уровень доказательств – I). Стандартом антитромботической терапии является назначение гепарина (НФГ или НМГ) и оральных антикоагулянтов или длительной монотерапии НМГ при условии стабильного состояния пациента. Нестабильные больные требуют немедленного проведения тромболитической терапии (уровень доказательств – I). Гепаринотерапия должна быть начата немедленно, как только заподозрен диагноз ТЭЛА у всех больных с высокой и средней клинической вероятностью немассивной ТЭЛА. У больных с низкой клинической вероятностью немассивной ТЭЛА необходимо сначала подтвердить диагноз объективными методами обследования и только после этого начинать гепаринотерапию. Рисунок 7.2. Алгоритм диагностики массивных ТЭЛА
КВ – клиническая вероятность; ОПН – острая правожелудочковая недостаточность; ВПСЛ – вентиляционно-перфузионная сцинтиграфия легких; АПГ – ангиопульмонография; ЦДС – цветное доплеровское сканирование. Схема использования НФГ при ТЭЛА (уровень доказательств – I) Ø Стандарт гепаринотерапии: первоначальная доза 5000 ед в\в болюсом с последующей в\в инфузией 1680 ед\час. Ø Подбор адекватной дозы НФГ осуществляется с помощью определения активированного частичного тромбопластинового времени (АЧТВ), которое должно быть в 1,5-2,5 выше нормы, что соответствует концентрации гепарина в плазме 0,2-0,4 ед\мл; первое определение АЧТВ через 4-6 часов после начала терапии. Ø При исключениях (пациенты после хирургических вмешательств в течение 2-х недель, с кровотечением из ЖКТ и мочевыводящих путей, тромбоцитопенией (менее 150 тыс\мкл), с повышенным риском кровотечения) терапия НФГ проводится по схеме 1250 ед\час. Схема использования НМГ при ТЭЛА (уровень доказательств – I) Ø Эноксапарин – 1 мг\кг (100 ед\кг) через 12 часов подкожно; Ø Надропарин – 86 ед\кг болюс, затем 86 ед\кг через 12 часов подкожно; Ø Дальтепарин – 120 ед\кг через 12 часов подкожно. Продолжительность гепаринотерапии при венозных тромбоэмболиях составляет около 5 дней при одновременном назначении с гепарином оральных антикоагулянтов (ОАК). Отмена гепарина возможна после подбора адекватной дозы ОАК (достижения МНО в терапевтическом диапазоне на протяжении двух последовательных дней). Более длительные периоды начальной терапии гепарином могут рассматриваться в случае массивной ТЭЛА.
Показания к тромболитикам при ТЭЛА (уровень доказательств – I) Ø Массивная ТЭЛА с явлениями артериальной гипотонии (систолическое давление менее 90 мм.рт.ст. или снижение АД на 40 мм.рт.ст. более 15 минут, не вызванное вновь возникшими нарушениями ритма сердца, гиповолемией или сепсисом) или шока. Ø Наличие перфузионного дефицита, по данным сцинтиграфии, более 30% или повышение систолического давления в легочной артерии более 60 мм.рт.ст. – дополнительные аргументы в пользу проведения тромболитической терапии. Ø При субмассивной ТЭЛА, сопровождающейся явлениями острой правожелудочковой недостаточности нет четких показаний к тромболизису, выбор индивидуален. Тромболитическая терапия при ТЭЛА показана с целью максимально быстрого восстановления окклюзированной легочной артерии, уменьшения легочной гипертензии и постнагрузки на правый желудочек. Убедительных данных о влиянии тромболитической терапии на прогноз жизни больных с ТЭЛА нет. Проведение тромболитической терапии сопряжено с высоким риском кровотечений. При развитии массивных ТЭЛА и наличии абсолютных противопоказаний тромболитическая терапия не проводится. Она также не проводится пациентам с массивными или субмассивными ТЭЛА, если они имеют гемодинамические нарушения, обусловленные сопутствующими заболеваниями сердца и легких. Схема применения тромболитической терапии при ТЭЛА представлена в табл. 7.1. Таблица 7.1. Схема тромболитической терапии при ТЭЛА (уровень доказательств – I)
Эмболэктомия при ТЭЛА Эмболэктомия при ТЭЛА в настоящее время занимает ограниченное место, так как отсутствуют данные об эффективности этой стратегии. Основной целью операции является предотвращение летального исхода от развития острого легочного сердца и обструкции кровотока через легкие. Операция связана с высоким риском летального исхода – 20-50%. Показаниями к проведению хирургической эмболэктомии в настоящее время считаются (уровень доказательств – III): Ø развитие острой массивной ТЭЛА; Ø наличие противопоказаний к тромболитической терапии; Ø неэффективность уже проведенной тромболитической терапии. Перед проведением эмболэктомии необходимо диагностическое обследование, достоверно подтверждающее диагноз и локализацию тромбов в стволе легочной артерии или ее главных ветвях. Это требование связано с высоким риском операции и необходимостью исключения диагностической ошибки.
Постановка кава-фильтра Данные рандомизированных исследований показывают, что постановка постоянных кава-фильтров у пациентов с проксимальным ТГВ и высоким риском венозной тромбоэмболии приводит к снижению частоты ТЭЛА в раннем периоде и увеличению рецидивов ТГВ в отдаленном периоде, без любого различия в частоте смертности (уровень доказательств – I). Такие результаты определили ограниченное место постоянным кава-фильтрам в лечении больных с венозными тромбозами: Ø эпизод венозной тромбэмболии при наличии абсолютных противопоказаний к терапии антитромботическими препаратами; Ø рецидив тромбоэмболии на фоне адекватной антикоагулянтной терапии. Целесообразность постановки постоянных кава-фильтров после легочной эмболэктомии пациентам с высоким риском тромбоэмболии и высокой вероятностью летального исхода не оправдана (уровень доказательств – I). При постановке кава-фильтра и отсутствии противопоказаний к проведению антикоагулянтной терапии назначаются ОАК на длительное время при поддержании МНО в диапазоне 2,0-3,0. Прогноз Летальный исход от ТЭЛА при отсутствии лечения – около 30%, а при рано начатой терапии антикоагулянтами – 2-8%. Ранее адекватное проведение антикоагулянтной терапии имеет первостепенное значение не только в связи со снижением смертности, но и в связи с возможностью предотвращения развития вторичной легочной гипертензии (примерно 1% больных с ТЭЛА). Список литературы 1. Кириенко И., Матюшенко А.А., Андрияшкин В.В. и др. Тромбоэмболия легочных артерий: диагностика, лечение и профилактика. Сonsilium medicum 2001; 3 (6): 224-228. 2. Котельников М.В. Ведение больных с венозными тромбоэболиями. М:»Боргез»; 2006. 3. Яковлев В.Б. Тромбоэмболия легочной артерии. Диагностика, лечение, профилактика. Рус. мед. журнал 1998; 6 (16): 1036-1047. 4. Beall A.C. Pulmonary embolectomy. Ann. Thorac. Surg. 1991; 51: 179. 5. Buller H.R., Agnelli G., Hull R.D. et al. Antithrombotic therapy for venous thromboembolic disease. The Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest. 2004; 126: 401-428. 6. Decousus H. A clinical trial of vena caval filters in the prevention of pulmonary embolism in patients with proximal deep-vein thrombosis. N. Engl. J. Med. 1998; 338: 409-416. 7. Geerts W.H., Pineo G.F., Heit J.A. et al. Prevention of venous thromboembolism. The Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest. 2004; 126: 338-400. 8. Guidelines on diagnosis and management of acute pulmonary embolism. Task Force Report. European Society of Cardiology. Europ. Heart J. 2000; 21: 1301-1336. 9. Guidelines or Antithrombotic Therapy for Prevention and Treatment of Thrombosis. The Sixth (2000) ACCP. Chest 2001; 119: 1-370. 10. Hedlund P.O. Postoperative venous thrombosis in benign prostatic disease: a study of 316 patients, using the 125 fibrinogen uptake test. Scand. J. Urol. Nephrol. Suppl. 1975; 27: 1-100. 11. Hyers T.M., Agnelli G., Hull R.D. et al. Antithrombotic therapy for venous thromboembolic disease. Chest. 2001; 119: 176. 12. Kakkar V.V., Howe C.T., Flanc C. et al. Natural history of postopera-tive deep-vein thrombosis. Lancet 1969; 2: 230-233. 13. Kearon C. Natural history of venous thromboembolism. Circulation 2003; 107: 122-130. 14. Kearon C., Salzman E.W., Hirsh J. Epidemiology, pathogenesis, and natural history of venous thrombosis. In: Kearon C., ed. Hemostasis and Thrombosis: basic principles and clinical practice. Philadelphia: Lip-pincott Williams and Wilkins; 2001. 1153-1178.
15. Lohr J.M., Kerr T.M., Lutter K.S. et al. Lower extremity calf thrombosis: to treat or not to treat? J. Vasc. Surg. 1991; 14: 618-623. 16. Meyer G., Tamisier D., Sors H. et al. Pulmonary embolectomy: a 20 years experience at one center. Ann. Thorac. Surg. 1991; 51: 232-236. 17. Musset D., Parent F., Meyer G. et al. For the Evaluation du Scanner Spirale dans I Embolie Pulmonaire study groop. Lancet 2002; 360: 1914-1920. 18. Opinions Regarding the Diagnosis and Management of Venous Thromboembolic Disease. ACCP Consensus Statement. Chest. 1998; 113: 499-504. 19. Prevention of venous tromboembolism. International consensus statement (Guidelines According to Scientific Evidencee). Int. Angiol. 1997; 16: 3-28. 20. Pulmonary embolism. New Paradigms in Diagnosis and Therapy. Chest. 2001; 120:1556-1561. 21. Rodger M., Wells P.S. Diagnosis of Pulmonary Embolism. Thrombos. Res. 2001; 103: 225-238. 22. Solis M.M., Ranval T.J., Nix M.L. et al. Is anticoagulation indicated for asymptomatic postoperative calf vein thrombosis? J. Vasc. Surg. 1992; 16: 414-418. 23. Stein P.D., Hull R.D., Saltzman H.A., Pineo G. Strategy for diagnosis of patients with suspected acute pulmonary embolism. Chest. 1993; 103: 1553-1559. 24. The PIOPED Investigators. Value of the ventilationperfusion scan in acute pulmonary embolism. JAMA 1990; 263: 2753-2759. 25. The PISAPED Investigators. Value of perfusion lung scan in the diagnosis of pulmonary embolism: results of the prospective study of acute pulmonary embolism diagnosis. Amer. J. Respir. Crit. Care Med. 1996; 154: 1387-1393.
Глава VIII. Частные вопросы гемостазиологии
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-21; просмотров: 492; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.23.103.203 (0.012 с.) |