
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Выбор метода хирургического вмешательстваСодержание книги
Поиск на нашем сайте
Понятие адекватной реваскуляризации далеко не полностью определяется количеством шунтов и дистальных анастомозов. Целый ряд факторов влияет на результаты операций. Среди них важнейший - характер поражения коронарных артерий, включающий распространенность процесса, диаметр сосудов подлежащих шунтированию, степень их стенозирования и наличие состоятельного дис-тального русла, индивидуальные особенности коронарного кровоснабжения, сложившиеся в результате атеросклеротического поражения, а также свойства используемых сосудистых трансплантатов. В настоящее время выбор сосудов для шунтирования и ориентировочная локализация анастомозов в достаточной мере стандартизованы. Для ПНА оптимальным считается использование левой ВГА на ножке, типичное место анастомоза на уровне середины ПНА, дистальнее отхождения диагональных ветвей. В этом месте артерия, как правило, проходит субэпикардиально и не скрыта жировой тканью и мышечными перемычками. Часто подлежат шунтированию диагональные ветви. Как показали наши исследования, для указанного бассейна и аутовенозные, и аутоартериальные трансплантаты демонстрируют хорошие результаты проходимости, по крайней мере через год после вмешательства. Для правой коронарной артерии - лучшее место для анастомоза - несколько проксимальнее «креста» - области деления артерии на заднюю межжелудочковую и боковые ветви (ЗМЖВ). В случае поражения артерии в этой зоне обычно ограничиваются шунтированием ЗМЖВ в средней трети, или, в редких случаях, при доминировании правой коронарной артерии, когда последняя отдает мощную задне-боковую ветвь к левому желудочку, выполняют шунтирование обеих терминальных ветвей или эндартерэктомию из области «креста». По нашим данным, аутовенозные и аутоартериальные шунты к проксимальным отделам имеют хорошую проходимость через год после операции. Состоятельность шунтов к дисталь-ным отделам ПКА, а именно к задней межжелудочковой ветви, хуже для аутовенозных (75%) и ауто- сердечно-сосудистая хирургия
Применение операционных микроскопов, микрохирургической техники, использование ВГА на ножке и свободных трансплантатов из ВГА в качестве операций выбора, а также правой желудочно-сальниковой артерии и аутовенозных шунтов для выполнения полной реваскуляризации миокарда позволяют решить практически все технические вопросы и перейти в настоящее время к функцио- нально выгодной аутоартериальной реваскуляризации миокарда. Необходимо отметить, что левая внутренняя грудная артерия по-прежнему остается «золотым стандартом» хирургического лечения ИБС. Правая внутренняя грудная, лучевая и правая желудочно-сальниковая артерии также зарекомендовали себя надежными трансплантатами для прямой реваскуляризации миокарда. Однако повседневное их использование несколько ограничено такими факторами, как наличие сахарного диабета, ожирения, предполагаемого продленного ИВЛ (для правой ВГА), язвенной болезни желудка, предшествующих операций на верхнем этаже брюшной полости (для ПЖСА), наличие признаков атеросклероза или положительной пробы Аллена (для лучевой артерии). Не малую роль здесь играет и вынужденное удлинение оперативного вмешательства с применением нескольких аутоартерий. Таким образом, выбор следующих аутоартериальных трансплантатов после ЛВГА для множественного аутоартериального коронарного шунтирования целесообразно определять с учетом противопоказаний к их использованию в каждом конкретном случае. Литература 1. Демихов Д.П. Хирургическое лечение недостаточности коро 2. Колесов В.И. Прямые операции на венечных артериях сердца // 3. Beck C.S., Leighninger D.S. Operations for coronary artery disease. 4. Benetti F., Naselli G., Wood M., Geffner L Direct myocardial revascu- 5. Buffolo E., De Andrade G, Branco J. et al. Coronary artery bypass 6. Calafiore A., Di Giammarco G., Teodori G. et al. Left anterior descend 7. Carpentier A., Guermonprez J.L., Deloche A., Frechette C, DuBost С 8. Favoloro R.G. Saphenous vein autograft replacement of severe seg- 9. Schwartz D., Ribakove G., Grossi E. Single and multivessel port-access 10. Stanbrige R., Hadjinikolaou L Technical adjuncts in beating heart
сердечно-сосудистая хирургия Трансплантация сердца: настоящее и будущее В.И.Шумаков
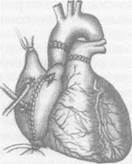
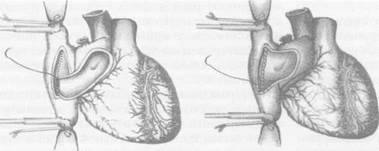
рошло уже более 35 лет после первой клинической трансплантации сердца (ТС) в мире. По данным международного регистра сердце и легкие» за 2001 г., за этот период времени выполнено около 58 000 ТС. Среди заболеваний, при которых выполняли ТС, ишемичес-кая болезнь сердца (ИБС) составила 44,3 %, дилата-ционная кардиомиопатия (ДКМП) - 43,7 %, приобретенные пороки сердца — 3,6 %, врожденные пороки сердца -1,5%, ретрансплантации сердца - 2% и другая патология - 4,9%. Выживаемость после ТС более 1 года составила 80%, 11,6 лет - 50%. При этом в 20% случаев длительность наблюдения достигла 15-17 лет. Максимальный срок наблюдения составил 23 года. Ежегодная летальность - 3-4%. С 1984 г. начато выполнение двухэтапных ТС, когда в отсутствие донорского органа у потенциального реципиента применяют либо механическую замену функции сердца (механический «мост»), либо интенсивную кардиотоническую терапию симпа-томиметическими препаратами (фармакологический «мост»). Использование медикаментозного или механического «моста» позволяет выполнить ТС вторым этапом у 62% больных, нуждающихся в немедленной ТС. Выживаемость более 1 года при таком варианте лечения составляет 70%. Первая успешная ТС в России выполнена 12 марта 1987 г. В.И.Шумаковым в НИИ трансплантологии и искусственных органов Минздрава РФ (НИИТиИО Минздрава РФ). Больная прожила с пересаженным сердцем 8,5 лет. С этого времени в России выполнено 128 ортотопических ТС (НИИТиИО Минздрава РФ - 100, Всероссийский научный центр хирургии - 25, Военно-медицинская академия им. С.М.Кирова - 3) и 2 пересадки комплекса сердце-легкие (НИ В клинике НИИТиИО Минздрава РФ 76 ТС были одноэтапными, 23 - двухэтапными и 1 - повторной через 4,5 года после первичной ТС. На основании обследования более 700 больных в конечной стадии застойной сердечной недостаточности, обусловленной ДКМП (70,2%) и ИБС (29,8%), установлено, что показанием к ТС является тяжелая застойная сердечная недостаточность III— IV функционального класса по шкале NYHA, рефрактерная к медикаментозной терапии. При определении показаний к ТС у больных ИБС (ишеми-ческая кардиомиопатия, постинфарктные аневризмы левого желудочка) учитывают общую и локальную сократимость левого и правого желудочков, размеры и объемы полостей сердца, наличие жизнеспособного миокарда в зоне пораженных коронарных артерий и возможность адекватного ремоделирования левого желудочка и реваскуля-ризации стенозированных коронарных артерий. К абсолютным противопоказаниям к ТС относят фиксированную легочную гипертензию с транс-пульмональным градиентом > 15 мм рт.ст. и легоч- ным сосудистым сопротивлением > 5 единиц Вуда, резистентную к фармакологическим пробам (нит-ропруссид натрия, добутамин, оксид азота), а также полиорганную недостаточность, активные инфекционные процессы, некоторые системные болезни, алкоголизм и наркоманию. Все остальные заболевания, которые регрессируют при терапевтическом и хирургическом лечении, относят к временным (относительным) противопоказаниям к ТС. После определения показаний и противопоказаний в лист ожидания ТС включается не более 25% больных. Для объективного определения очередности выполнения трансплантаций больным, находящимся в листе ожидания, разработана рабочая классификация (United Network for Organ Sharing - UNOS), согласно которой состояние пациентов делят на три статуса. СТАТУС 1А - негликозидная инотропная или механическая поддержка (внутриаортальная баллонная контрпульсация, левожелудочковый, правоже-лудочковый или бивентрикулярный обход, искусственное сердце), продолжающаяся менее 30 дней без улучшения клинического и гемодинамическо-го состояния больного и сопровождающаяся различными осложнениями (тромбоэмболии, инфекции, нарушения в системе механической поддержки, длительная искусственная вентиляция легких, сочетанное применение нескольких негликозид-ных инотропных препаратов в дозах выше терапевтических). СТАТУС 1Б — механическая или медикаментозная поддержка более 30 дней без осложнений. СТАТУС 2 - все остальные пациенты, ожидающие ТС. Анализ состояния потенциальных реципиентов, ожидающих ТС, показал, что у 40% из них возникают тяжелые расстройства кровообращения: в 60% наблюдений - внезапная остановка сердца; в 12% -быстро прогрессирующая сердечная недостаточность с кардиогенным шоком; в 28% - медленно прогрессирующая сердечная недостаточность. У 48 больных до ТС использовали фармакологический «мост» с назначением негликозидных инотропных препаратов в терапевтических дозах (добутамин до 5 мкг/кг/мин или допамин до 3 мкг/кг/мин от 1 до 4 мес). Из них 33 (68,7%) пациента погибли, не дождавшись ТС. Пятнадцати (31,3%) больным выполнили ТС. Выписано после ТС 78,8% больных. Выживаемость более 1 года составила 72,7%. Сроки наблюдения к настоящему моменту от 3 до 6 лет. У 31 больного использовали механический «мост» - вспомогательное кровообращение или полную замену сердца (имплантация искусственного сердца). Показания к механическому «мосту» в настоящее время четко объективизированы: прогрессирующая сердечная недостаточность (систолическое артериальное давление менее 90 мм сердечно-сосудистая хирургия рт.ст., сердечный индекс менее 2 л/мин/м, давление в левом предсердии более 25 мм рт.ст.), рефрактерная к максимальной инотропной поддержке (добутамин до 30 мкг/кг/мин, допамин до 10 мкг/кг/мин, адреналин до 500 нг/кг/мин). При решении вопроса о начале механического «моста» должны быть исключены абсолютные противопоказания к выполнению последующей ТС (необратимая полиорганная недостаточность, инфекционные осложнения). На первом этапе до ТС в 2 наблюдениях использовали внутриаортальную баллонную контрпульсацию, в 16 - обход левого желудочка центробежным насосом «БИОПАМП», в 6 — бивентрикуляр-ный обход сердца и в 7 - имплантацию искусственного сердца «ПОИСК ЮМ». Двухэтапные ТС выполнили 10 больным: 1 реципиенту после внутриаортальной баллонной контрпульсации в течение 5 сут, 8 больным - после обходов левого желудочка длительностью 1,5-5,5 сут и 1 - после имплантации искусственного сердца и его работы в течение 3,5 сут. В остальных наблюдениях диагностировали абсолютные противопоказания к ТС. В настоящее время сроки наблюдения реципиентов после двухэтапных ТС составляют до 60 мес. В 1995-2002 гг. у 50% реципиентов перед ТС использовали либо медикаментозный, либо механический «мост». В 57 наблюдениях забор донорского сердца выполняли в клинике института, в 43 — трансплантат забирали дистанционно. У 65% доноров выполняли мультиорганный забор (сердце, печень, почки). Для защиты трансплантата при заборе донорского сердца непосредственно в клинике использовали кристаллоидную кардиоплегию. Длительность ишемии трансплантата не превышала 80 мин. При дистанционном заборе применяли консервирующий раствор внутриклеточного действия кустади-ола. Длительность ишемии трансплантата в большинстве наблюдений не превышала 3,5 ч. Однако в 3 случаях длительность ишемии достигала от 4 ч 30 мин до 5 ч 45 мин. Все трое реципиентов выписаны из клиники. Настоящие наблюдения являются доказательством того, что донорское сердце может переносить ишемию до 6 ч. При 77 ТС использовали классическую атриаль-ную хирургическую технику; при 6 - кава-каваль-ную методику и при 17 - модификацию кава-ка-вальной методики ТС, предложенную В.И.Шумаковым. Модифицированную кава-кавальную ТС выполняли следующим образом (рис. 1). После удаления сердца реципиента по классической методике и стенки левого предсердия так, чтобы оставалась только площадка, в которую впадают левые и правые легочные вены, создавали узкий «мостик» между полыми венами реципиента. Для этого расслаивали предсердия по межпредсердной перегородке, как это выполняют при доступе к митральному клапану слева. Глубину этого расслоения доводили до овального окна межпредсердной перегородки. Затем изнутри рассекали на этом уровне заднюю стенку правого предсердия. После окончания анастомоза между левыми предсердиями донора и реципиента анастомозировали края разреза нижней полой вены донора с краями разреза «мостика» между полыми венами реципиента. В кон- це операции накладывали анастомозы между аортами и легочными артериями донора и реципиента. В настоящее время мы упростили технику операции, устранив этап формирования «мостика» между полыми венами реципиента. Для этого сшиваем латеральный край разреза нижней полой вены донора с задней стенкой правого предсердия реципиента анастомозом конец в бок латеральнее его овальной ямки, по той же линии, где производили разрез в первоначальном варианте. Противоположный край разреза нижней полой вены сшиваем с краем правого предсердия реципиента, после удаления излишков его тканей. Отказ от формирования «мостика» между полыми венами реципиент позволил упростить операцию и ускорить время ее выполнения. При выполнении пересадки сердца по данной методике отпадает необходимость создания отдельных циркулярных анастомозов между нижними и верхними полыми венами донора и реципиента. Частота дисфункции синусового узла, трикус-пидальной регургитации при данной методике достоверно не отличается от результатов при кава-ка-вальной методике ТС. Месячная летальность после ТС составила 31,6%. Основными причинами ее являлись нарушения насосной функции трансплантата (тотальная или правожелудочковая недостаточность) и инфекционные осложнения. Использование с 1996 г. ингаляционного оксида азота позволило полностью исключить летальность от правожелудочковой недостаточности, а применение нового поколения антибактериальных и противовирусных препаратов — значительно снизить частоту инфекционных осложнений. Посттрансплантационная иммуносупрессивная терапия включает циклоспорин А, азатиоприн и метилпреднизолон. С 1998 г. начато использование новой схемы трехкомпонентной терапии - циклоспорин А, метилпреднизолон и селл-септ. При использовании циклоспорина А нередко отмечается артериальная гипертензия, нефро- и ге-патоксичность. Сочетание с кетоканозолом (низо-рал) позволило снизить дозу принимаемого циклоспорина А на 70%, что в 90% случаев предупреждает его нефро- и гепатотоксический эффект, не снижая при этом концентрацию иммуносупрессо-ра в крови. После ТС с целью диагностики острого отторжения трансплантата необходимо выполнение эндо-миокардиальной биопсии. В первый месяц после ТС - еженедельно, во второй месяц - один раз в две недели, далее в течение первых двух лет - один раз в 2-3 мес. С третьего года - один раз в полгода. Всего после ТС в НИИТиИО Минздрава РФ выполнено 1096 биопсий. Только в 6% наблюдений при этом выявили умеренное или тяжелое острое отторжение. Стероидо-резистентное (персистирующее) клеточное острое отторжение наблюдали у 2 больных. Положительный эффект был достигнут в результате лечения антитимоцитарным глобулином име-тотрексатом. При гуморальном (сосудистом) отторжении с нарушением функции трансплантата, диагностированном у 2 реципиентов, лечебный эффект обеспечило сочетание гормональной пульс-терапии с 5-7 сеансами плазмафереза.
а. Рассечение и разделение межпредсердной перегородки на уровне межпредсердной борозды. б. Формирование «мостика» из задней стенки правого предсердия реципиента. в. Анастомоз между медиальным краем донорского сердца и медиальным краем сформированного г. Анастомоз «конец в бок» между медиальным краем донорского предсердия и задней стенкой правого д. Анастомоз между латеральйым краем донорского сердца и латеральным краем сформированного е. Вид сердца после окончания подшивания трансплантата.
д
Степень недостаточности кровообращения в течение первого и последующих годов наблюдения после ТС у 86% пациентов соответствует 0-1 функциональному классу NYHA. Снижение толерантности к физической нагрузке, соответствующее II—III функциональному классу NYHA, отмечали только у больных с посттранспланционным поражением коронарных артерий При анализе особенностей восстановления функции синусового узла трансплантированного сердца выделено пять вариантов его функционирования: нормальную функцию синусового узла наблюдали у 71,7% пациентов, транзиторную дисфункцию синусового узла - у 14,3 %, персистирую-щую - у 5,4 %, полное отсутствие функции - у 8,6%. У 71,7% больных восстановился синусовый ритм с частотой сокращений более 90 в минуту. Частота сокращений пересаженного денервированного сердца превышала частоту сокращений иннерви- рованного органа в среднем на 25%. Проблема дисфункции синусового узла после ТС по атриальной методике достаточно значима. Почти у 14% пациентов возникает необходимость в имплантации постоянного водителя ритма, либо в ближайшем, либо в отдаленном посттрансплантационном периоде. Развитие дисфункции синусового узла связано, вероятно, с травмированием его во время операции в процессе анастомозирования правого предсердия донорского сердца с остатком предсердия реципиента. При использовании кавальной и модифицированной методики ТС эта проблема практически не возникает. При анализе электрокардиограммы у 75% реципиентов выявили частичную и полную блокаду правой ножки пучка Гиса. Причины ее развития остаются пока неясными. Наблюдаемые желудочковые и наджелудочковые нарушения ритма легко поддавались терапии и не влияли на прогноз после ТС. Мониторинг гемодинамики пересаженного сердца в постреанимационном (госпитальный) и отдаленном (постгоспитальный) периоде в покое при синусовом ритме и отсутствии острого отторжения трансплантата показал, что денервация сердечно-сосудистая хирургия
трансплантированного сердца оказывает незначительный эффект на гемодинамические показатели донорского сердца в покое. После периода гемоди-намической нестабильности в непосредственном посттрансплантационном периоде насосная функция сердца достигает нормальных или субнормальных значений уже через 2-3 нед после ТС. Венозную гипертензию легкой степени (до 15 мм рт.ст.) наблюдали у 15% реципиентов в течение первого года после ТС, умеренную (до 20 мм рт.ст.)- только в течение первых двух месяцев у 5 % больных и тяжелую (более 20 мм рт.ст.) только ин-траоперационно и в раннем посттрансплантационном периоде. Тяжелая венозная гипертензия была обратимой при использовании инотропных препаратов в сочетании с вазодилататорами либо при механической поддержке правого желудочка пересаженного сердца. Причинами развития венозной гипертензии являются трикуспидальная регургитация, предшествующая легочная гипертензия, гиперволемия, замедленная адаптация правого желудочка пересаженного сердца. В первый месяц после ТС артериальную гипертензию наблюдали у 62%. Посттрансплантационная артериальная гипертензия обусловлена вазо-констрикторным эффектом циклоспорина А, который, увеличивая продукцию тромбоксана, снижает уровень простациклина, одновременно активирует ренин-ангиотензиновую систему и повышает концентрацию норадреналина, а также ги-перволемией в результате применения стероидных гормонов. Для предупреждения артериальной гипертензии, гиперфункции и гипертрофии пересаженного сердца необходимы контроль концентрации циклоспорина А и индивидуальный подбор гипотензивных препаратов. Лучшие результаты получены от использования антагонистов кальция (нифеди-пин и др.) или ингибиторов ангиотензин-превра-щающего фермента (каптоприл, эналаприл и др.). Результаты нагрузочных тестов показали, что де-нервированный трансплантат способен адаптироваться к нагрузке и обеспечивает адекватный кровоток в организме. Однако в отличие от иннерви-рованного сердца денервированное сердце увеличивает минутный объем кровообращения прежде всего за счет прироста ударного объема на фоне увеличение венозного возврата с вторичным повышением частоты сокращений. Длительное выживание после ТС лимитировано болезнью коронарных артерий пересаженного сердца (основная причина), инфекционными осложнениями и острым отторжением трансплантата. С целью ранней диагностики болезни коронарных артерий у 46 реципиентов выполнили 116 рентгеноконтрастных коронароангиографий. Частота поражения коронарных артерий в сроки до 5 лет составила 15%, от 5 до 14 лет - 43,8%. По международной классификации выделяют 3 типа поражения коронарных артерий пересаженного сердца (рис. 2): тип А - дискретные или тубулярные стенозы; тип В - диффузные концентрические стенозы средних и дистальных отделов сосудов (подтип В j - резкое концентрическое сте-нозирование, подтип В2 - плавное концентричес- кое стенозирование) и тип С - дистальное поражение мелких ветвей. По нашим данным, в венечных сосудах первого порядка поражение типа А встречается в 69,4% наблюдений, типов В и С - в 12%; в артериях второго порядка, соответственно в 30,6% и 32%. Для артерий третьего порядка тип А не характерен, а поражение типов В и С выявляется в 56% наблюдений. Окклюзии венечных сосудов обнаруживают в 19,7% случаев от всех поражений. Окклюзии в 50% наблюдений локализуются в проксимальных сегментах, в 18% - в средних и в 32% - в дистальных. Возможны 2 варианта клинического течения болезни коронарных артерий пересаженного сердца: быстро прогрессирующий (до 6 мес) наблюдают у 25% больных и медленно прогрессирующий (несколько лет) - у 75%. Первый вариант протекает с клиникой острой декомпенсации сердечной деятельности; второй -с постепенным нарастанием явлений сердечной недостаточности и ухудшением состояния реципиентов. Патогенез гиперплазии интимы сосудов при болезни коронарных артерий до конца не ясен. К факторам риска относят предтрансплантацион-ную ишемическую болезнь сердца, ранние (до 3 мес) острые кризы отторжения трансплантата, повышенное отложение иммуноглобулинов, С^-фракции комплемента и фибрина под сосудистым эндотелием (диагностируется в биопсийном материале), повышение содержания общего холестерина и триглицеридов в крови, нарушения гемостаза, цитомегаловирусную инфекцию, артериальную посттрансплантационную гипертензию, побочные эффекты стероидов. Для профилактики болезни коронарных артерий пересаженного сердца используют назначение дезагрегантов (препараты ацетилсалициловой кислоты), гиполипидемичес-кие, гипотензивные и противовирусные лекарственные средства. С целью ранней диагностики болезни коронарных артерий трансплантата необходимо ежегодное проведение коронароангиографических исследований. Показанием для проведения внеплановой ангиографии являются результаты радиоизотопных исследований и велоэргометрических нагрузочных проб.
Современной лечебной мерой является транслю-минальная баллонная коронароангиопластика. Несмотря на паллиативность данной процедуры, она позволяет восстановить коронарный кровоток и продлить нормальную функцию трансплантата. В НИИТиИО 8 больным с поражением коронарных артерий типа А выполнено 16 транслюминальных баллонных коронароангиопластик с постановкой стента в переднюю межжелудочковую артерию в двух случаях. К сожалению, часто возникает необходимость повторных вмешательств в связи с рес-тенозами коронарных артерий. У 4 реципиентов через 4-30 мес после выполнения первой процедуры выполнены повторные баллонные коронароан-гиопластики. В отдаленные сроки после ТС причиной летальности пациентов являются инфекционные вирусные гепатиты (В, С, сочетание В и С). Динамический анализ маркеров гепатита у непривитых реципиентов выявил прогрессирующее инфицирование гепатотропными вирусами: на первом г. число инфицированных составляет 22,3%, а к 10 годам - 80%. Одним из путей профилактики инфицирования вирусом гепатита В является плановая вакцинация реципиентов, стоящих в листе ожидания, которую выполняем с 1998 г. (вакцина Энджерикс В). Гибель больных от острого отторжения пересаженного сердца при несвоевременной диагностике и лечении возможна как в первый год, так и в отдаленные сроки после ТС. Увеличение продолжительности жизни пациентов с пересаженным сердцем выявило новую проблему - рост числа злокачественных новообразований в этой популяции больных. Онкологические заболевания диагностируют, как правило, у пациентов, живущих после ТС более 10 лет. Среди наших реципиентов базалиому кожи выявили в наблюдениях на 10-м и 12-м годах после ТС; периферическую аденокарциному легкого - в 1 случае на 11-м году после ТС; неоперабельный рак прямой кишки с метастазами в печень в 1 - через 12 лет после ТС. Важной проблемой является необходимость экс-тракардиальных хирургических операций в ближайшие и отдаленные сроки после ТС. У реципиентов выполняли различные внесердечные операции в условиях общей анестезии: ушивание прободной язвы желудка, панкреатотомию с дренированием общего желчного протока по поводу острого пан-кретатита, холецистэктомию, резекцию нижней доли левого легкого по поводу аденокарциномы с метастазами в лимфоузлы средостения, бифуркационное протезирование брюшной аорты, удаление варикозно расширенных вен нижних конечностей, имплантации искусственных хрусталиков глаза и др. У 2 пациенток с пересаженным сердцем в сроки от 8 до 24 нед выполняли прерывание беременности. Результаты хирургических вмеша- тельств у пациентов с пересаженным сердцем не отличаются от результатов в обычной популяции больных. Результаты первых 100 ТС в НИИТиИО Минздрава РФ вполне соответствуют международным данным. Для оказания своевременной и радикальной помощи пациентам с конечной стадией застойной сердечной недостаточности и обеспечения длительного выживания после ТС необходимо решение следующих проблем: 1. Дефицит донорских органов. 2. Создание имплантируемых систем для дли 3. Изучение патогенеза и разработка методов 4. Разработка эффективных мер профилактики 5. Внедрение новых более совершенных иммун- Литература 1. Шумаков В.И., Семеновский МЛ., Казаков Э.Н. и др. Транспланта 2. Шумаков В.И. Рациональные детали техники пересадки сердца. 3. Шумаков В.И., Казаков Э.Н., Семеновский и др. Хроническое от 4. Шумаков В.И., Казаков Э.Н., Кормер АЛ. и др. Гемодинамика ма 5. Шумаков В.И., Казаков Э.Н., Кормер А.Я. Терапия прогрессирую 6. Шумаков В.И., Казаков Э.Н., Кормер АД и др. Трансплантация 7. Шумаков В.И., Хубутия М.Ш., Селезнева Е.А. и др. Электрофизио 8. Шумаков В.И., Кормер АЯ., Казаков Э.Н., и др. Клиническая физи 9. Шумаков В.И. Модификация хирургической техники ортотопи 10. Шумаков В.И., Остроумов Е.Н., Кормер А.Я. и др. Общая и реги
|
||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 219; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.23.102.79 (0.017 с.) |

 артериальных (85%) шунтов. При этом различия в годичной проходимости между различными трансплантатами недостоверны. В отношении огибающей артерии и ее ветвей мнение опытных хирургов не всегда совпадают. Учитывая сообщения о худшей, по сравнению с другими артериями, проходимости шунтов к огибающей артерии (ОА) (61-67%, поданным Crosby и соавт., 1981), часть авторов рекомендует шунтировать только одну крупную ветвь тупого края и терминальную ветвь ОА, считая, что шунты к мелким ветвям ОА увеличивают риск операции и не улучшают отдаленные результаты. Другая часть призывает к восстановлению всех пораженных сосудов. В отношении выбора трансплантата для бассейна ОА также возможен различный подход, поскольку существуют сообщения о неудовлетворительных результатах реваску-ляризации бассейнов ОА и при некоторых вариантах аутоартериального шунтирования, включая множественное секвенциальное шунтирование или проведение ножки правой ВГА через поперечный синус перикарда. В качестве возможных причин неудовлетворительных результатов наиболее часто указываются неблагоприятные угловые смещения трансплантатов при секвенциальном шунтировании и малый диаметр реципиентных коронарных артерий. В этой связи логичным представляется предложение использовать в данной позиции аутовенозные шунты, чтобы сохранить ауто-артериальный пластический материал для возможных повторных операций по поводу рецидива стенокардии. Тем не менее в наших наблюдениях ре-васкуляризацию коронарных артерий заднедиаф-рагмальной зоны мы выполняли трансплантантами правой желудочно-сальниковой артерии на ножке и сложносоставными Y-образными конструкциями из обеих внутренних грудных артерий или с использованием лучевой артерии. Проведенное исследование показало преимущество указанных вариантов аутоартериального шунтирования задне-диафрагмальной области миокарда по сравнению с аутовенозным. Так, проходимость дис-тальных анастомозов к ОА через год после операции составила для аутовенозных шунтов 74%, для аутоартериальных трансплантатов 92%.
артериальных (85%) шунтов. При этом различия в годичной проходимости между различными трансплантатами недостоверны. В отношении огибающей артерии и ее ветвей мнение опытных хирургов не всегда совпадают. Учитывая сообщения о худшей, по сравнению с другими артериями, проходимости шунтов к огибающей артерии (ОА) (61-67%, поданным Crosby и соавт., 1981), часть авторов рекомендует шунтировать только одну крупную ветвь тупого края и терминальную ветвь ОА, считая, что шунты к мелким ветвям ОА увеличивают риск операции и не улучшают отдаленные результаты. Другая часть призывает к восстановлению всех пораженных сосудов. В отношении выбора трансплантата для бассейна ОА также возможен различный подход, поскольку существуют сообщения о неудовлетворительных результатах реваску-ляризации бассейнов ОА и при некоторых вариантах аутоартериального шунтирования, включая множественное секвенциальное шунтирование или проведение ножки правой ВГА через поперечный синус перикарда. В качестве возможных причин неудовлетворительных результатов наиболее часто указываются неблагоприятные угловые смещения трансплантатов при секвенциальном шунтировании и малый диаметр реципиентных коронарных артерий. В этой связи логичным представляется предложение использовать в данной позиции аутовенозные шунты, чтобы сохранить ауто-артериальный пластический материал для возможных повторных операций по поводу рецидива стенокардии. Тем не менее в наших наблюдениях ре-васкуляризацию коронарных артерий заднедиаф-рагмальной зоны мы выполняли трансплантантами правой желудочно-сальниковой артерии на ножке и сложносоставными Y-образными конструкциями из обеих внутренних грудных артерий или с использованием лучевой артерии. Проведенное исследование показало преимущество указанных вариантов аутоартериального шунтирования задне-диафрагмальной области миокарда по сравнению с аутовенозным. Так, проходимость дис-тальных анастомозов к ОА через год после операции составила для аутовенозных шунтов 74%, для аутоартериальных трансплантатов 92%. 33
33

 сердечно-сосудистая хирургия
сердечно-сосудистая хирургия Рис. 1. Методика трансплантации сердца академика В.И.Шумакова.
Рис. 1. Методика трансплантации сердца академика В.И.Шумакова.

 После ТС из клиники выписали 68 пациентов. Анализ отдаленных результатов ТС, выполненных более 10 лет назад, показал, что выживаемость более 1 года составила 84,6%, более 5 лет - 69,2% и более 10 лет - 23,9%. В настоящее время 8 реципиентов прожили более 10 лет.
После ТС из клиники выписали 68 пациентов. Анализ отдаленных результатов ТС, выполненных более 10 лет назад, показал, что выживаемость более 1 года составила 84,6%, более 5 лет - 69,2% и более 10 лет - 23,9%. В настоящее время 8 реципиентов прожили более 10 лет.


 38
38 сердечно-сосудистая хирургия
сердечно-сосудистая хирургия


