Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Диагностическое обследование. Рекомендовано начинать с медикоментозной терапии.. Рекомендуемая схема введенияСодержание книги
Поиск на нашем сайте
Диагностическое обследование - собрать анамнез, - осмотреть пациента, - измерить пульс и артериальное давление, - снять ЭКГ - подключить мониторное наблюдение АД И ЭКГ. - взять клинический, биохимический анализы крови, включающие тропонин и МВ КФК Рекомендовано начинать с медикоментозной терапии. Препаратами выбора являются аденозин (натрия аденозинтрифосфат, АТФ) или антагонисты кальциевых каналов негидропиридинового ряда. Аденозин ( аденозина фосфат ) в дозе 6-12мг (1-2 амп.2% р-ра) или натрия аденозинтрифосфат (АТФ) струйно быстро в дозе 5-10мг (0.5-1.0мл 1% раствора) только под контролем монитора (возможен выход из пароксизмальной наджелудочковой тахикардии через остановку синусового узла на 3-5сек. (А,1++). Верапамил вводится внутривенно капельно в дозе 5-10мг (2.0-4.0мл 2.5% раствора) на 200мл физиологического раствора под контролем АД и частоты ритма. (А,1++). Прокаинамид ( Новокаинамид ) вводится в/в капельно в дозе 1000мг (10.0мл 10%раствора, доза может быть повышена до 17мг/кг) со скоростью 50-100мг/мин под контролем АД (при тенденции к артериальной гипотонии – вместе с 0.3-0.5 мл 1% р-ра фенилэфрина ( Мезатона ) или 0.1-0.2 мл 0.2% р-ра норэпинефрина (Норадреналина) ), (А,1++). Пропранолол вводят в/в капельно в дозе 5-10мг (5-10мл 0.1% раствора) на 200 мл физиологического раствора под контролем АД и ЧСС; при исходной гипотонии его введение нежелательно даже в комбинации с мезатоном. (А,1+). Пропафенон вводится в/в струйно в дозе 1мг/кг в течение 3-6 минут. (С,2+). Дизопирамид (Ритмилен) – в дозе 15.0мл 1% раствора в 10мл физ. раствора (если предварительно не вводился новокаинамид).(С,2+). Рекомендуемая схема введения 1. Натрия аденозинтрифосфат (АТФ) 5-10мг в/в толчком. 2. Нет эффекта – через 2мин АТФ 10мг в/в толчком. 3. Нет эффекта – через 2мин верапамила 5мг в/в, медленно 4. Нет эффекта – через 15мин верапамил 5-10мг в/в, медленно 5. Повторить вагусные приемы. 6. Нет эффекта – через 20мин новокаинамид, или пропранолол, или пропафенон, или дизопирамид. Альтернативой повторному применению указанных выше препаратов может служить введение: Амиодарона (Кордарона) в дозе 300мг на 200мл физиологического раствора, капельно, учитывать влияния на проводимость и длительность QT (А, 1++). Особое показание к введению амиодарона – пароксизм тахикардии у больных с синдромами предвозбуждения желудочков
Этацизина (Этацизина) 15-20мг в/в капельно на 200мл физиологического раствора, который, однако, обладает выраженным проаритмическим эффектом и блокирует проводимость ( D,2+). Если отсутствуют условия для в/в введения лекарств, используют (таблетки разжевать!): Пропранолол (Анаприлин, Обзидан) 20-80мг. (А,1++).
Верапамил (Изоптин) 80-120мг (при отсутствии предвозбуждения!) в сочетании с феназепамом (Феназепам) 1 мг или клоназепамом 1мг.(А,1+). При гипокалиемии восполнить внутриклеточный калий: внутривенное капельное введение 10% хлорида калия на 200 мл физиологического раствора (А, 1++)
124. Кислотно-щелочное состояние у детей. Буферные системы организма.
В результате жизнедеятельности клетки в ней постоянно образуются кислоты, которые диссоциируют с освобождением очень активных ионов Н+. Часть этих ионов нейтрализуется буферной системной клетки, другая - буферными системами межклеточной жидкости и крови, а также при функционировании легких, почек, кишечника, печени и др. Соотношение водородных и гидроксильных ионов во внутренней среде в значительной мере определяет интенсивность окислительно-восстановительных процессов, синтез и расщепление белков, жиров и углеводов, активность ферментов, проницаемость мембран, чувствительность к гормональным стимулам и др. Это соотношение выражается в интегральном показателе рН. Учитывая, что показатель рН часто встречается в медицинской литературе, мы дадим ему более подробную характеристику. Кислотность или щелочность раствора зависит от содержания в нем свободных ионов водорода и концентрации гидроксильных групп. Если концентрация Н+ > концентрации ОН- - рН кислая Если концентрация Н+ = концентрации ОН- - рН нейтральная Если концентрация Н+ < концентрации ОН- - рН щелочная Эталон нормы –концентрация Н+ = 0,00000001 моль/л в 1 литре химически чистой воды при t0 250С. При этом рН будет нейтральной. Для удобства используют коэффициент рН. Термин «рН» представляет собой аббревиатуру от слов «puissance hydrogen» (puissance по-французски означает сила). Это мера активности или концентрации ионов водорода. рН определяют как отрицательный десятичный логарифм концентрации ионов водорода в моль/л:
Из этого уравнения следует, что: рН <7,0 - кислая среда рН =7,0- нейтральная среда рН >7,0 – щелочная среда
рН 7,4 = концентрация ионов водорода 40 нмоль/л; рН 7,0 = концентрация ионов водорода 100 нмоль/л; рН 6,0 = концентрация ионов водорода 1000 нмоль/л.
■ два этих параметра (рН и концентрация Н+) изменяются в противоположных направлениях - если концентрация ионов водорода возрастает, то рН снижается; ■ благодаря логарифмической природе шкалы незначительные изменения рН означают фактически очень существенные изменения концентрации ионов водорода. Например, удвоение концентрации ионов водорода соответствует снижению рН всего на 0,3 единицы.
- продукция Н+ за счет катаболизма кислот - дальнейшее преобразование и распределение кислот в организме - выведение Н+ из организма
- Н2С03 угольная кислота - летучая кислота, которая выводится через легкие - (слабая кислота, т.к. плохо диссоциирует),
В норме окисление глюкозы происходит аэробно: С6Н12О2 + 6О2 = 6Н2О + 6СО2 + 38 АТФ
В результате образуется избыток кислот и дефицит энергии.
-разведения (пассивного механизма); -действия буферных систем. Чтобы понять принцип работы химических буферных систем необходимо разобрать:
Кислота — это вещество, которое диссоциирует в растворе с высвобождением ионов водорода. Основания (щелочи) присоединяют ионы водорода. Например, соляная кислота (НС1) диссоциирует на ионы водорода и ионы хлора: тогда как бикарбонат (НС03), являющийся основанием, захватывает ион водорода, образуя угольную кислоту: НСОз + Н+ ↔ Н2С03
Буферы — это растворы химических композиций, которые способны сглаживать изменения рН, вызываемые добавлением кислоты, при помощи нейтрализации образующихся ионов водорода. Буфер состоит из основания и какой-либо слабой кислоты. Попадание в плазму сильной кислоты вызывает реакцию буферных систем, в результате которой сильная кислота превращается в слабую. То же происходит и при действии на биологические жидкости сильного основания, которое после взаимодействия с буферными системами превращается в слабое основание. В результате указанных процессов изменения рН либо не наступают, либо бывают минимальными.
1. Бикарбонатная 2. Фосфатная 3. Гемоглобиновая 4. Белковая
Бикарбонатный буфер состоит из угольной кислоты и бикарбоната, в соотношении 1:20
НСl + NаHC03 ↔ Nа Сl+ H 2C03 ↓ С02 + Н2О Система утрачивает буферные свойства при рН= 6,1, когда соотношение H 2C03 / NаHC03 = 1 /1 Происхождение бикарбонатной буферной системы тесно связано с метаболизмом органического углерода, поскольку конечным продуктом его является СО2 или НСО3- .
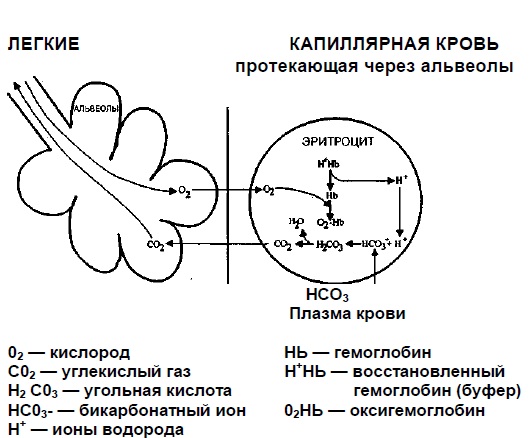
Кислород из вдыхаемого воздуха диффундирует через альвеолы в легкие и соединяется с гемоглобином, который, проявляя буферные свойства, высвобождает ионы водорода:
H++HC03- + Na2HP04 = NaHC03 + NaH2P04 Избыток Н2С03 ликвидируется, а концентрация НС03 - увеличивается. Таким образом, удерживается соотношение Н2С03/ NaHCO3= l:20 на постоянном уровне.
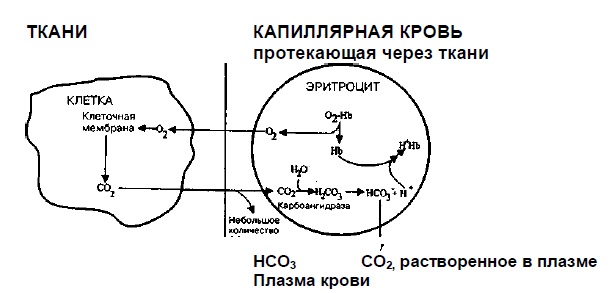
02НЬ – слабое основание С02 – слабая кислота Участие легких в кислотно-основном равновесии состоит в поддержании содержания углекислого газа (С02) в крови. Нормальное количество С02 в крови отражает равновесие между его продукцией в процессе клеточного обмена и выведением легкими с выдыхаемым воздухом. Последовательность событий от продукции С02 в тканях до его элиминации при выдохе выглядит следующим образом (рис. 1):
С02+ Н20 ↔ Н2С03 ↔ НСО3 - + Н+ ■ 3. Так как концентрация бикарбоната растет, часть его диффундирует из эритроцитов в плазму. Ионы водорода (которые, если позволить им накопиться, могут вызвать сильное снижение рН) связываются, с гемоглобином, который освобождается от принесенного кислорода в тканях (гемоглобин в данном случае действует как буфер). Н+ + 02НЬ ↔ Н+НЬ + 02 ■ 4. Когда кровь насыщена кислородом. Кислород из вдыхаемого воздуха диффундирует через альвеолы легких и соединяется с гемоглобином, который, проявляя буферные свойства, высвобождает ионы водорода. 02 + Н+НЬ ↔ Н+ + 02НЬ ■ 5. Освободившиеся ионы водорода буферируются бикарбонатом с образованием угольной кислоты, которая превращается в С02 и воду: Н+ + НС03- ↔ H2C03 ↔ Н20 + С02 ■ 6.С02 диффундирует из крови, где он находится в высокой концентрации, в альвеолы, где концентрация мала, и выводится из организма с выдыхаемым воздухом.
Рис. 1. Доставка 02 к тканям и первые стадии элиминации CO2
Транспорт кислорода из легких к тканям и из тканей к легким обусловлен изменениями, которые воздействуют на сродство кислорода к гемоглобину. На уровне тканей из-за снижения рН это сродство уменьшается (эффект Бора) и вследствие этого улучшается отдача кислорода. В крови легочных капилляров сродство гемоглобина к кислороду увеличивается из-за снижения рС02 и возрастания рН по сравнению с аналогичными показателями венозной крови, что приводит к повышению насыщения артериальной крови кислородом.
Белки плазмы крови – амфолиты – обладают свойствами кислот. Они составляют большую часть пула анионов плазмы. Изменение содержания альбуминов, протеинов и аномальных белков плазмы оказывает существенное влияние на величину анионной разницы. Если в крови много Н+, то белки их связывают:
R-CООН + Н+→ R-CООН2 Если в крови много ОН-, то белки отдают Н+ и образуется вода: R-CООН + ОН-→ R-CОО + Н2О
|
|||||||||
|
Последнее изменение этой страницы: 2024-06-27; просмотров: 4; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.217.228 (0.012 с.) |