Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Работа 1. Метод выделения плазмидной днк из дрожжейСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Для последующего введения в клетки E.coli.
Клетки Escherichia coli являются удобными объектами генно-инженерных экспериментов. Однако данные клетки не способны гликозилировать синтезируемые ими белки (в том числе и эукариотические). Но многие эукариотические белки активны лишь в гликозилированном состоянии. Дрожжи обладают всеми признаками эукариот. В их геноме нет оперонов, транскрипцию у них ведут три типа РНК-полимераз, а мРНК имеют типично эукариотическое строение. Они содержат специфические эукариотические белки (гистоны, актин, тубулин, пептидные гормоны) и эукариотические органеллы (ядерная мембрана, митохондрии, 80S рибосомы, эндоплазматические мембраны, аппарат Гольджи, лизосомы). Каждая хромосома их несет по одной центромере, по две теломеры и по несколько ori-сайтов инициации репликации. Дрожжевые клетки могут гликозилировать синтезируемые ими белки. У дрожжей известны три вида плазмид, которые можно использовать в качестве векторов. Это 2m и 3m (длина соответственно 2 и 3 мкм), а также митохондриальная (длина 24 мкм) ДНК. Первая плазмида найдена во многих штаммах дрожжей. Она представляет собой кольцевую молекулу ДНК (6318 пар нуклеотидов), локализуется в ядре клетки и составляет около 3% всей дрожжевой ДНК. В природе эта плазмида не интегрируется в дрожжевые хромосомы. Выделенную предлагаемым методом плазмидную ДНК можно использовать для трансформации E.coli. Ход работы 1. Посеять одиночную колонию в 5мл селективной среды и растить не менее 20 часов при +30°С. 2. 1,5 мл ночной культуры поместить в пробирку, центрифугировать 1 мин, после чего удалить супернатант. 3. Повторить п.2 еще 2 раза. 4. Суспендировать осадок в 200мл лизирующего буфера. 5. Добавить 0.3 г стеклянных шариков (Sigma G-8772) и 200 мл раствора Ф:Х:I (фенол: хлороформ: изоамиловый спирт в соотношении 25:24:1, pH=7). 6. Перемешать в течение 2 мин. 7. Центрифугировать 5 мин, водную фазу перенести в новую пробирку и осадить раствором этанола (добавить 1/10V ацетата натрия pH 5,2 и 2,5V этанола); 8. Осадок сполоснуть 70% этанолом, подсушить и растворить в 20мл буферного раствора 1xTE (10 мM Tris, pH 8.0 и 1мM EDTA).
Приготовление лизирующего буфера по схеме:
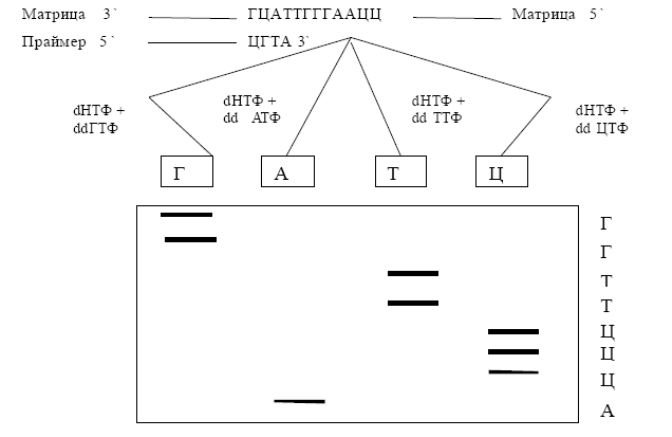
Секвенирование - исследование последовательности Нуклеотидов ДНК. Секвенирование биополимеров (белков и нуклеиновых кислот - ДНК и РНК) - определение их первичной аминокислотной или нуклеотидной последовательности (от англ. sequence - последовательность). В результате получается линейное символьное описание, которое сжато резюмирует атомную структуру молекулы. Для секвенирования применяются методы Эдмана, Сэнджера и другие. В настоящее время для секвенирования нуклеиновых кислот обычно применяется метод Сэнджера с дидезоксинуклеозидтрифосфатами (ddNTP). Обычно до начала секвенирования производят амплификацию участка ДНК, последовательность которого требуется определить, при помощи цепной полимеразной реакции (ПЦР). Дезоксинуклеотидный метод, или метод «обрыва цепи», был разработан Ф. Сенджером в 1977 году и в настоящее время широко используется для определения нуклеотидной последовательности ДНК. Он включает использование дидезоксинуклеозидтрифосфатов (2',3'-дидезокси НТФ) в модельной системе репликации ДНК. В эту модельную систему входит также набор всех дезоксирибонуклеозидтрифосфатов, ДНК-полимераза, небольшой олигонуклеотид, выполняющий роль затравки, и исследуемая молекула ДНК, которая служит матрицей для репликации. ДНК полимераза добавляет очередной мононуклеотид к 3'-ОН группе предыдущего мононуклеотида, следуя комплементарным «указаниям» ДНК матрицы. 2',3'-дидезокси НТФ не имеют 3'-ОН группы в дезоксирибозе. Поэтому добавление таких нуклеотидов останавливает синтез ДНК в момент присоединения dd-НТФ. По окончании реакции продукты разделяются методом электрофореза в присутствии мочевины как денатурирующего агента. После высушивания гель экспонируют с рентгеновской пленкой. Фракции внизу геля соответствуют низкомолекулярным продуктам, а сверху – высокомолекулярным (рис.).
Этот метод в последнее время вытеснил другие методы исследования первичной структуры белков. Зная последовательность нуклеотидов, можно легко установить последовательность аминокислот. В последе время чаще дидезоксинуклеотиды метят четырьмя разными флуоресцентными красителями и проводят ПЦР в одной пробирке. Затем во время электрофореза в полиакриламидном геле луч лазера в определенном месте геля возбуждает флуоресценцию красителей, и детектор определяет, какой нуклеотид в настоящий момент мигрирует через гель. Современные приборы используют для секвенирования ДНК капиллярный электрофорез.
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 818; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.157.86 (0.01 с.) |