
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Закон Бугера — Ламберта — БераСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Закон Бугера — Ламберта — Бера — физический закон, определяющий ослабление параллельного монохроматического пучка света при распространении его в поглощающей среде. Закон выражается следующей формулой: где Показатель поглощения характеризует свойства вещества и зависит от длины волны λ поглощаемого света. Эта зависимость называется спектром поглощениявещества. Закон Бугера — Ламберта — Бера экспериментально открыт французским учёным Пьером Бугером в 1729 году, подробно рассмотрен немецким учёным И. Г. Ламбертомв 1760 году и в отношении концентрации C проверен на опыте немецким учёным А. Бером в 1852 году. Для растворов поглощающих веществ в непоглощающих свет растворителях показатель поглощения может быть записан как
где Утверждение, что Законы Фарадея (I-II). · Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах. · Второй закон электролиза Фарадея: для данного количества электричества (электрического заряда) масса химического элемента, осаждённого на электроде, прямо пропорциональна эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество. Согласно 1-му закону, масса вещества г, прореагировавшего в процессе электролиза, прямо пропорциональна силе тока I и времени электролиза t, то есть количеству пропущенного электричества Q = It (предполагается, что I не зависит от t; в противном случае масса г пропорциональна Согласно 2-му закону, для разных электродных процессов при одинаковом количестве пропущенного электричества Q массы прореагировавших веществ относятся друг к другу так же, как эквиваленты химические этих веществ. Оба закона Фарадея объединяются одним уравнением: Записать выражение гравиметрического фактора для: FP/P2O5 ; FAg/Ag2S FAl/Al2S3 ; FBa/BaSO4 FP/P2O5 = 2MP/MP2O5 =2×31/142=0.436 FAg/Ag2S =2M Ag/MAg2S =2×108/140= 1.542 FAl/Al2S3 = 2MAl / MAl2S3 = 2×26/148=0.351 FBa/BaSO4 = 2MBa /M BaSO4 =2×137/233 =1.175 записать выражение ПР для соединений AI2S3; Fe(OH)3; Ag2CrO4;Ca3(PO4)2; Ba(OH)2? Ksp =[Al3+(aq)]2 [S2-(aq)]3 Ksp=[Fe3+(aq)] [OH-(aq)]3 Ksp=[Ag+(aq)]2 [CrO4 2- (aq)] Ksp=[Ca2+(aq)]3 [PO 4 3-(aq)]2 Записать выражение растворителя для Ag2CrO4 ; Cr(OH)3 ; В соответствии с правилом растворимости, сохранять постоянным произведение концентрации ионов в соответствующих степенях, рассчитывают растворимость осадков, т.е содержание ионов, находящихся в растворе над ними. Так. Для любого осадка в насыщенном растворе устанавливается равновесии: KpAq ‹—› pKq+ +qAp-Выражение произведение растворимости имеет вид: ПР (KpAq)=Сp (Kq+)× Cq(Ap-) ПР (Ag2CrO4) =С2 (Ag+)×C(CrO4 2-) ПР (Cr(OH)3 ) =С (Cr3+)×C3(OH-) Записать выражение растворителя для Al2S3 ; Fe(OH)3 ; ZnS В соответствии с правилом растворимости, сохранять постоянным произведение концентрации ионов в соответствующих степенях, рассчитывают растворимость осадков, т.е содержание ионов, находящихся в растворе над ними. Так. Для любого осадка в насыщенном растворе устанавливается равновесии: KpAq ‹—› pKq+ +qAp- Выражение произведение растворимости имеет вид: ПР =(KpAq)=Сp (Kq+)× Cq(Ap-) ПР Al2S3 =С2 (Al3+)×C3(S2-) ПР Fe(OH)3 =С (Fe3+)×C3(OH-) ПР ZnS =С (Zn2+)×C(S2-)
|
||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 3303; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.008 с.) |


 — интенсивность входящего пучка,
— интенсивность входящего пучка, 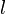 — толщина слоя вещества, через которое проходит свет,
— толщина слоя вещества, через которое проходит свет,  — показатель поглощения (не путать с безразмерным показателем поглощения
— показатель поглощения (не путать с безразмерным показателем поглощения  , который связан с
, который связан с  , где
, где  — длина волны).
— длина волны). ,
, — коэффициент, характеризующий взаимодействие молекулы поглощающего растворённого вещества со светом с длиной волны λ,
— коэффициент, характеризующий взаимодействие молекулы поглощающего растворённого вещества со светом с длиной волны λ,  — концентрациярастворённого вещества, моль/л.
— концентрациярастворённого вещества, моль/л. не зависит от
не зависит от  где t 1 и t 2 - моменты включения и выключения тока).
где t 1 и t 2 - моменты включения и выключения тока). где M - молярная масса вещества, участвующего в электролизе, z - число элементарных зарядов, соответствующее превращению одной молекулы этого вещества, 1/ F- коэффициент пропорциональности, общий для всех веществ, F - постоянная Фарадея, равная 96484,56 Кл/моль.
где M - молярная масса вещества, участвующего в электролизе, z - число элементарных зарядов, соответствующее превращению одной молекулы этого вещества, 1/ F- коэффициент пропорциональности, общий для всех веществ, F - постоянная Фарадея, равная 96484,56 Кл/моль.


