
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Способы расчета концентрации в фотометрии.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Метод градуировочного графика. В соответствии с законом Бугера - Ламберта - Бера график зависимости оптической плотности от концентрации должен быть линейным и проходить через начало координат. Готовят серию стандартных растворов различной концентрации и измеряют оптическую плотность в одинаковых условиях. Для повышения точности определения число точек на графике должно быть не меньше трех - четырех. Затем определяют оптическую плотность исследуемого раствора Ах и по графику находят соответствующее ей значение концентрации Сх (рис. 11.1.). Интервал концентраций стандартных растворов подбирают таким образом, чтобы концентрация исследуемого раствора соответствовала примерно середине этого интервала. Метод является наиболее распространенным в фотометрии. Основные ограничения метода связаны с трудоемким процессом приготовления эталонных растворов и необходимостью учитывать влияние посторонних компонентов в исследуемом растворе. Чаще всего метод применяется для проведения серийных анализов.
Метод добавок. Этот метод применяют для анализа сложных растворов, т. к. он позволяет автоматически учитывать влияние посторонних компонентов анализируемого образца. Сначала измеряют оптическую плотность исследуемого раствора с неизвестной концентрацией А х = затем в анализируемый раствор добавляют известное количество стандартного раствора определяемого компонента (Сст) и измеряют оптическую плотность А х+ст: А х+ст = откуда С х = С ст · Для повышения точности добавку стандартного раствора определяемого компонента делают дважды и полученный результат усредняют. Концентрацию анализируемого вещества в методе добавок можно найти графическим путем (рис.11.2.).
167. Стандартный и реальный потенциал. СТАНДАРТНЫЙ ПОТЕНЦИАЛ (нормальный потенциал), значение электродного потенциала, измеренное в стандартных условиях относительно выбранного электрода сравнения (стандартного электрода). Обычно стандартные потенциалы находят в условиях, когда термодинамич. активностиа всех компонентов потенциалопределяющей р-ции, протекающей на исследуемом электроде, равны 1, а давление газа (для газовых электродов) равно 1,01 · 105 Па (1 атм). Для водных р-ров в качестве стандартного электрода используют водородный электрод (Pt; H2 [1,01·105Па], Н+ [a=1]), потенциал к-рого при всех т-рах принимается равным нулю (см. Электроды сравнения): стандартный потенциал равен эдс электрохимической цепи, составленной из исследуемого и стандартного электродов. Согласно рекомендациям ИЮПАК (1953), при схематич. изображении цепи (гальванич. ячейки) водородный электрод всегда записывается слева, исследуемый-справа. Потенциал исследуемого электрода считается положительным, если в режиме "источник тока" слева направо во внеш. цепи движутся электроны, а в р-ре - положительно заряженные частицы. Напр., стандартный потенциал хлорсеребряного электрода равен эдс гальванич. ячейки -Pt, Н2[1,01·105Па]|НС1(аb=l)|AgCl, Ag|Pt + Для любой электродной р-ции, включающей перенос n электронов, электродный потенциал определяется ур-нием:
где Е°-стандартный потенциал электрода, R-газовая постоянная, Т-абс. т-ра, F- постоянная Фарадея, аi-термодинамич. активность частиц (как заряженных, так и незаряженных), участвующих в электродной р-ции, vi-стехиометрич. коэффициенты (положит. числа для продуктов р-ций и отрицат. числа для исходных в-в, если при записи стехиометрич. ур-ния элек-трохим. процесса электроны входят в левую часть ур-ния, напр. AgCl + е: Ag + С1-). Значения стандартных потенциалов для ряда электродных процессов в водной среде приведены в таблице в порядке убывания окислит. способности соответствующих систем. Стандартные потенциалы металлов и водорода, расположенные в порядке их возрастания, составляют электрохимический ряд напряжений. Стандартный потенциал определяется либо непосредственными измерениями эдс соответствующих электрохим. цепей с экстраполяцией на бесконечно разб. р-ры, либо расчетом - по данным о стандартных значениях изменения энергии Гиббса хим. р-ции DG0. В последнем случае р-цию представляют в виде суммы двух (или более) электродных р-ций, одна из к-рых -окис-лит.-восстановит. р-ция с искомым стандартным потенциалом
|
||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 1506; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.011 с.) |



 С х, (11.7.)
С х, (11.7.) . (11.9.)
. (11.9.)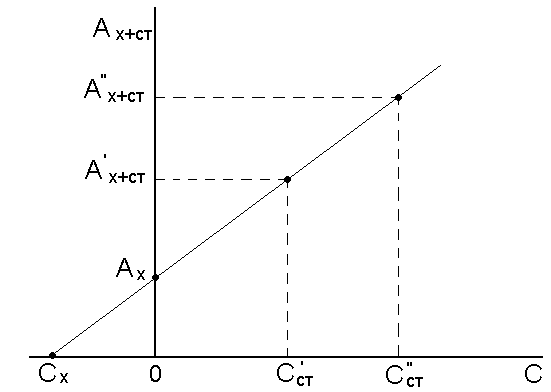

 , а другая-с известным стандартным потенциалом.
, а другая-с известным стандартным потенциалом.  . Если в условной схеме ячейки 1-й электрод записан слева, то
. Если в условной схеме ячейки 1-й электрод записан слева, то



