
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Эксикатор, сушильный шкаф, муфельная печь – название и их применение в практике химического анализаСодержание книги
Поиск на нашем сайте
Электроды вольтамперометрии Вольтамперометрия, совокупность электрохимических методов исследования и анализа, основанных на изучении зависимости силы тока в электролитической ячейке от потенциала погруженного в анализируемый раствор индикаторного микроэлектрода, на котором реагирует исследуемое электрохимически активное (электроактивное) вещество. В ячейку помещают помимо индикаторного вспомогательный электрод со значительно большей поверхностью, чтобы при прохождении тока его потенциал практически не менялся (неполяризующийся электрод). Разность потенциалов индикаторного и вспомогательного электродов Е описывается уравнением Е = U — IR, где U - поляризующее напряжение, R-сопротивление раствора. В анализируемый раствор вводят в большой концентрациииндифферентный электролит (фон), чтобы, во-первых, уменьшить величину R и, во-вторых, исключить миграционный ток, вызываемый действием электрического поля на электроактивные вещества (устаревшее - деполяризаторы). При низких концентрациях этих веществ омическое падение напряжения IR в растворе очень мало. Для полной компенсации омического падения напряжения применяют потенциостатирование и трехэлектродные ячейки, содержащие дополнительно электрод сравнения. В этих условиях В качестве индикаторных микроэлектродов используют стационарные и вращающиеся - из металла (ртуть, серебро,золото, платина), углеродных материалов (например, графит), а также капающие электроды (из ртути, амальгамгаллия). Последние представляют собой капилляры, из которых по каплям вытекает жидкий металл. Вольтамперометрию с использованием капающих электродов, потенциал которых меняется медленно и линейно, называют полярографией (метод предложен Я. Гейровским в 1922). Электродами сравнения служат обычно электроды второго рода, например каломельный или хлоросеребряный. Кривые зависимости I=f(E) или I =f(U) (вольтамперограммы) регистрируют спец. Приборами - полярографами разных конструкций.
Вольтамперограммы, полученные с помощью вращающегося или капающего электрода при монотонном изменении (линейной развертке) напряжения, имеют вид, схематически представленный на рисунке. Участок увеличения тока называют волной. Волны могут быть анодными, если электроактивное вещество окисляется, или катодными, если оно восстанавливается. Когда в растворе присутствуют окисленная (Ох) и восстановленная (Red) формы вещества, достаточно быстро (обратимо) реагирующие на микроэлектроде, на вольтамперограмме наблюдается непрерывная катодно-анодная волна, пересекающая ось абсцисс при потенциале, соответствующем окислительно-восстановительному потенциалу системы Ox/Red в данной среде. Если электрохимическая реакция на микроэлектроде медленная (необратимая), на вольтамперограмме наблюдаются анодная волна окисления восстановленной формы вещества и катодная волна восстановления окисленной формы (при более отрицательном потенциале). Образование площадки предельного тока на вольтамперограмме связано либо с ограниченной скоростью массопереноса электроактивного вещества к поверхности электрода путем конвективной диффузии (предельный диффузионный ток, Id), либо с ограниченной скоростью образования электроактивного вещества из определяемого компонента в растворе. Такой ток называют предельным кинетическим, а его сила пропорциональна концентрации этого компонента. Форма волны для обратимой электрохимической реакции описывается уравнением:
где R-газовая постоянная, Т-абсолютная температура, E1/2-потенциал полуволны, то есть потенциал, соответствующий половине высоты волны (Id/2; см. рис.). Значение E1/2 характерно для данного электроактивного вещества и используется для его идентификации. Когда электрохимической реакции предшествует адсорбция определяемого вещества на поверхности электрода, на вольтамперограммах наблюдаются не волны, а пики, что связано с экстремальной зависимостью адсорбции от потенциала электрода. На вольтамперограммах, зарегистрированных при линейном изменении (развертке) потенциала со стационарным электродом или на одной капле капающего электрода (устаревшее - осциллографической полярограмме), также наблюдаются пики, нисходящая ветвь которых определяется обеднением приэлектродного слоя раствора электроактивным веществом. Высота пика при этом пропорциональна концентрации электроактивного вещества. В полярографии предельный диффузионный ток (в мкА), усредненный по времени жизни капли, описывается уравнением Ильковича:
где n-число электронов, участвующих в электрохимической реакции, С-концентрация электроактивного вещества (мМ), D-eгo коэффициент диффузии (см2/с), Вольтамперограмма, получаемая с помощью вращающегося дискового электрода. В вольтамперометрии с вращающимся дисковым электродом предельный диффузионный ток рассчитывают по уравнению:
где S- площадь поверхности электрода (см2), Циклическая вольтамперометрия (вольтамперометрия с относительно быстрой треугольной разверткой потенциала) позволяет изучать кинетику и механизм электродных процессов путем наблюдения на экране осциллографич. трубки с послесвечением одновременно вольтамперограмм с анодной и катодной разверткой потенциала, отражающих, в частности, и электрохимическая реакции продуктов электролиза. Нижняя граница определяемых концентраций Сн в методах вольтамперометрии с линейной разверткой потенциала составляет 10-5-10-6 М. Для ее снижения до 10-7-10-8 М используют усовершенствованные инструментальные варианты - переменно-токовую и дифференциальную импульсную вольтамперометрию. В первом из этих вариантов на постоянную составляющую напряжения поляризации налагают переменную составляющую небольшой амплитуды синусоидальной, прямоугольной (квадратноволновая вольтамперометрия), трапециевидной или треугольной формы с частотой обычно в интервале 20-225 Гц. Во втором варианте на постоянную составляющую напряжения поляризации налагают импульсы напряжения одинаковой величины (2-100 мВ) длительностью 4-80 мс с частотой, равной частоте капания ртутного капающего электрода, или с частотой 0,3-1,0 Гц при использовании стационарных электродов. В обоих вариантах регистрируют зависимость от U или Е переменной составляющей тока с фазовой или временной селекцией. Вольтамперограммы при этом имеют вид первой производной обычной вольтамперометрической волны. Высота пика на них пропорциональна концентрации электроактивного вещества, а потенциал пика служит для идентификации этого вещества по справочным данным. Пики различных электроактивных веществ, как правило, лучше разрешаются, чем соответствующие вольтамперометрические волны, причем высота пика в случае необратимой электрохимических реакции в 5-20 раз меньше высоты пика в случае обратимой реакции, что также обусловливает повышенную разрешающую способность этих вариантов вольтамперометрии Например, необратимо восстанавливающийся кислород практически не мешает определению многих электроактивных веществ методом переменно-токовой вольтамперометрии Пики на переменно-токовых вольтамперограммах отражают не только электрохимических реакции электроактивных веществ, но и процессы адсорбции - десорбции неэлектроактивных веществ на поверхности электрода (пики нефарадеевского адмиттанса, устаревшее - тенсамметрические пики). Для всех вариантов вольтамперометрии используют способ снижения Сн, основанный на предварительном электрохимическом, адсорбционном или химическом накоплении определяемого компонента раствора на поверхности или в объеме стационарного микроэлектрода, с последующей регистрацией вольтамперограммы, отражающей электрохимическую реакцию продукта накопления. Эту разновидность вольтамперометрия называют инверсионной (устаревшее название инверсионной вольтамперометрии с накоплением на стационарном ртутном микроэлектроде - амальгамная полярография с накоплением). В инверсионной вольтамперометрии с предварительным накоплением Сндостигает 10-9-10-11 М. Минимальные значения Сн получают, используя тонкопленочные ртутные индикаторные электроды, в том числе ртутно-графитовые, состоящие из мельчайших капелек ртути, электролитически выделенных на подложку из специально обработанного графита. Для фазового и элементного анализа твердых тел используют инверсионную вольтамперометрию с электроактивными угольными электродами (так называемую минерально-угольными пастовыми электродами). Их готовят из смеси угольного порошка, исследуемого порошкообразного вещества и инертного связующего, например вазелинового масла. Разработан вариант этого метода, который дает возможность проводить анализ и определять толщину металлических покрытий. В этом случае используют специальное устройство (прижимная ячейка), позволяющее регистрировать вольтамперограмму, пользуясь каплей фонового электролита, нанесенного на исследуемую поверхность. Вольтамперометрию применяют: для количественного анализа неорганических и органических веществ в очень широком интервале содержаний - от 10-10 % до десятков %; для исследования кинетики и механизма электродных процессов, включая стадию переноса электрона, предшествующие и последующие химические реакции, адсорбцию исходных продуктов и продуктов электрохимических реакций и т. п.; для изучения строения двойного электрического слоя, равновесия комплексообразования в растворе, образования и диссоциации интерметаллических соединений вртути и на поверхности твердых электродов; для выбора условий ампераметрического титрования и др. Электролит-коагулятор - понятие примеры и его практическое применение. Электролит-коагулятор МЩЫОз вводят в промывную жидкость, чтобы не допустить пептизации осадка; добавка КНз служит для увеличения рН до 5, уменьшающего растворимость осадка. Если к золю приливать электролит-коагулятор небольшими порциями через большие промежутки времени, то коагуляция часто не наступает совсем, хотя общее количество добавленного электролита намного превышает величину адсорбционной способности, которую он проявляет при вливании в золь всего количества за один раз. Так, 20 мл золя сульфида мышьяка коагулируется полностью от прибавления 32 капель нормального раствора хлорида бария. Если прибавлять раствор хлорида бария постепенно - по 4 капли в первом опыте и по 2 капли во втором опыте, то после прибавления к каждому из растворов 32 капель раствора хлорида бария коагуляция не наступает. К золю сульфида мышьяка, взятому для первого опыта, приходится для полной коагуляции прибавить еще 24 капли раствора, а к золю, взятому для второго опыта, - гораздо больше. Если к золю приливать электролит-коагулятор небольшими порциями через большие промежутки времени, то коагуляция часто не наступает совсем, хотя общее количество добавленного электролита намного превышает величину адсорбционной способности, которую он проявляет при вливании в него всего количества за один раз. Если прибавлять раствор ВаС12 постепенно - по 4 капли в первом опыте и по 2 капли во втором опыте, то после прибавления к каждому из растворов 32 капель раствора ВаС12 коагуляции не наступает. К золю As2S3, взятому для первого опыта, приходится для полной коагуляции прибавить еще 24 капли раствора, а к золю, взятому для второго опыта, - гораздо больше. Перед осаждением добавляют к раствору какой-либо электролит-коагулятор. Коагуляторами чаще всего служат соли аммония.
Для объяснения этого следует принять во внимание, что прибавляемый при осаждении электролит-коагулятор, а также все другие электролиты постепенно вымываются из осадка. Поэтому скоагулированные в свое время коллоидные частицы осаждаемого вещества в конце концов снова получают заряд и начинают отталкиваться друг от друга. В результате крупные агрегаты снова распадаются на мельчайшие коллоидные частицы, которые свободно проходят сквозь поры фильтра.
Перед подачей речной воды в цеха завода ее осветляют: вводят в нее электролит-коагулятор и образовавшийся ил отстаивают в специальных отстойниках.
Аморфные осадки, способные переходить в коллоидное состояние, промывают водой, в которую добавляют электролит-коагулятор. В качестве коагулятора чаще всего применяют соли аммония.
Раствором электролит а-к оагулятора промывают осадки, которым свойственно переходить в коллоидное состояние. Электролит-коагулятор должен удаляться при прокаливании осадка.
Раствором электролита-коагулятора промывают осадки, которым свойственно переходить в коллоидное состояние. Электролит-коагулятор должен удаляться при прокаливании осадка.
Практически для этой цели пользуются или летучими кислотами (если последние не растворяют осадка или аммонийными солями. Конечно, заботиться о том, чтобы электролит-коагулятор содержал общий ион с осадком, не приходится, так как назначение его здесь совершенно иное, чем в случае, рассмотренном выше.
Образование коллоидных растворов постоянно происходит также при промывании осадков. Это объясняется тем, что прибавляемый при осаждении электролит-коагулятор при промывании постепенно вымывается из осадка. Вследствие этого частицы осадка снова приобретают заряд и, образуют коллоидный раствор (явление пептизации), в виде которого они легко могут проходить через фильтр. Во избежание подобного нежелательного явления некоторые осадки приходится промывать не чистой водой, а разбавленным раствором электролита, обычно какой-либо соли аммония.
Образование коллоидных растворов может происходить также при промывании осадков. Это объясняется тем, что прибавляемый при осаждении электролит-коагулятор при промывании постепенно вымывается из осадка. Вследствие этого частицы осадка снова приобретают заряд и образуют коллоидный раствор (явление пептизации), который легко проходит через фильтр.
Сульфид свинца обычно получается в этом опыте в виде коллоидного раствора. Если к нему прибавить немного раствора МН4С1 (электролит-коагулятор) и нагреть до кипения, то PbS скоагулирует и выпадет в виде хлопьев черного цчета.
Образование коллоидных растворов постоянно происходит также при промывании осадков. Это объясняется тем, что прибавляемый для осаждения электролит-коагулятор при промывании постепенно вымывается из осадка, его частицы в конце концов снова получают заряд и начинают отталкиваться друг от друга. В результате образуется коллоидный раствор и вещество проходит через фильтр или переходит из осадка в раствор. Электролит-коагулятор (понятия, примеры) Электролит — вещество, которое проводит электрический ток вследствие диссоциации на ионы. Примерами электролитов могут служить водные растворы кислот, солей и оснований и некоторые кристаллы, (например, иодид серебра, диоксид циркония). ПОРОГ КОАГУЛЯЦИИ - минимальная концентрация электролита, при которой исчезает энергетический барьер. Например, на коллоидные частицы гидроксида алюминия производит более сильное коагулирующее действие (NH4)2SO4, чем NH4Cl. Для коагуляции положительно заряженного золя Fe(OH)3 достаточно нескольких капель раствора аммиака: для выделения 2г Fe(OH)3 из его золя нужно 1мг NH4OH. При коагуляции часто происходит загрязнение осадка ионами электролита, что мешает дальнейшему проведению анализа. Раствором электролита-коагулятора промывают осадки, которым свойственно переходить в коллоидное состояние. Электролит-коагулятор должен удаляться при прокаливании осадка
|
||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 256; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.72.65 (0.008 с.) |


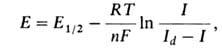

 время жизни ртутной капли (с), m-скорость вытекания ртути (мг/с).
время жизни ртутной капли (с), m-скорость вытекания ртути (мг/с).
 -круговая частота вращения электрода (рад/с), v-кинематическая вязкость раствора (см2/с), F-число Фарадея (Кл/моль).
-круговая частота вращения электрода (рад/с), v-кинематическая вязкость раствора (см2/с), F-число Фарадея (Кл/моль).


