

Мы поможем в написании ваших работ!
ЗНАЕТЕ ЛИ ВЫ?
|
Определение точки эквивалентности
Содержание книги
- Аналитический сиглан рефрактометрии, прибор на котором его измеряют.
- Аналитический сигнал кондуктометрии.
- Аналитический сигнал нефелометриии и прибор, на котором его снимают.
- Аналитический сигнал полиметрии и прибор на котором его измеряют.
- Аналитический сигнал фотометрии. Приборы фотометрии
- Аналитический сигнал фотометриии.
- В чем Различия между аморфными и кристалическими осадками.
- Вольтамперометрия (индикаторы метода и амперометрическое титрование).
- Монохроматический свет, монохроматизация , монохроматизаторы фотометрии
- Определение концентрации вещества в растворе.
- Декантация- понятие, сущность и пратическое применение
- Естественный и поляризованный луч-их различие, плоскость поляризации и плоскость колебаний.
- Закон Бугера — Ламберта — Бера
- Индикаторы - интервал перехода окраски и РТ-индикатора.
- Индикаторы метода кислотно-основного титрования (интервал перехода окраски и рТ).
- Классификация хроматографического анализа.
- Коэффициент рефракции – смысл ,формула и фактор влияющие на величину рефракции
- Кривые кондуктометрического титрования и их различия.
- Определение точки эквивалентности
- Кривые титрования, их назначение и координаты.
- Методы редоксиметрии. Координаты кривых титрования
- Монохроматический свет, монохроматизация , монохроматизаторы фотометрия
- Направление реакции редоксиметрии
- Основное условие амперометрического титрирования
- Основные операции гравиметрии (методы осождения)
- Относительный показатель преломления, формула и понятие
- Перманганатометрия, рабочий раствор, установленные вещества, индикаторы.
- Переносчик электричества в кондуктометрии
- Полярогррафия.индикаторный электрод.электрод сравнения.полярограмма
- Посуда и аппаратура их назначение в практике гравиметрии
- Прибор для снятия сигнала нефелометрии.
- Рабочие растворы и способы их приготовления.
- Рассчитать T(HCl/CaO);KMnO/Fe
- Редокс-потенциал-понятие, еденица измерения.
- С чем связанна оптическая активность вещества.
- Созревание осадков- понятие и для каких осадков характерно
- Спектр поглощения( определение), графическая зависимость.
- Способы определений концентрации вещества в методах прямых измерений (метод градуировочного графика, молярного вещества, добавок)
- Способы расчета концентрации в рефракции.
- Способы расчета концентрации в фотометрии.
- Стандартный редокс-потенциал.
- Сущность кислотно-основного титрования: реакции, рабочие растворы, установленные вещества, индикаторы и тд.
- Классификация видов хроматографии
- Сущность методы окисления-восстановления.
- Фильтрование и промывание осадка
- Уравнения Ленгмюра. Изотерм адсорбции.
- Условия осаждения амфотерных осадков.
- Формула расчета концентрации в поляриметрии.
- Фотоэлемент – определение (понятие)э
- Фототок — это электрический ток, возникающий в фотоэлементе при воздействии света.
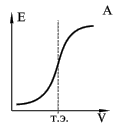
| На рис. А представлена кривая титрования хлороводородной кислоты (HCl) гидроксидом натрия (NaOH). Она почти точно воспроизводит теоретическую кривую титрования сильной кислоты сильным основанием. Как видно, в точке эквивалентности происходит резкий скачок ЭДС, вызванный резким изменением потенциала индикаторного электрода. По этому скачку можно определить точку эквивалентности и потом рассчитать содержание хлороводородной кислоты.
| 
| Для нахождения точки эквивалентности часто строят дифференциальную кривую в координатах dE/dV - V (рис. Б). На точку эквивалентности указывает максимум полученной кривой, а отсчет по оси абсцисс, соответствующий этому максимуму, дает объем титранта, израсходованного на титрование до точки эквивалентности. Определение точки эквивалентности по дифференциальной кривой значительно точнее, чем по простой зависимости E - V.
| 
| Поскольку производная функции, имеющей максимум, в точке максимума равна нулю, вторая производная потенциала по объему (d2E/dV2) в точке эквивалентности будет равна нулю. Это свойство также используется для нахождения точки эквивалентности (рис. В).
| 
| В простом и удобном методе Грана точка эквивалентности определяется по графику в координатах dV/dE-V. Перед точкой эквивалентности и после нее кривая Грана линейна, а сама точка эквивалентности находится как точка пересечения этих прямых (рис. Г). Достоинства и удобства метода Грана особенно заметны при анализе разбавленных растворов, позволяя определить точку эквивалентности с достаточной точностью
вследствие линейности графика.
| Для точного определения конечной точки титрования необходимо, чтобы на кривой титрования вблизи точки эквивалентности наблюдался перегиб (скачок). Это требование устанавливает пределы как для минимальной определяемой концентрации, так и для минимальной константы равновесия, приемлемой для реакции титрования. Видно, что при уменьшении концентрации скачок становится менее выраженным. Нижний предел концентрации зависит от конкретной реакции и метода определения конечной точки титрования, но проводить титрование при концентрациях ниже 10–4 М уже затруднительно. Для реакций нейтрализации в водных растворах константа равновесия в случае сильной кислоты и сильного основания составляет 1014, а для слабой кислоты и сильного основания – 1014 K a, где K a – константа диссоциации кислоты. По мере уменьшения константы равновесия уменьшается и величина скачка. Чтобы визуальное определение конечной точки титрования было надежным, константа равновесия не должна быть меньше 106.
|