
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Индикаторы метода кислотно-основного титрования (интервал перехода окраски и рТ).Содержание книги
Поиск на нашем сайте Индикаторы – слабые органич. к-ты(или основания), у которых не диссоциированные молекулы и образуемые ими ионы имеют различную окраску. Поэтому они называются кислотно-основными индикаторами. Индикаторы, обладающие св-вом присоединять протоны называют основными индикаторами: JndOH + Индикаторы редоксиметрии. Процессы окислительно-восстановительного титрования сопровождаются резкими скачкаи потенциалов в точке эквивалентности, поэтому легко себе представить что редокс-индикатор меняет свою окраску, характеризуя окислительный потенциал, при котором достигается точка эквивалентности. Изменение цвета редокс-индикатора обуславливается окислением восстановленной формы индикатора и превращением ее в окисленную форму или восстановление окисленной формы и переходом в восстановленную при определении значения потенциала. Ind(восст.) – ne Ind(окис.) Бесцв. форма окрашен. Форма Ind(восст.) +ne Ind(окис.) Окрашен.форма Бесцв. Форма Редокс индикаторы являются в большинстве органическими соединениями, окисляющиися при определенных значениях окислительно-восстановительного потенциала, при этом становятся видимыми изменения цвета индикатора. Изменение окраски цвета индикатора зависит от отношения интервала изменения. Интервал изменения индикатора вычисляется по формуле: Е= Ионная теория Оствальда. Швецарский ученый Освальд представляет свою ионную теорию индикаторов. Согласно это теории: изменение цвета индикатора. HJnd ↔ H+ + Jnd- кислота основание (акцептор протона); (донор протона) ↓; ↓ ионная форма индикатора (анион); Молекулярная форма молекул. Окраска кислотной формы индикаторов отличается от окраски основной формы. К какому виду соосаждения относятся аморфные осадки. Примеры. (Ответ ниже) К какому виду соосаждения относятся красталлические осадки. Примеры. Стадия осаждения является важнейшим этапом гравиметрического оп- ределения, точность анализа определяется тем, насколько чистой получена осаждаемая форма. Загрязнение осадков примесными ионами может происходить в ре- зультате: 1) совместного осаждения (одновременно превышается значение IIP осадков, содержащих осаждаемый и примесный ионы); 2) последующего осаждения (примесное соединение осаждается на определяемом спустя некоторое время); 3) соосаждения (загрязнение осадка веществами, которые в данных ус- ловиях должны оставаться в растворе). Если получен сильно загрязненный осадок, то прибегают к переосаж- дению (осадок растворяют и повторно осаждают). Виды соосаждения: 1) адсорбция (загрязнение поверхности осадка примесными ионами); 2) окклюзия (захват примесных ионов внутрь кристаллической решетки); 3) изоморфизм (загрязнение примесными ионами с образованием изоморфного соединения). Изоморфное соосаждение наблюдается, если осаждаемые и примесные ионы имеют одинаковый заряд, близкие радиу-28 сы (R1–R2 =10–15 %), кристаллизуются в одинаковом типе кристалличе- ской решетки. Наиболее часто осадки загрязнены адсорбированными примесными ионами. Образование осадков сопровождается соосажением, то есть увлечением в осадок примесей, растворимых в условиях осаждения. Основными видами соосаждения являются: а) адсорбция ионов на поверхности осадка – особенно значительна для амфорных осадков, имеющих большую поверхность; б) окклюзия – захват примесей вместе с маточным раствором внутрь кристалла во время его роста и формирования за счет дефектов в кристаллической решетке; в) изоморфные включения (инклюзия) – совместная кристаллизация соединений, имеющих однотипные формулы и кристаллизующихся в одинаковых геометрических формах. Чтобы свести к минимуму явление соосаждения, осаждение необходимо проводить в условиях, описанных ранее для кристаллических и аморфных осадков. При этом большую роль играет процесс созревания кристаллического осадка, в результате которого происходит совершенствование кристаллической структуры осадка и уменьшение его удельной поверхности, вследствие чего десорбируются и переходят в раствор примеси адсорбированные на поверхности осадка, а также высвобождаются окклюдированные капельки маточного раствора. В случае очень загрязненных осадков их переосаждают. Все осадки тщательно промывают для удаления адсорбированных примесей. Условия осаждения аморфных осадков Аморфные осадки следует:29 1) осаждать из концентрированных растворов концентрированным раствором осадителя; 2) осаждать из горячих растворов; 3) осаждать в присутствии электролита-коагулянта (лучше использо- вать летучие соли аммония); 4) осадитель добавлять быстро; 5) не оставлять на «старение» (во избежание загрязнения посторонни- ми ионами за счет высокой удельной поверхности). Для уменьшения количества адсорбированных примесей осадки про- мывают, используя промывные жидкости. В зависимости от природы обра- зующегося осадка в состав промывных жидкостей должны входить: а) электролиты-коагулянты (для аморфных осадков); б) электролиты, содержащие одноименные с осадком ионы (для кри- сталлических осадков). Соосаждение является одной из основных причин загрязнения осад- ков, что вызывает погрешности анализа. Но соосаждение может играть и положительную роль, являясь эффективным способом извлечения мик- роколичеств веществ из сильно разбавленных растворов (осаждение с кол- лектором). Как влияет большое количество осадителя на растворимость осадков i[Ag+]'[Cl~] <npAgci — ненасыщенный раствор; i[Ag+]i[Cl~] =nPAgci —насыщенный раствор; :[Ag+] [Cl~] >nPAgci —пересыщенный [раствор. Осадок образуется в том случае, когда произведение концентраций. ионов малорастворимого электролита превысит величину произведения растворимости электролита при данной температуре. Когда ионное произведение станет равным величине ПР, выпадение осадка прекращается. Зная объем и концентрацию смешиваемых растворов, можно рассчитать, будет ли выпадать осадок образующейся соли. Пример. Выпадает ли осадок при смешении равных объемов 0,2 М растворов РЬ(.ЫОз)2 и NaCl? ПРрьс12=2,4-10~4. Решение. При смешении объем раствора возрастет вдвое и концентрация каждого иэ> веществ уменьшится вдвое, т. е. станет 0,1 М или 1-Ю-1 моль/л. Таковы же будут концентрации РЬ2+ и С1~. Следовательно [РЬ2+] [СГ]2= 1 • 10-1-(1 • Ю-1)2 = Ы0-». Полученная величина превышает ПРрьа2 (2,4-Ю-4). Поэтому часть соли PbCfo выпадет в осадок. Из всего сказанного выше мы можем сделать вывод о влиянии различных факторов на образование осадков. 1. Влияние концентрации растворов. Трудиораство-римый электролит с достаточно большой величиной 'ПР нельзя осадить из разбавленных растворов. Например, осадок РЬСЬ не будет выпадать при смешении равных объемов 0,1 М растворов Pb(N03)2 и NaCl. При смешении равных объемов концентрации каждого из веществ станут 0,1: 2 = 0,05 М или 5-10 ~2 моль/л. Ионное произведение [РЬ2+] [СГ]2 = 5- Ю-2 (5- Ю-2)2 = 12,5-10-». Полученная величина меньше ПРРьс12. следовательно выпадения осадка не произойдет. 2. Влияние количества осадителя. Для возможно более полного осаждения употребляют избыток осадителя. ВаС12 + Na2C03 = BaC03J + 2NaCl После прибавления эквивалентного количества Ыа2СОз в растворе остаются ионы Ва2+, концентрация которых обусловлена величиной ПР. Повышение концентрации ионов СО!", вызванное прибавлением избытка осадителя (Na2C03), повлечет за собой соответственное уменьшение концентрации ионов Ва2+ в растворе, т. е. увеличит полноту осаждения этого иона. Однако большого избытка осадителя следует избегать по ряду причин (образование комплексных солей, кислых солей и пр.). На практике обычно употребляют не более чем полуторный избыток осадителя. Большое значение имеет степень диссоциации осадителя. Концентрация ионов, вступающих в реакцию, у слабого электролита во 'много раз меньше концентрации самого электролита, а следовательно, осаждение мало-диссоциированным реактивом будет гораздо менее полным. 3. Влияние одноименного иона. Растворимость труднорастворимых электролитов понижается в присутствии Если к ненасыщенному раствору BaS04 прибавлять понемногу раствор Na2S04, то ионное произведение, которое 'было сначала меньше nPBaso4 (1,1-Ю-10), постепенно достигнет ПР и превысит его. Начнется выпадение осадка. Соли с одноименным ионом понижают растворимость солей с довольно большой растворимостью. 4. Солевой эффект. Соли, не имеющие одноименного иона, тоже влияют на растворимость электролитов, но влияни в данном случае противоположное: растворимость электролита повышается. Так, например, раство римость PbS04повышается в присутствии нитратов калия или натрия, а растворимость AgCl повышается в присутствии сульфатов «атрия или калия. Описанное явление называется солевым эффектом. 5. Влияние температуры. Произведение растворимости является постоянной величиной при постоянной температуре. С увеличением температуры величина произведения растворимости возрастает, поэтому осаждение, как правило, проводят из холодных растворов. Осаждение из горячих растворов проводят лишь тогда, когда температура благоприятно влияет на характер осадка (переход из аморфного состояния в кристаллическое, предотвращение образования коллоидных растворов и т. д.). Какая зависимость в основе вольтамперометрии. Зависимость тока I от приложенного напряжения Е при обратимом электродном процессе передается уравнением полярографической волны: Е = Е 1/2 + (R T / n F) ln (Id – I) / I, (1) Где Е 1/2 – потенциал полуволны; Id – диффузионный ток. При I = Id / 2 уравнение (1) переходит в Е = Е 1/2 . (2) Это соотношение показывает независимость потенциала полуволны от тока и, следовательно, от концентрации восстанавливающегося иона. Потенциал полуволны является, таким образом, качественной характеристикой иона в растворе данного фонового электролита, и определение потенциала полуволны составляет основу качественного полярографического анализа. Количественный полярографический анализ основан на уравнении Ильковича, которое связывает диффузионный ток Id с концентрацией иона с и рядом других величин: Id = 605 z D 1/2 m 2/3 t 1/6 c (3) Где z - заряд иона; D – коэффициент диффузии; m – масса ртути, вытекающей из капилляра за 1 с, мг; t – время образования капли (периода капания), с В практике количественного полярографического анализа коэффициент пропорциональности межу концентрацией вещества и силой диффузионного тока обычно устанавливают с помощью стандартных растворов. При постоянных условиях полярографирования D, m, и t постоянны, поэтому уравнение (3) переходит в Id = k c. (4) При анализе некоторых систем, для которых применимость уравнения (4) установлена вполне надежно, часто используют менее трудоемкий метод стандартных растворов. Так же широко распространен в количественной полярографии и метод добавок. Какая форма осадка более практична для осаждения Mg; если ПР Mg(OH)2 = 5×10-12 ПР=MgCO3 =1,0×10-5 ПР= MgC2O4 =8,4×10-16 Ответ: MgC2O4 так как ПР=MgC2O4 =8,4×10-16 <ПР Mg(OH)2 = 5×10-12 < ПР=MgCO3 =1.0×10-5 то более практична для осаждения будет ввиду форме MgC2O4 Какая форма осадка более практична для осаждения Са; если ПР CaSO4 = 2,4×10-5 ПР=CaCO3 =4,8×10-8 ПР= CaC2O4 =1,2×10-12 Ответ: CaC2O4 так как ПР= CaC2O4 =1,2×10-12 < ПР=CaCO3 =4,8×10-8 <ПР CaSO4 = 2,4×10-5 то более практична для осаждения будет ввиду форме CaC2O4
|
||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 389; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.009 с.) |

 + H2O. Индикаторы, обладающие св-вом отдавать протоны называют кислотными индикаторами: Н Jnd
+ H2O. Индикаторы, обладающие св-вом отдавать протоны называют кислотными индикаторами: Н Jnd 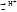 +
+ 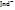 .
.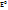 +
+  . В редоксиметрии применяются необратимые индикаторы: метилоранж, метил красный и др., которые в конечной точке титрования необратимо окисляются избытком окислителя, при этом меняют окраску. Известны также индикаторы флуоресцентные и хемилюминисцентные. К флуоресцентным относятся в-ва(акридин, селикарбазон салицилового альдегида и др.), излучающие видимый цвет при определенных значениях рН р-ра в процессе облучения их ультрафиолетовыми лучами. Хемилюминисцентными индикаторами являются разнообразныев-ва(люминал, люцигенин, силоксен и др.) светящиеся в конечной точке титрования вследствие экзотермических химических процессов. Преимуществом флуоресцентных и хемилюминесцентных индикаторов является то, что их можно применять для титрования не только прозрачных, но и мутных или окрашенных р-ров
. В редоксиметрии применяются необратимые индикаторы: метилоранж, метил красный и др., которые в конечной точке титрования необратимо окисляются избытком окислителя, при этом меняют окраску. Известны также индикаторы флуоресцентные и хемилюминисцентные. К флуоресцентным относятся в-ва(акридин, селикарбазон салицилового альдегида и др.), излучающие видимый цвет при определенных значениях рН р-ра в процессе облучения их ультрафиолетовыми лучами. Хемилюминисцентными индикаторами являются разнообразныев-ва(люминал, люцигенин, силоксен и др.) светящиеся в конечной точке титрования вследствие экзотермических химических процессов. Преимуществом флуоресцентных и хемилюминесцентных индикаторов является то, что их можно применять для титрования не только прозрачных, но и мутных или окрашенных р-ров
 Образование осадковЕсли произведение концентраций ионов (ионное произведение) труднорастворимого электролита меньше его произведения растворимости, раствор является ненасыщенным. В тот момент, когда ионное произведение достигнет величины ПР данного электролита, раствор станет.насыщенным относительно этого электролита. Если ионное произведение превысит величину ПР, начинается выпадение осадка:
Образование осадковЕсли произведение концентраций ионов (ионное произведение) труднорастворимого электролита меньше его произведения растворимости, раствор является ненасыщенным. В тот момент, когда ионное произведение достигнет величины ПР данного электролита, раствор станет.насыщенным относительно этого электролита. Если ионное произведение превысит величину ПР, начинается выпадение осадка: 


