

Мы поможем в написании ваших работ!
ЗНАЕТЕ ЛИ ВЫ?
|
Индикаторы - интервал перехода окраски и РТ-индикатора.
Содержание книги
- Аналитический сиглан рефрактометрии, прибор на котором его измеряют.
- Аналитический сигнал кондуктометрии.
- Аналитический сигнал нефелометриии и прибор, на котором его снимают.
- Аналитический сигнал полиметрии и прибор на котором его измеряют.
- Аналитический сигнал фотометрии. Приборы фотометрии
- Аналитический сигнал фотометриии.
- В чем Различия между аморфными и кристалическими осадками.
- Вольтамперометрия (индикаторы метода и амперометрическое титрование).
- Монохроматический свет, монохроматизация , монохроматизаторы фотометрии
- Определение концентрации вещества в растворе.
- Декантация- понятие, сущность и пратическое применение
- Естественный и поляризованный луч-их различие, плоскость поляризации и плоскость колебаний.
- Закон Бугера — Ламберта — Бера
- Индикаторы - интервал перехода окраски и РТ-индикатора.
- Индикаторы метода кислотно-основного титрования (интервал перехода окраски и рТ).
- Классификация хроматографического анализа.
- Коэффициент рефракции – смысл ,формула и фактор влияющие на величину рефракции
- Кривые кондуктометрического титрования и их различия.
- Определение точки эквивалентности
- Кривые титрования, их назначение и координаты.
- Методы редоксиметрии. Координаты кривых титрования
- Монохроматический свет, монохроматизация , монохроматизаторы фотометрия
- Направление реакции редоксиметрии
- Основное условие амперометрического титрирования
- Основные операции гравиметрии (методы осождения)
- Относительный показатель преломления, формула и понятие
- Перманганатометрия, рабочий раствор, установленные вещества, индикаторы.
- Переносчик электричества в кондуктометрии
- Полярогррафия.индикаторный электрод.электрод сравнения.полярограмма
- Посуда и аппаратура их назначение в практике гравиметрии
- Прибор для снятия сигнала нефелометрии.
- Рабочие растворы и способы их приготовления.
- Рассчитать T(HCl/CaO);KMnO/Fe
- Редокс-потенциал-понятие, еденица измерения.
- С чем связанна оптическая активность вещества.
- Созревание осадков- понятие и для каких осадков характерно
- Спектр поглощения( определение), графическая зависимость.
- Способы определений концентрации вещества в методах прямых измерений (метод градуировочного графика, молярного вещества, добавок)
- Способы расчета концентрации в рефракции.
- Способы расчета концентрации в фотометрии.
- Стандартный редокс-потенциал.
- Сущность кислотно-основного титрования: реакции, рабочие растворы, установленные вещества, индикаторы и тд.
- Классификация видов хроматографии
- Сущность методы окисления-восстановления.
- Фильтрование и промывание осадка
- Уравнения Ленгмюра. Изотерм адсорбции.
- Условия осаждения амфотерных осадков.
- Формула расчета концентрации в поляриметрии.
- Фотоэлемент – определение (понятие)э
- Фототок — это электрический ток, возникающий в фотоэлементе при воздействии света.
1. Индикатор — соединение, позволяющее визуализировать изменение концентрации какого-либо вещества или компонента, например, в растворе при титровании, или быстро определить pH, еН и др. параметры. Существуют также химические индикаторы для самых различных специальных целей, например, для определения дозы облучения.
Применение индикаторов
Индикаторы позволяют быстро и достаточно точно контролировать состав жидких или газообразных сред, следить за изменением их состава, или за протеканием химической реакции.
Широко используются кислотно-основные индикаторы, разбавленные растворы которых обладают способностью заметно изменять цвет, в зависимости от кислотности раствора. Причина изменения цвета — изменения в строении молекул индикатора в кислой и щелочной среде, что приводит к изменению спектра поглощения раствора.
Для определения состава газовых сред используют индикаторные бумажки и индикаторные трубки.
Структура молекул и цвет индикаторов
Трифенилметановые красители-индикаторы
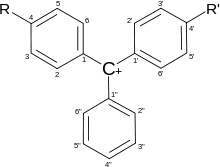 Структура трифенилметановых красителей Структура трифенилметановых красителей
Трифенилметановые красители широко используются в качестве индикаторов. В зависимости от типа заместителей изменения структуры молекулы приводят к широкой гамме цветных соединений, большинство из которых могут служить химическими индикаторами.
Производные азобензола
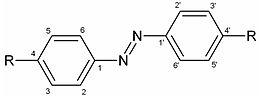
Виды индикаторов
· Кислотно-основные индикаторы
· Редокс-индикаторы, Ох- и Red-формы которых имеют различный цвет
· Металлоиндикаторы
· Адсорбционные индикаторы
Распространённые кислотно-основные индикаторы
| Индикатор
| Окраска/кислая форма
| Окраска/щелочная форма
| Интервалы pH
| | Ализариновый жёлтый
| жёлтый
| фиолетовый
| 10,1—12,1
| | Тимолфталеин
| бесцветный
| синий
| 9,4—10,6
| | Фенолфталеин
| бесцветный
| красный
| 8,2—10,0
| | Крезоловый красный
| жёлтый
| тёмно-красный
| 7,0—8,8
| | Нейтральный красный
| красный
| коричневый
| 6,8—8,0
| | Феноловый красный
| жёлтый
| красный
| 6,8—8,0
| | Бромтимоловый синий
| жёлтый
| синий
| 6,0—7,6
| | Лакмус (азолитмин)
| красный
| синий
| 5,0—8,0
| | Метиловый красный
| красный
| жёлтый
| 4,4—6,2
| | Метиловый оранжевый
| розовый, жёлтый
| жёлтый
| 3,0—4,4
| | Бромфеноловый синий
| красный
| синий
| 3,0—4,6
| | Тропеолин
| -
| жёлтый
| 1,4—3,2
| Металлоиндикаторы
Окислительно-восстановительные индикаторы
Окислительно-восстановительные индикаторы изменяют цвет в зависимости от присутствия в растворе окислителей или восстановителей. Дифениламин бесцветен в восстановленной форме, но имеет фиолетовый цвет в окисленном состоянии. Некоторые ярко окрашенные вещества сами могут служить индикатором. Например, при перманганатометрическом определении железа(II)
10FeSO4 + 2KMnO4+ 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
добавляемый в ходе титрования раствор перманганата обесцвечивается, пока не будут окислены все ионы Fe2+, имевшиеся в исследуемом растворе. Точка эквивалентности определяется по розовой окраске раствора, из-за возникшего избытка перманганат-анионов.
Хингидрон также является окислительно-восстановительным индикатором. это смесь хинона и гидрохинона.
Адсорбционные индикаторы[
Крахмал
Термоиндикаторы
Химические индикаторы влажности
|