
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Рассчитать T(HCl/CaO);KMnO/FeСодержание книги
Поиск на нашем сайте
Рассчитать МЭ [KMnO4] –(кислой среде Молярная масса эквивалента соли определяется отношением молярной массы соли к произведению числа атомов металла на его валентность М(КМnO4)=158г/моль Мэ (КМnO4)=158 / 1= 158 г/моль Растворимость осадков и факторы влияющие на растворимость осадков Растворимость осадков зависит от температуры, природы растворителя, ионной силы, наличия одноименных ионов и побочных реакций, а также от структуры осадка и степени его дисперсности. Можно показать графики, иллюстрирующие влияние некоторых факторов на растворимость (рис. VI-5, VI-6). В одном и том же растворителе влияние физических факторов незначительно по сравнению с химическими факторами, главным образом такими, как побочные реакции (комплексообразование, взаимодействие ионов осадка с ионами водорода).
Рис. VI-5. Зависимость растворимости хлорида серебра от концентрации одноименных ионов. Коэффициент побочной (конкурирующей) реакции комплексообразования с одним из ионов осадка можно рассчитать по формуле: 1 где а — коэффициент побочной реакции; а — равновесная концентрация лиганда; в—суммарная константа устойчивости. Расчетные формулы гравиметрии 1. Результат гравиметрического анализа рассчитывают по формуле где mo – масса определяемого вещества; m – масса гравиметрической формы; М(х) и М(г.ф.) – соответственно молярные массы определяемого вещества и гравиметрической формы (г/моль). Отношение М(х)/М(г.ф.)=Fназывают гравиметрическим фактором (гравиметрическим множителем) или фактором пересчета. Следовательно, x=mF При вычислении гравиметрического фактора необходимо учитывать стехиометрические коэффициенты в химических формулах определяемого вещества и гравиметрической формы, чтобы число атомов определяемого компонента в числителе и знаменателе дроби было одинаковым: Например, если определяемым веществом является Fe3O4, а гравиметрической формой Fe2O3, гравиметрический фактор будет равен Числовые значения факторов пересчета для большинства практически важных определений рассчитаны с высокой точностью и приведены в справочниках. Расчет определяемого вещества в граммах qA =mгр.ф∙F (30) Расчет определяемого вещества в процентах
Расчет навески определяемого вещества При определении кристаллических осадков
где МА и Мгр.ф. - молекулярные веса определяемого вещества и гравиметрической формы соответственно; m,n- стехиометрические коэффициенты. При определении аморфных осадков
Опытным путем было найдено, что 0,5 - 0,3 - практически удобная масса весовой формы вещества для кристаллических осадков (г); 0,1-0,2- практически удобная масса весовой формы вещества для аморфных осадков(г). Объем осадителя находим по формуле
где 1,5- const- коэффициент, найденный практическим путем (берется с учетом того, что осадитель по обыкновению является летучим веществом); МВ- молекулярный вес осадителя; МА- молекулярный вес определяемого вещества; а- навеска определяемого вещества, г; С - процентная концентрация; ρ- плотность г/см3. Расчетные формулы титриметрии 2. Нормальность (N) раствора- число грамм-эквивалентов вещества, содержащихся в 1 л раствора где а- навеска образца анализируемого вещества, г; Э- грамм-эквивалент; n- число грамм-эквивалентов; V- объем, мл. Если V=1л, то N · V=a Молярность (См) – число моль(грамм - молекул) растворенного вещества в 1л раствора
Если V=1л, то
Основное расчетное уравнение химического анализа NAVA=NBVB В момент эквивалентности химических реакций произведение нормальных концентраций на объемы растворов реагирующих веществ равны друг другу. При известной нормальной концентрации раствора вещества А можно рассчитать его титр ТА, перейдя к массе qА через эквивалентен ЭА.
qА- содержание определяемого вещества, г.
Рассчитать количество вещества в граммах можно по формуле: С учетом разбавления в мерной колбе VK и титрования аликвотной части исследуемого раствора Va.
Vа- объем аликвотной части раствора, мл. Рассчитать количество вещества в процентах можно по формуле
Поправочный коэффициент определяют и рассчитывают следующим образом
где К- поправочный коэффициент; пр- практическое значение; т- теоретическое значение.
Расчет содержания вещества методом обратного титрования Расчет содержания вещества обратным титрованием по методу отдельных навесок, %
где В –стандартный раствор, взятый с избытком; В1 – стандартный раствор, идущий на титрование раствора В. Расчет содержания вещества обратным титрованием по методу пипетирования, %
Расчет содержания вещества методом обратного титрования по титру, %
Переходные формулы для расчетов концентраций Формула для перехода от процентной концентрации к нормальной
Э – эквивалент, грамм – эквивалент; ρ – плотность г/см3. Формула для перехода от нормальной концентрации к процентной
Формула для перехода от процентной концентрации к молярной
Формула для перехода от молярной концентрации к процентной
Расчет ошибок кислотно-основного титрования Протонную ошибку можно рассчитать ОТ [Н+] ,%
где V- исходный объем определяемого вещества, мл; VD- объем добавленного титранта, мл; рТ- показатель титрования индикатора. Гидроксидную ошибку можно рассчитать ОТ [ОН-], %
Кислотная ошибка возникает,если при недотитровании слабых кислот в растворе остается небольшое количество кислоты в молекулярной форме (ОТА),%
Основная ошибка появляется при недотитровании слабого основания (ОТВ), %
В точке эквивалентности количество эквивалентов в смеси равно n Реакции титриметрии и требования к ним. 3. В титриметрии применяют различные химические реакции: кислотно-основные, окислительно-восстановительные, комплексообразования, а также так называемые реакции осаждения. приводящие к образованию осадка. К химической реакции титрования предъявляются следующие требования: 1) строгая стехиометричность, отсутствие побочных реакций; 2) высокая скорость; 3) практическая необратимость (Кр > 107), обеспечивающая количественное превращение реагирующих веществ в продукты реакции; 4) наличие подходящего индикатора или другого способа фиксирования ТЭ. Окислительно-восстановительное титрование основано на реакциях типа: aOx1 + bRed2 +... bОx2 + aRed1 +..., где Ox1 и Ох2 - окисленные формы соответственно титранта и определяемого вещества, Red1 и Red2 - их восстановленные формы, a, b, a, b-стехиометрические коэффициенты. Окислительно-восстановительные потенциалы, характеризующие титрант и определяемое вещество, соответственно имеют вид:
где и -реальные потенциалы пар соответственно Ox1/Red1 и Ox2/Red2 в данной системе, n-число электронов. участвующих в реакции, F- число Фарадея, R-универсальная газовая постоянная. Титрант действует как окислитель. если >, и как восстановитель, если >. В ходе титрования величина |Е1—Е2| уменьшается, а в точке эквивалентности Е1 = Е2. Титрование эффективно, если при этом отношение [Red2]/[Ox2] (в случае титрования окислителем) или обратное соотношение (в случае титрования восстановителем) мало. Для этого подбирают титрант так, чтобы было достаточно велико. В соответствии с тем, какое вещество служит титрантом, различают перманганатометрию, иодометрию, дихроматометрию. броматометрию и т. д. Конечную точку устанавливают, как правило, потенциометрически или с помощью окислительно-восстановительных индикаторов, а также по появлению или исчезновению окраски титранта или титруемого вещества. Метод, основанный на образовании устойчивых комплексных соединений катионов металлов с различными лигандами, называют комплексометрией. Конечную точку устанавливают с помощью металлохромных индикаторов или веществ, взаимодействующих с избытком реагента (лиганда). К комплексометрии относятся, в частности, комплексонометрия, методы, основанные на образовании иодидных комплексов Hg, фторидных комплексов Ag и Zr (фториметрия). Примерами осадительного титрования могут служить методы определения галогенидов с применением солей серебра, а также сульфатов с помощью растворимых солей Ва. В последнем случае осаждение BaSO4 ведут в смеси воды и метанола (1:1); индикатором служит ализариновый красный С, меняющий окраску при адсорбции на поверхности осадка. Реакция лежащая в основе гравиметрии (пример) В основе гравиметрии лежит реакция осаждения. Осаждение – это одна из основных операций гравиметрического анализа. Цель ее – перевести определяемую часть анализируемого вещества в химическое соединение, удобное для определения весовым способом. Например, барий в хлориде бария определяют в форме сульфата бария, Также необходимо чтобы осаждение происходило количественно, т.е. определяемый ион полностью переходил в осадок. Для этого выбранная осаждаемая форма, т.е. соединение, осаждаемое из раствора, должна обладать очень малой растворимостью. Для количественного анализа выбирают соединения, произведение растворимости которых не превышает 108. Исходя из этого, подбирают и реактивы для осаждения. Осаждение ведут, приливая раствор осадителя в стакан с раствором анализируемого вещества при непрерывном перемешивании стеклянной палочкой. Полноту осаждения определяют после отстаивания осадка и образования над ним прозрачного раствора. К нему осторожно добавляют Редоксиметрия (полу-пара, пример: окислитель - восстановитель). Редокс-потенциал При титровании в методах окисления-восстановления происходят окислительно-восстановительные реакции. В качестве рабочих растворов в этих методах применяют растворы самых разнообразных окислителей и восстановителей. Всего в редоксиметрии известно около 50 методов. Их классифицируют по названию рабочего вещества. 1. Перманганатометрия KMnO4 2. Йодометрия Na2S2O3 (вспом. в-во KI) 3. Йодиметрия I2 4. Дихроматометрия (хроматометрия) K2Cr2O7 5. Броматометрия KBrO3 6. Йодатометрия KIO3 Окислительно-восстановительный потенциал Ион, проявляющий в реакции окислительные свойства, присоединив электроны, превращается в свою восстановленную форму:
Восстановленных форм у окислителя и окисленных форм у восстановителя может быть несколько. Это определяется природой окислителя и восстановителя и условиями протекания реакции. восст. – восстановленная или восстановителя; R - газовая константа, равна 8,314 Дж/моль . К; Т - абсолютная температура, К; n - число присоединяемых или отдаваемых электронов; F - число Фарадея, равное 96500 Кулонам; [окисл.] [восст.] - активность (в упрощенном варианте молярная концентрация) окисленной и восстановленной форм окислителя или восстановителя. Для расчетов в методах редоксиметрии (например, при построении кривых титрования) используется уравнение Нернста в упрощенном виде. Если температура, при которой производят расчет, составляет 25оС, то уравнение примет вид:
Редокс-пары-понятие, примеры. Редокс-пара - это система из окисленной и восстановленной форм данного вещества, в которой окисленная форма (окислитель) является акцептором электронов и восстанавливается, принимая электроны, а восстановленная форма выступает в роли донора электронов и окисляется, отдавая электроны. Следовательно, любая редокс-пара, потенциал которой при данных условиях лежит в пределах - 0 43 В Е 0 77 В, вызовет восстановление Fe до Fe2, не сопровождающееся образованием элементарного железа. Для индикации редокс-пары Н / Н2 применяют водородный электрод. Во избежание перенапряжения платинированную платиновую проволоку (или пластину) насыщают очищенным газообразным водородом и помещают в анализируемый раствор. В качестве эталонной редокс-пары (эталонного электрода) выбран водородный электрод: в его основе лежит обратимая полу - реакция.
Окислительно-восстановительный потенциал (редокс-потенциал от англ. redox — reduction-oxidation reaction, Eh или Eh) — мера способности химического вещества присоединять электроны (восстанавливаться[1]). Окислительно-восстановительный потенциал выражают в милливольтах (мВ). Примером окислительно-восстановительного электрода: Pt/Fe3+,Fe2+ Окислительно-восстановительный потенциал определяют как электрический потенциал, устанавливающийся при погружении платины или золота (инертный электрод) в окислительно-восстановительную среду, то есть в раствор, содержащий как восстановленное соединение (Ared), так и окисленное соединение (Aox). Если полуреакцию восстановления представить уравнением: Aox + n·e− → Ared, то количественная зависимость окислительно-восстановительного потенциала от концентрации (точнее активностей) реагирующих веществ выражается уравнением Нернста. Окислительно-восстановительный потенциал определяют электрохимическими методами с использованием стеклянного электрода с red-ox функцией и выражают в милливольтах (мВ) относительно стандартного водородного электрода в стандартных условиях.
|
||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 564; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.009 с.) |

 .
.

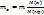 ,
, .
. .
. (31)
(31) , (32)
, (32) (33)
(33) ,
,  (34)
(34) ,
,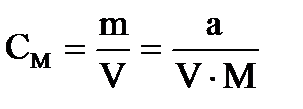 где М- масса 1моль растворенного вещества.
где М- масса 1моль растворенного вещества.

 , где Т- титр, г/см3, г/мл
, где Т- титр, г/см3, г/мл , где А- определяемое вещество;
, где А- определяемое вещество;



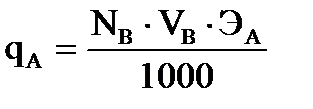 где В–титрант.
где В–титрант. , где VК- емкость мерной колбы, мл;
, где VК- емкость мерной колбы, мл;
 ,
,
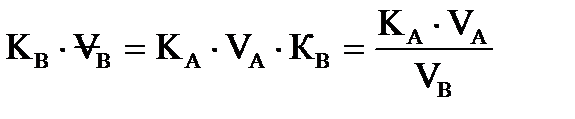
 ,
,

 , где C – процентная концентрация;
, где C – процентная концентрация;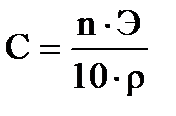 , где n – число эквивалентов.
, где n – число эквивалентов.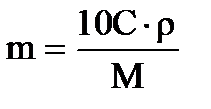 , где M – молекулярный вес.
, где M – молекулярный вес. , где m – число моль.
, где m – число моль. ,
,
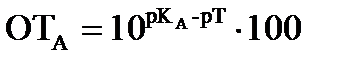

 + n
+ n  = n
= n 
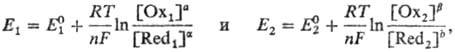


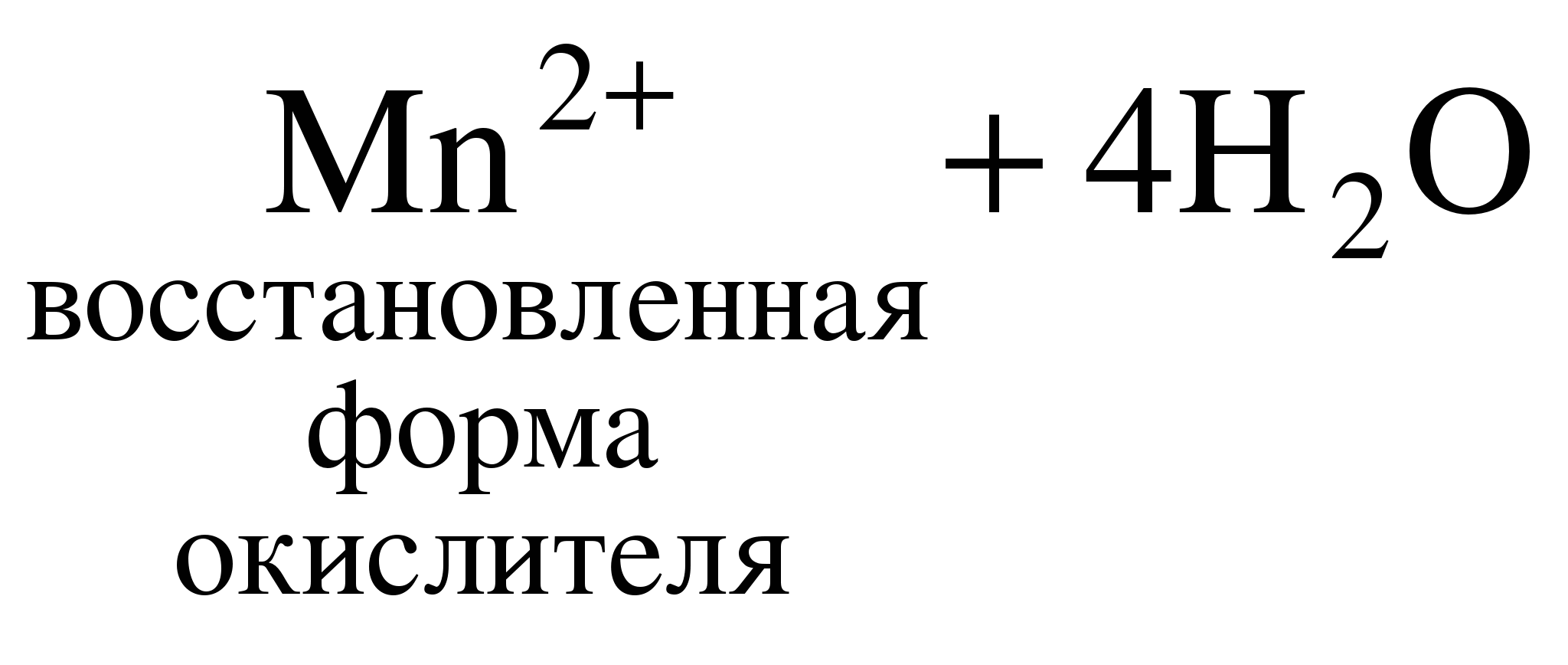 .
.
 .
.
 где
где  - потенциал окислителя или восстановителя;
- потенциал окислителя или восстановителя; .
.  .
. 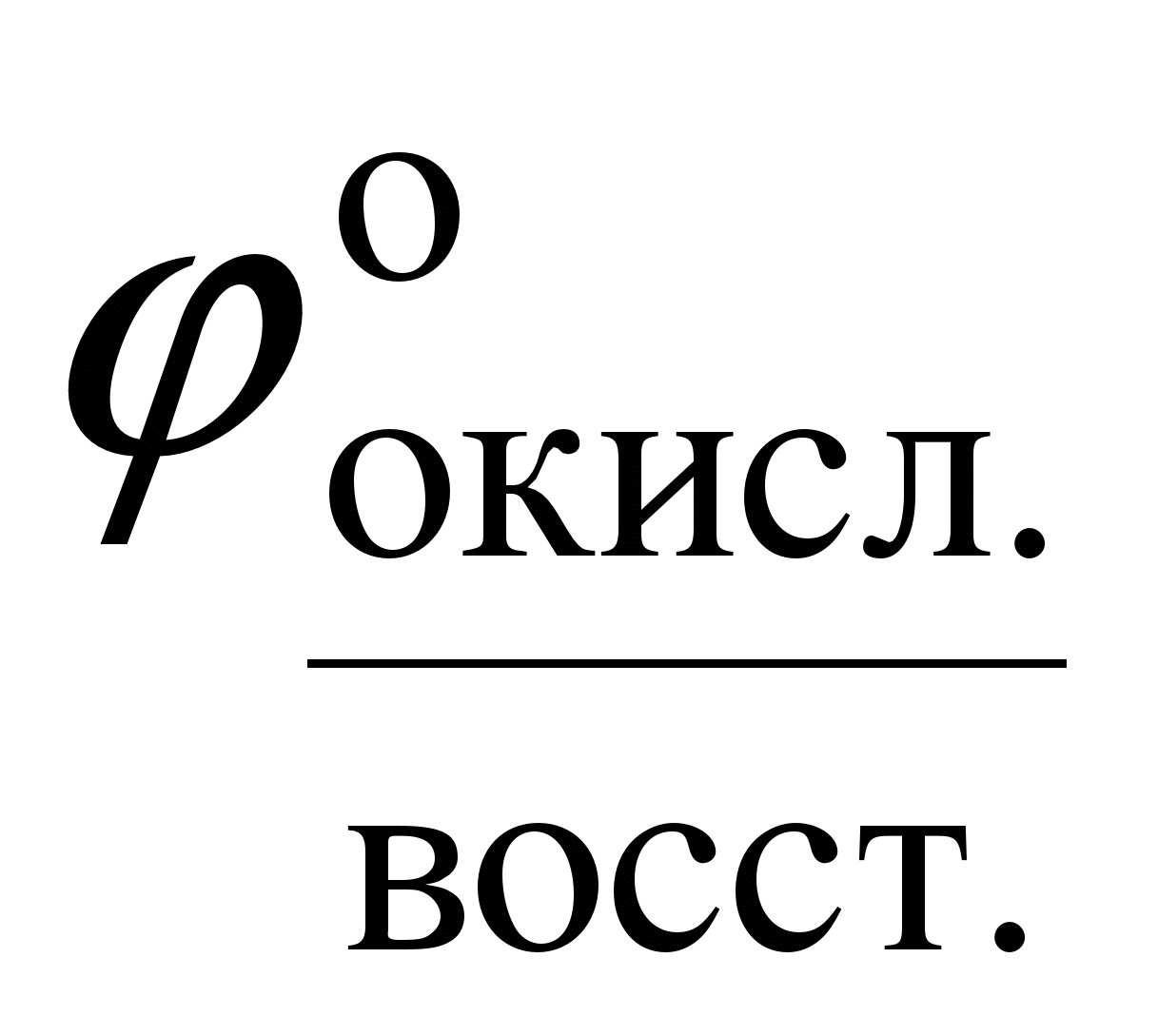 - стандартный потенциал, его называют также нормальным потенциалом, является постоянной, т.е. табличной величиной, измеренной при стандартных условиях (Т = 298 К, Р =
- стандартный потенциал, его называют также нормальным потенциалом, является постоянной, т.е. табличной величиной, измеренной при стандартных условиях (Т = 298 К, Р =  Па, С = 1 моль/дм3).
Па, С = 1 моль/дм3).


