
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Характеристика-полярограммы.Содержание книги
Поиск на нашем сайте
Если в растворе присутствует несколько электрохимически активных соединений, на полярограмме наблюдается соответствующее число волн (рис. 4.13). Потенциалы полуволн и значения предельных диффузионных токов, зарегистрированных на такой полярограмме, совпадают с аналогичными величинами, полученными для растворов индивидуальных соединений такой же концентрации. Полярограммы могут быть искажены за счет полярографических максимумов — резкого возрастания тока выше его предельного значения с последующим спадом. Причины возникновения максимумов различны, и могут быть связаны с неравномерной поляризацией ртутной капли и тангенциальным движением ее поверхности, что приводит к дополнительному перемешиванию раствора. Такого рода максимумы можно устранить введением в полярографический раствор ПАВ: красителей (метиловый красный, фуксин и др.), высокомолекулярных соединений (агар-агар, желатин). ПАВ адсорбируются на поверхности ртутной капли, изменяя ее поверхностное натяжение, и тем самым устраняют неравномерное движение приповерхностных слоев. Кроме того, на полярограммах возникают кислородные максимумы: растворенный в анализируемом растворе кислород восстанавливается на ртутном электроде в две стадии образуя две волны на полярограммах соответственно при —0,1 и ~0,9 В. Интерпретация полярограммы, осложненной волнами восстановления кислорода, затруднительна, поэтому перед поляро-графированием из анализируемого раствора кислород удаляют, продувая анализируемый раствор азотом или аргоном, в щелочных средах можно использовать кристаллический Na2SO3. При анализе водных растворов достаточна 5—10-минутная деаэрация, растворы в органических растворителях деаэрируют в течение 25—30 мин. Полярографирование анализируемого раствора следу-ет проводить после анализа фонового электролита и удаления из чего кислорода: на полярограмме должны отсутствовать какие-ли-
Дифференциальная полярография основана на дифференцировании обычных поляро-грамм и получении зависимости й1/йЕ = /(Е). На такой поляро-грамме появляются четко выраженные максимумы, соответствующие потенциалам полуволн окисляющихся или восстанавливающихся ионов в анализируемой смеси. Дифференциальную полярографию используют при анализе смеси ионов с близкими значениями Е1/2.
Дифференциальную полярограмму получают графическим дифференцированием обычной полярограммы или дифференцированием ее самим полярографом с автоматической записью на самописце прибора.
Типичный вид дифференциальной полярограммы приведен на рис. 10.2.
Инверсионная полярография катионов или анионов основана на выделении путем электролиза из раствора и концентрирования анализируемых ионов в висящей капле ртути микроэлектрода или на поверхности твердого электрода с последующим затем электролизным растворением образовавшихся продуктов. На кривой зависимости тока растворения от напряжения образуется «перевернутый пик», глубина которого к пропорциональна концентрации анализируемого иона. Типичный вид такой кривой Рис. 10.3. Инверсионная поляро-приведен на рис.10.3. грамма
Инверсионную полярографию применяют при анализе очень разбавленных растворов — до 10-9 моль/дм3. Однако время анализа при этом резко возрастает и составляет несколько десятков минут. Другой важной характеристикой полярограммы является потенциал полуволны (Е 1/2) - потенциал, при котором ток равен половине величины диффузионного тока. Е 1/2 не зависит от силы тока и концентрации восстанавливающегося иона. Потенциал полуволны является качественной характеристикой иона, т.е. зависит от его природы. Определение Е 1/2 составляет основу качественного полярографического анализа. Значение Е 1/2 для одного и того же иона зависит от природы, концентрации и рН фонового электролита, наличия в растворе комплексообразователей. Например, в 1 М КСl E 1/2 (Pb2+) = - 0,44 B, в 1М NaOH E1/2 (Pb2+) = - 0,76 В. Хромофоры – примеры. Хромофорная теория индикатора. 5. Хромофоры — ненасыщенные группы атомов, обуславливающие цвет химического соединения. В то же время поглощающие электромагнитное излучение независимо от наличия окраски. Так, карбонильная группа C=O является хромофором, поглощающим в области 280 нм, в то же время кетоны, содержащие С=O – бесцветные вещества. К хромофорам относят азогруппу —N=N—, нитрогруппу —NO2, нитрозогруппу —N=O, карбонильную группу =С=О, сопряженные системыдвойных связей, хиноидные группировки и др. Хромофорная теория возникновения окраски была предложена в 1878 г. немецким ученым Виттом. Хромофорная теория может быть применена для двухцветных индикаторов. Однако наиболее простой для них является теория Оствальда. Согласно хромофорной теории хромофор одним своим присутствием сообщает бесцветной молекуле окраску; но это действие хромофора проявляется или усиливается при посредстве ауксохромной, например, гидроксильной группы. Тот факт, что соли нитрофенолов всегда окрашены много интенсивнее, чем свободные соединения, объяснялся по хромофорной теории тем, что ауксохромная природа гидроксильной группы проявляется только путем солеобразования. Из основ хромофорной теории цветности следовало, что при образовании окрашенного соединения необходимо учитывать лишь наличие в соединении хромофорных и ауксохромных группировок. Ароматическое же ядро, входящее в состав хромогена, оставлялось при этом без внимания, и считалось, что оно остается таким же, каким было в исходном бесцветном соединении. Ошибочность этого взгляда может показать следующий пример: известно, что парабен-зохинон (I) окрашен в желтый цвет, а продукт его гидрирования циклогександион-1 4 (II) - бесцветный, хотя в нем и сохраняются две хромофорные карбонильные группы. Восстановление парабен-зохинона в гидрохинон (III) также вызывает переход желтого соединения в бесцветное. Чем характеризуется оптическая активность веществ. Примеры оптически активных веществ. Оптическая активность вещества характеризуется постоянной величиной, которая называется удельным вращением. Величину отклонения плоскости поляризации от начального положения, выраженную в угловых градусах, называют углом вращения и обозначают греческой буквой а. Угол вращения зависит от природы и толщины оптически активного вещества, температуры, природы растворителя и длины волны света. Для сравнительной оценки способности различных веществ вращать плоскость поляризации света вычисляют удельное вращение [a]D>.. УЭеяьное вращение — это константа оптически активного вещества, вращение плоскости поляризации монохроматического света, вызванное слоем оптически активного вещества толщиной 1 дм при пересчете на содержание 1 г вещества в 1 мл объема: [a]t = 100а где а — измеряемый угол вращения, град; D — длина волны монохроматического света; t — температура, при которой проводилось измерение; / — толщина слоя, дм; С —концентрация раствора, выраженная в граммах вещества на 100 мл раствора. Обычно определение удельного вращения проводят при 20 °С и длине волны, соответствующей D-линии натрия (À, = 589,3 нм). Для жидких веществ удельное вращение [а]Р =, где d — плотность жидкого вещества, г/мл. Часто вместо удельного вращения рассчитывают молярное ера-ù^Hèe [M ](по следующей формуле: t = МРM к 100 ' где M — молекулярная масса. Измерение угла вращения производят с помощью иоляримеяг-рое (рис. 1.101), которые позволяют получать результаты с точностью ±0,02° Пример - известный в стереохимии асимметричный атом углерода, окружённый четырьмя разными заместителями; такова асиарагиновая к-та (рис. 2). Хирофоров в молекуле может быть несколько, тогда сказывается их взаимное влияние. Известен ряд функциональных групп (напр., карбонильная), в свободном состоянии симметричных и не имеющих ОА, но легко деформируемых асимметричными возмущениями со стороны др. частей молекулы.
Что называетсяя аналитическим сигналом (определение, формула) Любой метод аналитической химии основан на получении сигнала при воздействии на вещество. Сигнал, дающий информацию о химическом составе вещества, называется аналитическим сигналом Аналитическим сигналом называется комплексный сигнал вида z(t)=s(t) +j Что называют дисперсией. Дисперсией называется зависимость скорости распространения электромагнитных волн от их частоты. Так как скорость света в веществе зависит от показателя преломления (v = c/n), то дисперсией можно назвать также зависимость от частоты абсолютного показателя преломления вещества. Дисперсия света открыта Ньютоном. Его опыт состоит в следующем: узкий солнечный луч, проходя через призму, дважды преломляется на ее гранях и разлагается на разноцветные лучи
Результаты опыта свидетельствуют о том, что:
|
||||||||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 474; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.116.93 (0.01 с.) |



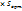 (t)
(t)




