Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основное условие амперометрического титрированияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Амперометрическое титрование - это метод анализа, возникший на основе классической полярографии. В нем предельный диффузионный ток используют для нахождения точки эквивалентности при проведении титрования. Амперометрическое титрование возможно только при условии электроактивности (способности разряжаться на электроде) определяемого вещества или вещества титранта или хотя бы одного продукта их реакции. Для проведения амперометрического титрования аликвотную часть анализируемого раствора помещают в электролизер. В раствор опускают РКЭ или твердый (чаще всего платиновый) микроэлектрод и электрод сравнения. На электроды подают напряжение, отвечающее области предельного тока электроактивного вещества, и проводят титрование. После добавления из бюретки каждой отдельной порции титранта отмечают силу тока. Пусть электроактивным является определяемое вещество, например, Pb2+, тогда добавление титранта (H2SO4), реагирующего с ним, будет уменьшать концентрацию определяемого вещества в растворе, в соответствии с этим будет уменьшаться и предельный диффузионный ток.
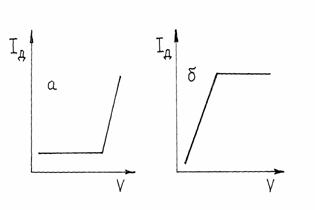
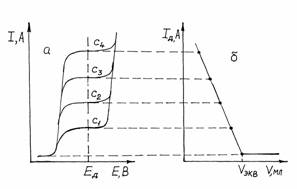
Рис. 5. Схема получения кривой амперометрического титрования (б) электроактивного определяемого вещества по его полярограммам (а) при концентрациях Поскольку предельный диффузионный ток, согласно уравнению Iд = К×С, пропорционален концентрации, то амперометрические кривые титрования, построенные в координатах Iд - V, являются линейными (рис.2.14.4). По ним графически находят объем титранта в точке эквивалентности (Vэкв). Значение напряжения, при котором следует проводить титрование, предварительно устанавливают по полярограммам анализируемого раствора, титранта или раствора продуктов реакции. Если электроактивным является вещество титранта, то ток останется практически равным нулю, пока не будет достигнута конечная точка титрования и не появится в растворе избыток титранта. Начиная с этого момента, ток будет расти. Такую кривую титрования можно получить, напри - мер, при титровании ионов цинка раствором K4 [Fe(CN) 6], окисляющегося на платиновом электроде (рис. 6, а). Титрование возможно, если электроактивен образующийся продукт реакции определяемого вещества и титранта. Кривая титрования тогда имеет вид, изображенный на рис. 6, б.
Рис. 6. Кривые амперометрического титрования при электроактивном титранте (а) или продукта реакции титрования (б). Для амперометрического титрования пригодны реакции комплексообразования, осаждения, а также редоксиреакции. Концентрация титруемого раствора обычно порядка 10-3 моль/л. Определять можно не только неорганические, но и органические вещества (например, фенолы). Метод значительно проще, экспресснее и доступнее полярографии и вольтам перометрии. Основной закон поглощения (закон Бутлера-Ламберта-Бера) Индикатор — соединение, позволяющее визуализировать изменение концентрации какого-либо вещества или компонента, например, в растворе при титровании, или быстро определить pH, еН и др. параметры. Существуют также химические индикаторы для самых различных специальных целей, например, для определения дозы облучения. Применение индикаторов Индикаторы позволяют быстро и достаточно точно контролировать состав жидких или газообразных сред, следить за изменением их состава, или за протеканием химической реакции. Широко используются кислотно-основные индикаторы, разбавленные растворы которых обладают способностью заметно изменять цвет, в зависимости от кислотности раствора. Причина изменения цвета — изменения в строении молекул индикатора в кислой и щелочной среде, что приводит к изменению спектра поглощения раствора. Для определения состава газовых сред используют индикаторные бумажки и индикаторные трубки. Структура молекул и цвет индикаторов. Трифенилметановые красители-индикаторы
Структура трифенилметановых красителей Трифенилметановые красители широко используются в качестве индикаторов. В зависимости от типа заместителей изменения структуры молекулы приводят к широкой гамме цветных соединений, большинство из которых могут служить химическими индикаторами.
Производные азобензола
Виды индикаторов · Кислотно-основные индикаторы · Редокс-индикаторы, Ох- и Red-формы которых имеют различный цвет · Металлоиндикаторы · Адсорбционные индикаторы Распространённые кислотно-основные индикаторы
Металлоиндикаторы Окислительно-восстановительные индикаторы Окислительно-восстановительные индикаторы изменяют цвет в зависимости от присутствия в растворе окислителей или восстановителей. Дифениламин бесцветен в восстановленной форме, но имеет фиолетовый цвет в окисленном состоянии. Некоторые ярко окрашенные вещества сами могут служить индикатором. Например, при перманганатометрическом определении железа(II) 10FeSO4 + 2KMnO4+ 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O добавляемый в ходе титрования раствор перманганата обесцвечивается, пока не будут окислены все ионы Fe2+, имевшиеся в исследуемом растворе. Точка эквивалентности определяется по розовой окраске раствора, из-за возникшего избытка перманганат-анионов. Хингидрон также является окислительно-восстановительным индикатором. это смесь хинона и гидрохинона. Адсорбционные индикаторы[ Крахмал Термоиндикаторы Химические индикаторы влажности
Основной закон титриметрии. Титриметрия (от франц. titre- качество, характеристика и греч. metreo-измеряю), совокупность методов количественного анализа, основанных на измерении количества реагента, необходимого для взаимодействия с определяемым компонентом в растворе или газовой фазе в соответствии со стехиометрией химической реакций между ними. При проведении эксперимента можно контролировать либо объем, либо массу добавляемого титранта-раствора или газовой смеси с точно известной концентрацией Ст реагента. Наибольшее распространение получила титриметрия для экспрессного определения высоких и средних концентраций веществ в растворах, в том числе неводных. Точно известный объем V анализируемого раствора с помощью пипетки помещают в коническую колбу и к нему прибавляют небольшими порциями титрант из бюретки (калиброванная стеклянная трубка с клапанным устройством, например краном, на оттянутом конце), тщательно перемешивая раствор в колбе. Эту операцию называют титрованием. Массовые титриметрические анализы обычно проводят с помощью титраторов. В титриметрии концентрацию определяют, измеряя объем стандартного или титрованного реагента (титранта), израсходованного в химической реакции с определяемым веществом в растворе (или газовой фазе). Измерение проводят с помощью процедуры титрования. Процесс титрования сопровождается изменением равновесных концентраций реагента, определяемого вещества и продуктов реакции. Это удобно изобразить графически в виде титриметрия называют кривой титрования в координатах концентрация определяемого вещества (или пропорциональная ей величина)-объем (масса) титранта. Измерив объем Vт титранта в конце титрования, рассчитывают концентрацию С анализируемого раствора по формуле: CV= CтVт (концентрации выражены в моль/л). Теоретически необходимо добавить такой объем титранта, который содержит количество реагента, эквивалентное количеству определяемого компонента в соответствии со стехиометрией реакции между ними при условии, что эта реакция практически необратима. Этот объем титранта соответствует точке эквивалентности (т. э.), или моменту стехиометричности. Практически определяют, однако, не т.э., а конечную точку титрования (к.т.т.), которая должна максимально совпадать с т.э. для получения минимальной погрешности титрования. Фиксировать к.т.т. можно по изменению окраски добавленного индикатора (выбор которого осуществляют по теоретически рассчитанной кривой титрования) или по достаточно резкому изменению каких-либо физические характеристики раствора, зависящей от концентрации определяемого вещества - тока, окислительно-восстановительного потенциала, оптической плотности, электрической проводимости и количества электричества. Соответственно различают амперометрическое титрование, потенциометрической, фотометрическое, кондуктометрической и кулонометрическое титрование (см. Потенциометрия. Фотометрический анализ, Кондуктометрия и Кулонометрия). В этих титриметрических методах кривая титрования представляет собой зависимость измеряемой физической величины от объема (или массы) титранта.
Закон эквивалентов Закон эквивалентов: Все вещества реагируют и образуются в эквивалентных соотношениях. Эквивалентное соотношение означает одинаковое число моль эквивалентов. Т.о. закон эквивалентов можно сформулировать иначе: число моль эквивалентов для всех веществ, участвующих в реакции, одинаково. Рассмотрим реакцию взаимодействия гидроксида алюминия с серной кислотой: 2Al(OH)3+3H2SO4= Al2(SO4)3+6H2O.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 797; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.011 с.) |

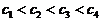 .
.