
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Сущность методы окисления-восстановления.Содержание книги
Поиск на нашем сайте
СУЩНОСТЬ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ Окислительно-восстановительные процессы принадлежат к числу наиболее распространенных химических реакций и имеют огромное значение в теории и практике. Окисление-восстановление—один из важнейших процессов природы. Дыхание, усвоение углекислого газа растениями с выделением кислорода, обмен веществ и ряд других химических процессов в основе своей являются окислительно-восстановительными реакциями. Сжигание топлива в топках паровых котлов и двигателях внутреннего сгорания, электролитическое осаждение металлов, процессы, происходящие в гальванических элементах и аккумуляторах, включают реакции окисления-восстановления. Получение элементарных веществ (железа, хрома, марганца, золота, серебра, серы, хлора, йода и т.д.) и ценных химических продуктов (аммиака, щёлочей, азотной, серной и других кислот) основана на окислительно-восстановительных реакциях. На окислении-восстановлении в аналитической химии основаны методы объёмного анализа: перманганатометрия, йодометрия, броматометрия, и другие, играющие важную роль при контролировании производственных процессов и выполнении научных исследований. В органической химии для проведения ряда химических превращений самое широкое распространение нашли процессы окисления- восстановления. Инертные газы лишь в исключительных случаях способны вступать в окислительно-восстановительные реакции. Сущность нефелометрии. Нефелометрия (от др.-греч. νεφέλη — «облако» и μετρέω — «измеряю») — метод исследования и анализа вещества по интенсивности светового потока, рассеиваемого взвешенными частицами данного вещества. Суть метода Интенсивность рассеянного светового потока зависит от множества факторов, в частности от концентрации частиц в анализируемой пробе. Большое значение при нефелометрии имеетобъём частиц, рассеивающих свет. Важное требование к реакциям, применяемым при нефелометрии, заключается в том, что продукт реакции должен быть практически нерастворим и представлять собой суспензию (взвесь). Для удержания твёрдых частиц во взвешенном состоянии применяются различные стабилизаторы (например, желатин), предотвращающиекоагуляцию частиц. Реализация процесса См. также: Нефелометр Для измерения интенсивности рассеянного света используются специальные приборы — нефелометры. Их действие основано на уравнивании двух световых потоков: одного от рассеивающей взвеси, другого от матового или молочного стеклянного рассеивателя прибора. Один из вариантов нефелометрии — нефелометрическое титрование, в котором растворанализируемого вещества титруют раствором осадителя. В процессе титрования интенсивность рассеянного света увеличивается пропорционально количеству образующихся частиц. В точке эквивалентности рост помутнения прекращается. По излому кривой титрования находят объём затраченного на реакцию осадителя. Погрешность при этом составляет от 5 до 10 %. Применение Нефелометрия используется преимущественно для определения хлоридов (в виде взвеси AgCl), сульфатов (в виде взвеси BaSO4) при анализе различных материалов, например руд,минералов. Нефелометрию также применяют для определения размеров и формы диспергированных частиц, молекулярной массы полимеров, изучения коагуляции. 181 Сущность нефелометрии Нефелометрия (от др.-греч. νεφέλη — «облако» и μετρέω — «измеряю») — метод исследования и анализа вещества по интенсивности светового потока, рассеиваемого взвешенными частицами данного вещества. Суть метода Интенсивность рассеянного светового потока зависит от множества факторов, в частности от концентрации частиц в анализируемой пробе. Большое значение при нефелометрии имеетобъём частиц, рассеивающих свет. Важное требование к реакциям, применяемым при нефелометрии, заключается в том, что продукт реакции должен быть практически нерастворим и представлять собой суспензию (взвесь). Для удержания твёрдых частиц во взвешенном состоянии применяются различные стабилизаторы (например, желатин), предотвращающиекоагуляцию частиц. Реализация процесса Для измерения интенсивности рассеянного света используются специальные приборы — нефелометры. Их действие основано на уравнивании двух световых потоков: одного от рассеивающей взвеси, другого от матового или молочного стеклянного рассеивателя прибора. Один из вариантов нефелометрии — нефелометрическое титрование, в котором растворанализируемого вещества титруют раствором осадителя. В процессе титрования интенсивность рассеянного света увеличивается пропорционально количеству образующихся частиц. В точке эквивалентности рост помутнения прекращается. По излому кривой титрования находят объём затраченного на реакцию осадителя. Погрешность при этом составляет от 5 до 10 %. Применение Нефелометрия используется преимущественно для определения хлоридов (в виде взвеси AgCl), сульфатов (в виде взвеси BaSO4) при анализе различных материалов, например руд,минералов. Нефелометрию также применяют для определения размеров и формы диспергированных частиц, молекулярной массы полимеров, изучения коагуляции 182 Титр, титрование, аликвота – понятие и формула Титр раствора (от фр. titre — качество, характеристика) — способ выражения концентрации, применяемый, в основном, в аналитической химии. Обозначается заглавной латинской буквой T (тэ). Измеряется в г/мл (г/см³). Различают титр по растворённому веществу и титр по определяемому веществу (условный титр). Титр по растворённому веществу или просто титр — масса растворённого вещества (в граммах), содержащаяся в одном миллилитре (см³) раствора. Рассчитывается по формуле:
где
Титр по определяемому веществу или условный титр — масса какого-либо вещества (в граммах), реагирующая с одним миллилитром данного раствора. Иными словами: масса определяемого вещества, оттитровываемая одним миллилитром раствора.Титр связан с молярной концентрацией эквивалента соотношением: Т(х) = Сэ(х) × Мэ (х) / 1000 Титриметрический анализ (титрование) — метод количественного/массового анализа, который часто используется в аналитической химии, основанный на измерении объёма раствора реактива точно известной концентрации, расходуемого для реакции с определяемым веществом. Титрование — процесс определения титра исследуемого вещества. Титрование производят с помощью бюретки, заполненной титрантом до нулевой отметки. Титровать, начиная от других отметок, не рекомендуется, так как шкала бюретки может быть неравномерной. Заполнение бюреток рабочим раствором производят через воронку или с помощью специальных приспособлений, если бюретка полуавтоматическая. Конечную точку титрования (точку эквивалентности) определяют индикаторами или физико-химическими методами (по электропроводности, светопропусканию, потенциалу индикаторного электрода и т. д.). По количеству пошедшего на титрование рабочего раствора рассчитывают результаты анализа. Аликвота — точно измеренная кратная часть образца (объём раствора), взятая для анализа, которая сохраняет свойства основного образца. 183,184 Точка эквивалентности и способы его фиксации Точка эквивалентности (в титриметрическом анализе) — момент титрования, когда число эквивалентов добавляемого титранта эквивалентно или равно числу эквивалентов определяемого вещества в образце. В некоторых случаях наблюдают несколько точек эквивалентности, следующих одна за другой, например, при титровании многоосновных кислотили же при титровании раствора, в котором присутствует несколько определяемых ионов. На графике кривой титрования присутствует одна или несколько точек перегиба, соответствующих точкам эквивалентности. Методы определения точки эквивалентности С помощью индикаторов Это вещества, изменяющие свой цвет вследствие протекания химических процессов. Кислотно-основные индикаторы, например фенолфталеин, изменяют свой цвет в зависимости отpH раствора, в котором они находятся. Редокс-индикаторы изменяют свой цвет вслед за изменением потенциала системы, используются таким образом при окислительно-восстановительном титровании. Перед началом титрования в исследуемый раствор добавляют несколько капель индикатора и начинают по каплям добавлять титрант. Как только раствор вслед за индикатором изменяет свой цвет, титрование прекращают, этот момент приблизительно и есть точка эквивалентности. Правило выбора индикатора - при титровании используется такой индикатор, который изменяет свою окраску около точки эквивалентности, т.е. интервал перехода окраски индикатора должен по возможности совпадать со скачком титрования. Потенциометрия В данном случае используют прибор для измерения электродного потенциала раствора. При достижении точки эквивалентности потенциал рабочего электрода резко изменяется. С помощью pH-метров pH-метр по сути своей также является потенциметром, в котором используется электрод, потенциал которого зависит от содержания в растворе ионов H+, это пример использованияионоселективного электрода. Таким образом можно следить за изменением pH в течение всего процесса титрования. При достижении точки эквивалентности pH резко изменяется. Данный способ более точный по сравнению с титрованием с использованием кислотно-основных индикаторов, и может быть легко автоматизирован. Проводимость Проводимость раствора электролитов зависит от находящихся в нем ионов. Во время титрования проводимость часто значительно изменяется (Например, при кислотно-основном титровании, ионы H+ и OH− взаимодействуют, образуя нейтральную молекулу H2O, что вызывает изменение проводимости раствора). Общая проводимость раствора зависит и от других присутствующих ионов (например, противоинов), которые вносят в нее различный вклад. Он, в свою очередь, зависит от подвижности каждого иона и от общей концентрации ионов (ионной силы). В связи с этим предсказать изменение проводимости гораздо сложнее, нежели измерить ее. Изменение цвета При протекании некоторых реакций происходит изменение цвета и без добавления индикатора. Чаще всего это наблюдается при окислительно-восстановительном титровании, когда исходные вещества и продукты реакции имеют разные цвета в разных степенях окисления. Осаждение Если во время реакции образуется твердое нерастворимое вещество, то по окончании титрования образуется преципитат. Классическим примером такой реакции является образование крайне нерастворимого хлористого серебра AgCl из ионов Ag+ и Cl−. Удивительно, но это не позволяет точно определить момент окончания титрования, поэтомуосадительное титрование чаще всего используют в качестве обратного титрования. Изотермическое калориметрическое титрование Используется изотермический титровальный калориметр, который по величине тепла, которое выделила или поглотила реагирующая система, определяет точку эквивалентности. Данный способ важен в биохимическом титровании, например, для определения того, как ферментный субстрат связывается с ферментом. Термометрическая титриметрия Термометрическая титриметрия — чрезвычайно гибкая техника. Она отличается от калориметрической титриметрии тем, что теплота реакции, о которой свидетельствует падение или рост температуры, не используется для определения количества содержащегося в исследуемом образце раствора вещества. Напротив, точка эквивалентности определяется на основе области, в которой происходит изменение температуры. В зависимости от того, является реакция между титрантом и исследуемым веществом экзотермической или эндотермической, температура в течение процесса титрования будет, соответственно, возрастать или падать. Когда все исследуемое вещество прореагировало с титрантом, изменение области, в которой происходит рост или падение температуры, позволяет определить точку эквивалентности и изгиб на кривой температуры. Точно точку эквивалентности можно определить, взяв вторую производную кривой температуры: четкий пик будет указывать на точку эквивалентности. Спектроскопия Точку эквивалентности можно определить, измеряя абсорбцию света раствором во время титровании, если известен спектр продукта, титранта или исследуемого вещества. Относительное содержание продукта реакции и исследуемого вещества позволяют определить точку эквивалентности. При этом присутствие свободного титранта (указывающее на завершение реакции) можно обнаружить при очень малых величинах. Амперометрия Метод, позволяющий определить точку эквивалентности по величине тока при заданном потенциале. Величина тока вследствие реакции окисления/восстановления исследуемого вещества или продукта у рабочего электрода зависит от их концентрации в растворе. Точке эквивалентности соответствует изменение величины тока. Данный метод наиболее полезен, когда необходимо уменьшить расход титранта, например, при титровании галидов ионом Ag+. 185 Точка эквивалентности и точка конца титрование – понятие и их разница Точка эквивалентности (в титриметрическом анализе) — момент титрования, когда число эквивалентов добавляемого титранта эквивалентно или равно числу эквивалентов определяемого вещества в образце. В некоторых случаях наблюдают несколько точек эквивалентности, следующих одна за другой, например, при титровании многоосновных кислотили же при титровании раствора, в котором присутствует несколько определяемых ионов. Титрование – это постепенное прибавление титрованного раствора к анализируемому для определения точно эквивалентного количества. Момент титрования, когда количество добавленного титранта химически эквивалентно количеству титруемого вещества, называют точкой эквивалентности. Её можно заметить по изменению индикатора – специального вещества, которое вводят в титруемый раствор (внутренняя индикация). В области точки эквивалентности (т.э.) индикатор изменяет свой цвет, образует осадок или вызывает другой наблюдаемый эффект. В области т.э. индикатор изменяет свой цвет, образует осадок или вызывает другой наблюдаемый эффект. Момент титрования, когда наблюдается изменение индикатора, называется точкой конца титрования (т.к.т.). В идеальном случае т.э. и т.к.т. совпадают. Чем больше разница между ними, тем больше погрешность титрования при прочих равных условиях. Поэтому необходимо тщательно подходить к подбору индикатора. Требования к гравиметрической форме. 1)Постоянство химического состава; 2)Химическая устойчивость; 3)С меньшим содержанием определенного компонента 187 Требования к гравиметрической форме.(примеры)
1)Постоянство химического состава; 2)Химическая устойчивость; 3)С меньшим содержанием определенного компонента 188 Требования к осадителю.(примеры) Осадитель выбирают, исходя из требований предъявляемых к осадку. Полученный осадок должен, прежде всего, обладать меньшей растворимостью в воде. Например: ПРBaC2O4=1,6∙10-7; ПРBaSO4=1,1∙10-10; ПРBaCrO4=2,4∙10-10; ПРBaCO3=8∙10-9. Наименьшую величину ПР имеет BaSO4, поэтому ионы Ba2+ осаждают в сульфатах бария. Полученный осадок должен легко отфильтровываться и хорошо отмываться от примесей. Наконец, осаждаемая форма должна при прокаливании на цело превратиться в гравиметрическую форму. Абсолютно не растворимых веществ не существует, чтобы понизить концентрацию Ba2+ в растворе, т.е. добиться практически полного осаждения ионов Ba2+, нужно повысить концентрацию осадителя, т.е. ионов SO2- (необходим избыток H2SO4). Опытным путем установлено, что для полного осаждения иона достаточно - полуторного избытка осадителя. 189 Требования к осаждаемой форме. 1) ПР < 10-8; 2) Кристаллические и аморфные осадки; 3) Легко и быстро переходила в гравиметрическую форму. 190 Требование к осождаемым формам осадков (примеры) 2. Условия осаждения аморфных осадков: I) Осаждать: 1) из больших концентраций растворов - концентрированными растворами осадителя; 2) из горячих растворов – горячим раствором осадителя; 3) присутствие электролита коагулянта; 4) при быстром переливании осадка и перемешивании; 5) осадок необходимо быстро отфильтровать, во избежание загрязнения. II) Соосаждение – загрязнение осадителя, не зависимо от структуры и формы. 1) Адсорбция – поверхностное загрязнение 2) Окклюзия – внутреннее загрязнение (когда происходит захват примеси при формировании кристаллической решетки, захват трещинами и углублениями). 3) Изоморфизм – внутренне загрязнения, когда происходит обратное смешивание кристаллических решеток (NH4)2Fe(SO4)2; NH4Al(SO4)2∙4H2O – алюмоаммонийные квасцы. 3. Условия осаждения кристаллических осадко в: 1.Осаждение вести из разбавленных растворов и разбавленным раствором осадителя. 2.Прибавлять осадитель медленно по каплям. 3.Непрерывно перемешивать раствор во избежании местных пересыщений. 4.Вести осаждение из горячего раствора и нагретым раствором осадителя. 5.Фильтровать осадок только после охлаждения раствора и его созревания (для укрупнения кристаллов осадок под раствором оставляют на несколько часов). Созревание – это процесс укрупнения кристаллического осадка за счет растворения мелких кристаллов (старение). 191 Угол вращения плоскости поляризац ии- формулы, понятия. Вращение плоскости поляризации поперечной волны — физическое явление, заключающееся в повороте поляризационного вектора линейно-поляризованной поперечной волны вокруг её волнового вектора при прохождении волны через анизотропную среду. Волна может быть электромагнитной, акустической, гравитационной и т. д. Угол вращения плоскости поляризации ф - угол, на который повертывается плоскость поляризации при взаимодействии линейно поляризованного оптического излучения с веществом. Угол вращения плоскости поляризации, вызываемый раствором, в котором содержится 1 моль чистого антипода на литр (мольное вращение) - это стандартная и обязательная характеристика любого оптически активного соединения. Для измерения этой величины тоже применяют несложные оптические приборы - поляриметры. угол поворота плоскости поляризации прямо пропорционален толщине вращающего слоя: φ = αd, (5) где φ – угол поворота плоскости поляризации; d – толщина пройденного лучом света слоя вещества (толщина пластинки); α – угол вращения. Закон Био: Вращательная способность растворов прямо пропорциональна толщине слоя раствора и его концентрации: φ= [α]dc, (6) где [α] – постоянная вращения; d – толщина слоя; с – концентрация раствора. Из формулы (6) следует, что если известна величина [α], то, измеряя при данной толщине слоя d угол поворота плоскости поляризации φ, можно измерить концентрацию вещества в растворе. Оптически неактивные вещества под действием внешнего магнитного поля приобретают способность вращать плоскость поляризации линейно поляризованного света, распространяющегося вдоль направления поля, т. е. вещества становятся оптически активными. Этот эффект впервые был обнаружен в 1845 г. М. Фарадеем (Эффект Фарадея) и явился первым доказательством прямой связи оптических и электромагнитных процессов. Опыты Фарадея, а затем более точные и полные исследования французского математика М. Верде показали, что для изотропных немагнитных веществ (пира - и диамагнетиков) в области не очень сильных полей угол поворота плоскости поляризации (фарадеевского вращения) j пропорционален длине пути D линейно поляризованного монохроматического света в веществе и индукции В внешнего продольного постоянного магнитного поля:
Коэффициент V называется Постоянной Верде или Удельным магнитным вращением (Магнитной вращательной способностью). Удельное магнитное вращение аналогично вращению в оптически активных веществах зависит от свойств вещества и его физического состояния (в частности, плотности), длины волны излучения, слабо от его температуры Т. Зависимость постоянной Верде от длины волны также выражается законом Био: V = B 1/l2 + B 2/l4, где B 1 и B 2 – слабо зависят от температуры
192 Угол предельного падения и угол предельного преломления При переходе света из оптически более плотной среды в оптически менее плотную среду при увеличении угла падения направление преломленного луча приближается к границе раздела двух сред (рис. 6.14).
Луч, соответствующий случаю, когда преломленный луч – скользящий, выделен на рис. 6.15 желтым цветом. При углах падения, больших предельного (лучи красного цвета), преломленный световой поток отсутствует, вся переносимая этим лучом энергия остается в отраженном потоке. Для красного луча имеет место явление полного внутреннего отражения.
193, 194 Удельная и мольная рефракция. Понятие формула расчеты и назначение Удельная рефракция, величина, характеризующая электронную поляризуемость единицы массы вещества в высокочастотном электромагнитном поле световой волны. Удельная рефракция r вещества равна его рефракции молекулярной R, деленной намолекулярную массу М. Удельная рефракция может быть выражена через преломления показатель n вещества несколькими способами; чаще всего её записывают в виде Рефракция молярная (R) (от позднелат. refractio-преломление), произведение уд. рефракции г да мол. массу М: R = rМ. Уд. рефракция представляет собой отношение некоторой ф-ции f(n) показателя преломления л (см.Рефрактометрия) к плотности r вещества: r =f(n)/r. Величина г практически не зависит от температуры, давления и агрегатного состояния вещества. Из мн. предлагавшихся ф-ций f(n) наиб. распространение получила ф-ция Лоренца-Лоренца: f(n) = (n2 — 1)/(n2 + + 2). Вычисленные с ее использованием значения R пропорциональны среднейполяризуемости a молекул: R = (n2 — — 1)М/(n2 + 2)r = 2,522•1024a. Простая пропорциональность между R и a является, однако, лишь первым приближением, поскольку вывод ф-ции Лоренца-Лоренца основан на упрощающих предположениях. Более строгие соотношения между n, r и a включают специфические для каждого вещества параметры (эффективные радиусы молекул, коэф. изотермич. сжимаемости) и позволяют объяснить изменения R при высоких давлениях и температурах, а также небольшие отклонения от аддитивности молярной рефракции растворов хим. соединений (см. ниже). Молярная рефракция зависит от состава и структуры вещества и обладает свойством аддитивности, т.е. может быть представлена в виде суммы: R = SxkRk. В случае растворов xk-молярная доля k-гo компонента раствора с P.M. Rk; в случае хим. соединений xk-число фрагментов k-го вида с присущими им постоянными значениями Rk. Такими фрагментами м. б. ионы. атомы или атомные группировки; соответствующие им Rk называют ионными, атомными или групповыми рефракциями. Атомы одного элемента, но находящиеся в разных валентных состояниях или в разных функц. группах, имеют разл. значения Rk. Иногда необходимо вводить дополнит. слагаемые-инкременты рефракции циклов, двойных и тройных связей. например, инкременты связей С=С, С=С, трехчленного и четырехчленного углеродных циклов составляют соотв. 1,733, 2,398, 0,71 и 0,5. Значения R для лучей видимой области спектра определяются в осн. поляризуемостью внешних (валентных) оболочек, так что возможны расчеты молярной рефракции на основе констант Rk, приписываемых хим. связям определенного типа и называемых рефракциями связей или связевыми рефракциями. Между атомными рефракциями, инкрементами и рефракциями связей существуют простые мат. соотношения, причем упомянутые аддитивные величины практически не имеют преимуществ друг перед другом. Они позволяют рассчитывать R с точностью до 0,3-0,4 мл/моль для молекулбез эффектов сопряжения и с незначительно разветвленным углеродным скелетом. Наличие в молекулах сопряженных кратных связей может приводить к весьма существенному (неск. мл/моль) превышению экспериментально определенного значения R по сравнению с вычисленным. Такое превышение называют экзальтацией P.M. и используют при установлении структурных ф-л орг. соединений. Постоянные Rk находят обработкой достаточно большого числа эксперим. данных по измерению лир для представителей разл. гомологич. рядов. Молярную рефракцию определяют для подтверждения правильности установления элементного состава, выявления присутствия кратных связей и их сопряжения, идентификации геом. изомеров циклоалканов, анализа таутомеряых смесей. Корреляции R с др. физ.-хим. свойствами применяют для расчета ряда важных мол. параметров (дипольных моментов, энтальпий испарения и др.). Весьма важным является то обстоятельство, что формула удельного лучепреломления, формула Лорентца—Лоренца
(где п — наблюденный показатель преломления, a d — плотность вещества при той же температуре), дает выражение удельной рефракции R, независимой от температуры, давления и агрегатного состояния вещества. Удельная рефракция является мерой действительного объемамолекулы. Произведение R × M называется молекулярной рефракцией. Исследования Ландольта, Брюля и Канноникова показали, что молекулярная рефракция органических веществ, так же как и молекулярный объем, может быть выражена суммой величин атомных рефракций, изменяющихся на определенную величину в зависимости от характера связей атомовТак, например, атомная рефракция углерода (для желтой линии D натрия), равная 2,418, при условии, что атом углерода связан с другими атомамилишь простыми связями, увеличивается на определенную величину, если этот атом связан с другим углеродным атомом кратной связью. При наличии в молекуле кратных связей к молекулярной рефракции, вычисленной из атомных рефракций, добавляют соответствующий инкремент на каждую кратную связь. Для ацетиленовой связи этот инкремент больше, чем для этиленовой. Многие значения атомных рефракций остаются постоянными в органических соединениях разных классов. Поэтому сравнение найденноймолекулярной рефракции соединения, состав и молекулярный вес которого известны, с молекулярной рефракцией, вычисленной из атомных рефракций, часто дает представление о строении соединения, а иногда позволяет решить, каким из известных изомеров принадлежат те или иные возможные формулы. Для этого достаточно измерить показатель преломления и плотность вещества. Часто величина молекулярной рефракциипозволяет судить о чистоте соединения с известным строением. Как показывает опыт, инкременты кратных связей не всегда сохраняют постоянные значения. Сравнительно небольшие изменения строения (перемещения двойных связей друг относительно друга) могут вызывать изменения этих инкрементов, называемые экзальтацией. Так, например, экзальтацию молекулярной рефракции вызывает присутствие в молекуле сопряженных кратных связей. Таким образом, по наличию или отсутствию экзальтации можно судить о взаимном расположении кратных связей в молекуле. Удельную и молекулярную рефракцию твердых веществ можно определять врастворах. Для определения удельной рефракции пользуются соотношением
где Rx — искомая удельная рефракция растворенного вещества; С — процентное содержание его в растворе: R р и R — удельная рефракция раствора и чистого растворителя. Умножив найденную удельную рефракцию твердого вещества на его молекулярный вес, находят молекулярную рефракцию. Молекулярная рефракция является непосредственной мерой поляризуемости молекулы, т. е. подвижности зарядов под влиянием внешнего электрического поля (возбуждение светом, электрическим полем другой молекулы и т. д.). Зависимость между поляризуемостью и молекулярной рефракцией выражается уравнением
где MR — молекулярная рефракция: N — число Авогадро; α — поляризуемость. Знание поляризуемости имеет самое существенное значение не только для характеристики строения молекулы, но и для понимания теченияхимических реакций. 195 Удельная и молярная электропроводность и их взаимосвязь. Электропроводимость есть способность раствора или расплава электролита проводить электрический ток. Переносчиками электричества в этом случае являются ионы (проводники 2-го рода). Кондуктометрический метод исследования основан на изучении зависимости между электропроводимостью раствора и концентрацией ионов в этом растворе. В кондуктометрическом анализе измеряемым аналитическим сигналом является электропроводимость растворов. Электропроводимость раствора – это физическая величина, обратная его сопротивлению За единицу электропроводимости в СИ принят Сименс (См). Один Сименс равен электропроводимости проводника сопротивлением 1 Ом. Различают удельную Удельная электропроводимость – это электропроводимость Для электролитической ячейки, в которой производят измерения, отношение Эквивалентная (молярная) электропроводимость – это электропроводимость раствора, содержащего 1 моль эквивалентов растворенного электролита при расстоянии между электродами Предельная эквивалентная (молярная) электропроводимость ( При достижении предельной электропроводимости прекращается межионное взаимодействие, и ионы движутся независимо друг от друга:
где Подвижности ионов пропорциональны их абсолютным скоростям движения и рассчитываются по формулам:
где F – постоянная Фарадея; V – абсолютная скорость движения иона. Абсолютная скорость движения иона – это скорость передвижения иона к электроду, отнесенная к единице напряженности электрического поля. Скорость движения ионов в растворе зависит от их природы, температуры и природы растворителя, а именно: 1. Природа иона определяется его радиусом r и зарядом Z. Эти два фактора характеризуют поляризующую способность ионов по отношению к растворителю. В растворах скорость движения ионов определяется размерами сольватированных (гидратированных) ионов. Чем меньше радиус иона и больше заряд, тем большим поляризующим действием ион обладает. 2. Природа растворителя характеризуется диэлектрической постоянной D Е. С уменьшением величины D Е падает способность растворителя сольватировать ионы в растворе; электропроводимость раствора уменьшается, поскольку происходит уменьшение степени диссоциации веществ в малополярных растворителях. 3. С ростом температуры электропроводимость увеличивается на каждый градус на 2 % (вследствие уменьшения сольватной оболочки). Зная электропроводимость раствора электролита, можно рассчитать его термодинамические характеристики a и Связь степени диссоциации a и эквивалентной электропроводимости
где
|
||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 486; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.184.102 (0.018 с.) |

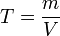
 — титр раствора (в г/мл)
— титр раствора (в г/мл) — масса растворённого вещества (в г)
— масса растворённого вещества (в г) — объём раствора (в мл)
— объём раствора (в мл) — закон Верде. (6)
— закон Верде. (6)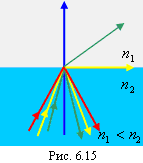 Когда угол падения превосходит некоторое предельное значение, падающий на границу раздела свет полностью отражается. Это явление называется полным внутренним отражением. Угол падения, при котором угол преломления равен
Когда угол падения превосходит некоторое предельное значение, падающий на границу раздела свет полностью отражается. Это явление называется полным внутренним отражением. Угол падения, при котором угол преломления равен  , называется предельным углом. Согласно (6.1) при переходе луча из оптически более плотной среды с показателем преломления
, называется предельным углом. Согласно (6.1) при переходе луча из оптически более плотной среды с показателем преломления 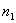 в оптически менее плотную среду с показателем преломления
в оптически менее плотную среду с показателем преломления 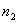 (
(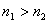 ) величина предельного угла определится из следующего соотношения:
) величина предельного угла определится из следующего соотношения: .
.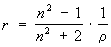 где r - плотность вещества.
где r - плотность вещества.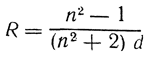


 [Ом-1 или См].
[Ом-1 или См]. и эквивалентную L электропроводимости.
и эквивалентную L электропроводимости.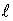 = 1 м:
= 1 м: 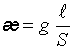 [Cм.м-1 или Ом-1 . м-1].
[Cм.м-1 или Ом-1 . м-1].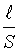 является постоянной величиной и называется константой ячейки. Размерность константы
является постоянной величиной и называется константой ячейки. Размерность константы 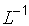 .
.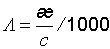 [м2·Ом-1·моль-1], где
[м2·Ом-1·моль-1], где 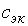 – молярная концентрация эквивалента вещества электролита, моль/дм3.
– молярная концентрация эквивалента вещества электролита, моль/дм3.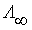 ) – это значение эквивалентной электропроводимости, которое не зависит от разведения. При бесконечном разведении эквивалентная электропроводимость определяется по закону Кольрауша: при бесконечно большом разбавлении ионы движутся независимо друг от друга, и общая электропроводимость раствора электролита равна сумме электропроводимостей катиона и аниона.
) – это значение эквивалентной электропроводимости, которое не зависит от разведения. При бесконечном разведении эквивалентная электропроводимость определяется по закону Кольрауша: при бесконечно большом разбавлении ионы движутся независимо друг от друга, и общая электропроводимость раствора электролита равна сумме электропроводимостей катиона и аниона.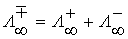 ,
,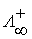 и
и 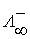 – предельные электропроводимости или подвижности ионов (катиона и аниона) (табл. 13).
– предельные электропроводимости или подвижности ионов (катиона и аниона) (табл. 13). ;
; 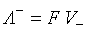 ,
, – степень и константу электролитической диссоциации.
– степень и константу электролитической диссоциации.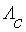 при данном разведении (концентрации) определяется уравнением:
при данном разведении (концентрации) определяется уравнением: ,
, – определяют экспериментально;
– определяют экспериментально; 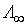 – справочная в
– справочная в


