
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Переносчик электричества в кондуктометрииСодержание книги
Поиск на нашем сайте Все проводники, существующие в природе, в зависимости от механизма переноса электричества при прохождении через них электрического тО'Ка можно разделить на три класса: электронные, ионные и смешанные. К «лассу электронных проводников, в которых переносчиками электрических зарядов являются электроны, относятся металлы, полупроводники, большинство металлических сплавов, углерод и некоторые твердые соли и окислы. В класс ионных проводников входят газы и электролиты, в которых переносчиками электрических зарядов являются ионы и прохождение тока сопровождается переносом вещества. Класс смешанных проводников состоит из веществ, обладающих частично электронной и частично ионной проводимостью. Область измерений электропроводности электролитов как одна из областей электрохимических измерений охватывает классы ионных и смешанных проводников. Аналоговые и частотные методы кондуктометрии по роду контакта исследуемого ионного проводника в кондуктометрической ячейке в свою очередь делятся каждый на две группы: контактные и неконтактные (или безконтактные) методы. Ее величина является суммой емкостей: емкости, определяющейся диэлектрической постоянной раствора, расстоянием между электродами, действующей площадью электродов, и емкости между проводниками, идущими к электродам. Величина удельной электропроводности ионных проводников выражается уравнениемОтношение L/S наиболее просто определяется в том случае, если проводник имеет строго определенную геометрическую форму, которой ограничиваются силовые линии тока, проходящего через проводник, это наблюдается, например, при измерении электропроводности металлических проводников. В некоторых случаях в измеряемую величину вносится погрешность от паразитных токов, возникающих между проводниками ячейки через термостатную жидкость. Схема воздействия высокочастотного магнитного поля на проводящий цилиндр (а), зависимость плотности тока от расстояния до центра проводника (б) и зависимость активного сопротивления и индуктивности раствора от частоты (в) электрода с твердой мембраной с встроенным электродом сравнения (а) и без электрода сравнения (б): / — корпус; 2 — твердая мембрана; л— внутренний раствор; 4 — внутренний электрод сравнения; 5 — металлический проводник io~e Ток смещения существует и в проводниках. При наложении постоянного напряжения на проводник через него протекает большой ток. 1 — корпус; 2 — электроды; 3 — соединительные проводники К слою серебра непосредственно припаиваются проводники для подвода напряжения. Прежде всего здесь сильно проявляется поверхностный эффект, вследствие которого ток проходит не через всю толщу проводника, а только в его поверхностном слое. Столбик исследуемой жидкости высотой h находится между внешним (/) и внутренним (2) цилиндрическими проводниками волновода. Проводники волновода в нижней части изолированы друг от друга при помощи уплотнительной втулки 3. Способ измерения состоит в том, что в определенном положении поршня 7, перемещая зонд 8 вместе с внутренним проводником 2 вверх или вниз, определяют максимумы или минимумы тока при помощи гальванометра 6. Схематическое устройство СВЧ метода с коаксиальной линией: / — внешний проводник волновода; 2 — внутренний проводник волновода; 3 — уп-лотнительная изолирующая втулка; 4 — петля связи; 5 — германиевый диод; 6 — гальванометр; 7 — поршень; 8 — зонд Для измерения компенсационным методом используется однородный проводник ВС (рис. ионных проводников, находящихся в виде истинных водных и неводных растворов, коллоидных растворов или расплавов. Перманганатометрия(сущность метода) ПЕРМАНГАНАТОМЕТРИЯ – метод объемного (титриметрического) химического анализа, основанный на применении стандартного (имеющего строго определенную концентрацию) раствора перманганата калия KMnO4. При действии восстановителей перманганат-ион в кислотной среде переходит в бесцветный катион марганца(2+): MnO4- + 8H+ + 5e-- = Mn2+ + 4H2O (стандартный потенциал при 25° С равен +1,53 В) Окончание титрования устанавливается по отсутствию розовой окраски перманганат-иона или с помощью индикатора (например, дифениламина). Применение перманганатометрии несколько осложняется реакцией, которая может идти в конце титрования в случае недостаточной кислотности раствора и приводит к ошибкам аналитического определения восстановителей: 2MnO4- + 3Mn2+ + 2H2O = 5MnO2 + 4H+ Эта реакция ускоряется в присутствии диоксида марганца. Для подкисления раствора при перманганатометрии обычно используют серную кислоту, так как соляная кислота (хлорид-ионы) и азотная (примеси оксидов азота) могут окисляться перманганатом калия и тем самым искажать результаты титрования. При хранении раствора KMnO4 идет его постепенное разложение с выделением кислорода и образованием MnO2, что ведет к изменению концентрации исходного раствора. Для приготовления стандартного раствора перманганата калия рекомендуется использовать дважды перегнанную дистиллированную воду (при вторичной перегонке к воде добавляют немного KMnO4). Если нет возможности использовать бидистиллят, приготовленный раствор KMnO4 кипятят, охлаждают и отделяют выпавший осадок MnO2 фильтрованием через стеклянный фильтр. Концентрацию (нормальность) раствора KMnO4 устанавливают титрованием точной навески щавелевой кислоты или оксалата натрия. Перманганатометрически определяют железо(2+), хром(3+), таллий(1+), вольфрам(V), ванадий(IV), сурьму(III), пероксид водорода, гидразин, органические вещества. Перманганатометрическое титрование применяется для определения очень сильных восстановителей, реагирующих с катионами железа(3+), переводя их в катионы железа(2+), которые оттитровывают перманганатом калия. Метод используется также для косвенных определений, например в феррометрии, суть которого заключается в восстановлении окислителей катионами железа(2+), избыток которого реагирует с перманганатом калия. Обратным перманганатометрическим титрованием определяют восстановители, медленно реагирующие с KMnO4 – такие как иодиды, цианиды, тиоцианаты и т.п.
Покажите кривую титрования слабой кислоты сильным основанием и укажите область точки экиваленности
1 точка: рН рассчитывают как для слаб. электролита – к-ты: С( рН= S рК(к-ты) – S lgC(к-ты), где рК(к-ты) = - lgK(к-ты) 2,3,4 точки – промежуточные: рН = рК(к-ты) - lg 5 точка- точка эквивалентности: рН = 6 точка: добавляем 100,1мл щелочи С( рОН= - lg С( рН=14-4=10 7 точка: добавляем 101мл щелочи(кислоты – 100мл) С( рОН= - lg С( рН=14-3=11 8 точка: добавляем 110мл щелочи С( рОН= - lg С( рН=14-2=12 9 точка: добавляем 200мл щелочи С( рОН= - lg С( рН=14-1=13 Используя полученные данные строим кривую титрования рН
V,мл поляриметрия сущность метода Кристаллические решетки некоторых веществ обладают способностью пропускать свет только с определенным направлением колебаний. Свет, прошедший через такую среду, называют поляризованным; он способен колебаться только в какой-либо одной плоскости, называемой плоскостью колебаний. Плоскость, перпендикулярную плоскости колебаний, называют плоскостью поляризации Среди известных веществ насчитывают несколько тысяч так называемых оптически активных, т. е. способных изменять (вращать) плоскость поляризации проходящего через них поляризованного света. Оптическая активность I^SSI^Ha этих веществ возникает в результате электронных взаимодействий в молекуле. Она связана со строением молекул и с особенностями кристаллической решетки. Когда через СЛОЙ оптически актив- Естественный (а) и по-ного вещества проходит поляризован- ляризованный (б) лучи ный свет, то плоскость поляризации его оказывается повернутой на некоторый угол, называемый углом вращения плоскости поляризации. В основе метода поляриметрического анализа лежит измерение угла вращения плоскости поляризации света, прошедшего через оптически активную среду. Если оптически активное вещество находится в растворенном состоянии, то угол поворота плоскости поляризации зависит от числа молекул вещества, встречающихся на пути поляризованного луча. Чем больше число молекул, тем больше угол поворота плоскости поляризации. Таким образом, угол поворота плоскости поляризации зависит от концентрации оптически активного вещества в растворе. При поляриметрических определениях расстояние по линии распространения светового луча не должно изменяться. Это означает, что расстояние от одной стенки сосуда, в котором находится оптически активное вещество, до другой во всех определениях остается неизменным. При соблюдении этих условий угол вращения плоскости поляризации будет в прямой пропорциональной зависимости от концентрации. Поляриметрический метод широко используют для изучения структуры и свойств различных веществ: с его помощью проводят исследования кристаллических веществ в минералогии и кристаллохимии, изучают кинетику процессов, протекающих с участием оптически активных веществ, изучают некоторые параметры космических объектов. Метод поляриметрического анализа широко применяют в аналитических целях при количественных определениях различных веществ. В пищевой промышленности его успешно используют для количественных определений жиров, масел, сахаристых и других веществ.
|
||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 238; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.007 с.) |

 )=
)=  -lg С(
-lg С(
 рК(Н2О) +
рК(Н2О) +  )=0.1/1000=
)=0.1/1000=  моль/л
моль/л моль/л
моль/л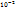 моль/л
моль/л
 =1
=1


