Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Подавление секреторной активности пжСодержание книги
Поиск на нашем сайте
а) медикаментозное подавление. Антипротеазы: апротинин 1,0 - 1,5 млн. ЕД /сутки, контрикал до150 тыс. ЕД /сут, пантрипин 300 - 480 ЕД/сут. Подавляя кининовую и трипсиновую активность, антипротеазы не влияют на активность липазы и не могут прервать некротизирующее повреждение в железе и парапанкреальной клетчатке. Антилипазным действием обладают тетрациклины (морфоциклин, доксациклин). Цитостатики, накапливаясь в панкреатоцитах, угнетают синтез проферментов. Разовая и суточная доза 5-фторурацила - 10 мг/кг, фторофура - 20 мг/кг. Регуляторные пептиды (соматостатин, кальцитонин, даларгин) существенно подавляют не только продукцию трипсина и амилазы, но и общего объема панкреатического секрета. Соматостатин вводят в катетеризированную центральную вену в течение 12 часов со скоростью 3 - 3,5 мкг/кг в 1 час, т.е. в среднем 250 мкг/ч взрослому больному. б) искусственная гипотермия. Снижение температуры в области ПЖ до 350С приостанавливает активацию панкреатических ферментов, существенно уменьшает секрецию, понижает протоковую гипертензию, купирует воспалительный процесс на брюшине, обладает бактериостатическим действием. Различают следующие методы гипотермии: Желудочная гипотермия осуществляется как с помощью ледяной воды, вводимой через двухканальный зонд (открытый способ), так и с помощью охлаждающего баллона (закрытый способ). Более редко используют внутрисосудистую гипотермию за счет регионарной инфузии охлажденными до 40Со растворами, и внутрисальниковую гипотермию (лаваж сальниковой сумки охлаждающими растворами).
Активная детоксикация а)инфузионная терапия и форсированный диурез. Форсированный диурез. На этапе гидратации и гемодилюции проводят первично-инфузионную детоксикацию. Форсирование мочеотделения достигается струйным вливанием 15 - 20% р-ра маннита или сорбита в дозе 1 г в-ва на 1 кг массы тела, или быстрым капельным вливанием лазикса в дозе 1 - 3 мг/кг. Детоксицирующее действие наиболее выражено при темпе мочеотделения не менее 4 -5 мл/кг в час. Поддержание диуреза обеспечивается вливанием полиионных растворов и состоит в поддержании гомеостаза. б) наружное отведение лимфы (НОЛ). Показанием к НОЛ служит выраженный эндотоксикоз, который не удается уменьшить традиционными методами лечения. Извлечение путем катетеризации грудного лимфатического протока 2 - 3 л лимфы, богатой продуктами нарушенного метаболизма (билирубин, аммиак, желчные кислоты, фенолы и деструкции тканей продукты ПОЛ, панкреатические и лизосомальные ферменты) приводит к разительному снижению эндотоксикоза, уменьшает легочные проявления сброса в кровоток панкреатических ферментов, восстанавливает функцию почек. в) энтеросорбция. Энтеросорбция - метод активной детоксикации, основанный на выведении факторов эндогенной интоксикации через ЖКТ с помощью орального приема сорбентов. Основанием для энтеросорбции считают возможность поступления в просвет кишки токсинов, характерных для заболеваний панкреатодуоденальной зоны, нередкая динамическая кишечная непроходимость с расстройством полостного и пристеночного пищеварения, восходящая колонизация паретичной кишки патогенными микробами и связанные с этим бродильные и гнилостные процессы. Для энтеросорбции используются углеродные сорбенты на основе карбонита, промышленных активированных углей, волокнистых сорбентов (Вуален), энтеросорбенты на основе поливинилпироллидона (энтеродез) и порошковые на основе лигнина (полифепан). г) гемосорбция. Гемосорбция - один из наиболее распространенных методов активной детоксикации, в котором моделируют механизмы иммобилизации эндотоксинов. Гемосорбция часто используется на ранних стадиях ОП и панкреатогенного перитонита, протекающего с признаками энцефалопатии. д) плазмаферез. Плазмаферез - операция экстракорпоральной гемекоррекции, в процессе которой частично или полностью удаляют плазму крови. Отчетливое дезинтоксикационное действие плазмафереза проявляется при объеме плазмоэксфузии 1-1,5 л. Эксфузия, превышающие 1,8 - 2 л плазмы, носит название плазмообмен и обеспечивает наиболее отчетливую детоксикацию.
Антимикробная химиотерапия При выборе препаратов следует исходить из характера микрофлоры, обнаруживаемой в гнойных очагах. Высевается, как правило, ассоциация эшерихии с протеем, ли-бо с псевдомонадами. Наиболее часто для химиотерапии используются аминогликозида (хорошо накапливаются в ткани ПЖ), хлорамфеникол (подавляет вегетацию ряда анаэробных микробов), тетрациклины (хорошо накапливаются в очагах панкреонекроза и желчи).
Иммунокоррекция При признаках метаболического иммунодефицита и стойкой лимфоцитопении можно применять леакадин по 0,3 - 0,5 г в/м 2-3 дня подряд. Снижение фагоцитарной активности - показание к применению продигиозана по 50 мг с интервалом в 2-3 дня.
Фотомодификация крови (ФМК) ФМК - метод гемокоррекции состоящий в обработке крови различными видами лучевой энергии для получения системного стимулирующего эффекта. а) после выведения из шока б) значительная степень эндотоксикоза. Фмк способствует уменьшению воспалительных явлений в железе, предотвращению перехода деструктивного ОП в гнойный. Параллельно этому уменьшается поражение легочной паренхимы, быстро восстанавливается содержание гемоглобина в эритроцитах. Хирургическое лечение Показаниями к оперативному вмешательству в первые 5-7 суток заболевания служат сомнения в диагнозе (риск пропустить другое экстренное хирургическое заболевание). Неэффективность консервативной терапии по истечении 24 часов, проявляющаяся нарастанием интоксикации и прогрессированием перитонита; сопутствующий деструктивный холецистит, некупирующаяся нарастающая желтуха, холангит. Оперативное вмешательство при панкреонекрозе должно соответствовать принципам “закрытого” метода. Манипуляции на поджелудочной железе должны ограничиваться парапанкреатической блокадой, “абдоминизацией”, двухлоскутной оментопанкреопексией и ограниченным дренированием сальниковой сумки, парапанкреатической клетчатки. Желчные пути дренируются путём наложения холецистостомы, а при наличии в них патологии - производится радикальная санация. Верхний этаж брюшной полости в целях профилактики распространения перитонита отграничивают от других отделов брюшной полости путём подшивания большого сальника к париетальной брюшине передней брюшной стенки на уровне поперечной ободочной кишки с закрытием латеральных каналов. В послеоперационном периоде необходимо продолжать интенсивную терапию и проводить мероприятия по профилактике гнойно-септических осложнений. С этой целью возможны инфузии лекарственных смесей (антибиотики, дезагреганты, спазмолитики, антикоагулянты и т.п.) в правую желудочно-сальниковую артерию, катетеризированную во время операции, проведение продольного внутритканевого электрофореза, эндолимфатическое введение антибиотиков и цитостатиков. Тактика при гнойно-висцеральных осложнениях панкреонекроза Лечение гнойных осложнений панкреонекроза - довольно сложная задача, при решении которой необходимо учитывать, что эти осложнения, во-первых, взаимообусловлены и часто взаимосвязаны, во-вторых, их наличие практически всегда является показанием к неотложной операции, в-третьих, только активные действия, радикальные вмешательства дают гарантии на успех. При гнойно-некротических осложнениях панкреонекроза (абсцессы поджелудочной железы, сальниковой сумки, парапанкреатической клетчатки, забрюшинная флегмона) необходим доступ, сочетающий правила оптимального дренирования и широкий подход к железе. Этим требованиям отвечает поперечный дугообразный разрез в эпигастрии. Единственно оправданным способом лечения подобных больных является современная санация патологических очагов методом многократной некрсеквестрэктомии. При аррозивных кровотечениях приемлемы только радикальные меры (резекция поджелудочной железы, перевязка сосуда на протяжении, спленэктомия). Паллиативные мероприятия (тампонада гнойной полости с источником кровотечения) дают только временный эффект, через несколько часов или суток кровотечение повторяется и больные погибают.
Схемы операций при панкреатите (Шалимов А.А. и соавт. 1997г.)
Схема 1. Новокаиновая блокада поджелудочной железы
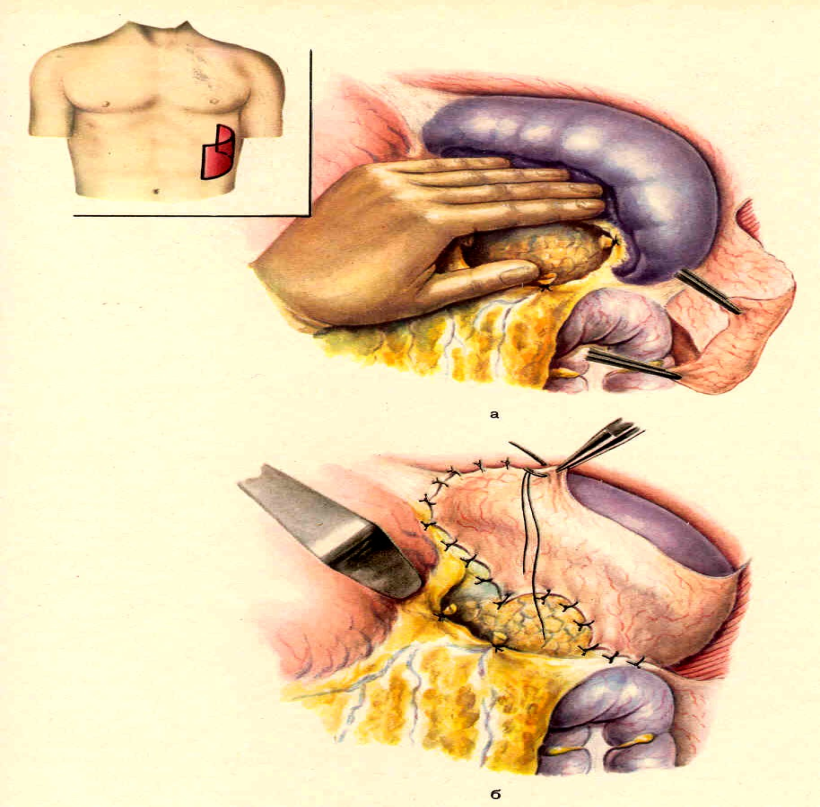
Схема 2. Оментопанкреатопексия: а-мобилизация сальника; б – пришивание сальника выше и ниже поджелудочной железы
Схема 3. Панкреатонекрэктомия
Схема 4. Способ локальной лапаростомии с проведением лаважа 2.6 Портальная гипертензия
Портальная гипертензия (ПГ) – повышение давления в системе воротной вены, вызванное различными причинами. Наряду с высоким портальным давлением (ПД) и снижением скорости кровотока, уменьшением объема портального кровотока, имеет место извращение печеночного кровотока, спленомегалия, варикозное расширение вен пищевода и желудка, асцит, расширение вен передней брюшной стенки, геморроидальных вен, желтухи, гиперспленизм, и их сочетания:
q ПГ и симптомы, сопутствующие ей, являются общими для ряда нозологических форм заболеваний
q ПГ - симптомокомплекс закончившегося основного патологического процесса
q ПГ у детей - следствие стеноза или облитерации воротной вены (ВВ), вызванной различными воспалительными процессами, рубцами, тромбозом, опухолевым процессом и другими заболеваниями
q ПГ - cледствие стеноза или облитерации селезеночной вены (СВ), болезни Киари или синдрома Бадда-Киари (тромбоз нижней полой вены на уровне печеночных вен с эндофлебитом), цирроза печени. Воротная вена (V. porta) образуется позади головки поджелудочной железы двумя, тремя или четырьмя венозными стволами. Вена направляется вверх и вправо, располагаясь между двумя брюшинными листками печеночно-дуоденальной связки. Впереди ствола воротной вены проходят печеночная артерия и общий желчный проток, артерия лежит слева, а проток справа от вены (рис. 13). Возможны анатомические индивидуальные особенности. Место слияния вен и образования ствола воротной вен находится на уровне II поясничного позвонка, иногда на уровне III поясничного или XII грудного. Начальная часть воротной вены чаще проецируется между I и II поясничным позвонком.
Различают несколько форм слияния венозных стволов, образующих воротную вену. По В.Н. Тонкову - три формы образования ВВ, В.И. Валькер выделяет четвертую форму: воротная вена образуется в результате слияния четырех вен – верхней брыжечной, нижней брыжечной, селезеночной и венечной вен желудка. Установлено наличие и добавочных воротных вен, несущих кровь к печени, они названы гепатопетальными анастомозами, в отличие от гепатофугальных проносящих кровь мимо печени Одной из крупных корневых ветвей ВВ является верхняя брыжеечная вена, ширина ее 0,2-0,8 см. Вторая ветвь – селезеночная вена, которая проходит по верхне-задней поверхности поджелудочной железы. Третья менее крупная ветвь ВВ – нижняя брыжеечная вена, которая в большинстве случаев впадает в селезеночную или верхнебрыжеечную вену. Четвертой ветвью ВВ является венечная вена желудка, которая как и НБВ в ряде случаев впадает в селезеночную вену, крайне редко в ВБВ
Артериальная кровь под давлением 110-120 мм.рт.ст. поступает в первую сеть капилляров, расположенных в непарных органах брюшной полости. Давление в капиллярах этой системы 10-15 мм.рт.ст. Из первой капиллярной сети кровь поступает в венулы, вены и далее в ВВ, где давление в норме 5-10 мм.рт.ст. Большее сосудистое сопротивление, физиологические механизмы ограничения притока артериальной крови, позволяют артериальной системе воротного бассейна принимать активное участие в процессах регулирования кровообращения этой области. При патологических состояниях (ЦП) в этом процессе участвуют и магистральные сосуды: селезеночная и печеночная артерии. Кровь из портального русла попадает в сердце через печень, этим предотвращается интоксикация организма ядовитыми продуктами, всасывающимися из кишечника. В отличие от артериальной системы, где перепад давления от ствола чревной артерии до внутрипеченочных капилляров составляет 100-110 мм.рт.ст., разница в давлении между селезеночной веной и внутрипеченочными разветвлениями ВВ незначительная, это свидетельствует об относительно низком сосудистом сопротивлении этой области при большой емкости.
Наиболее объективной является следующая классификация ПГ (М.Д.Пациора, 1974): 1. Допеченочная блокада портального кровообращения: а) флебосклероз, облитерация, тромбоз воротной вены или ее ветвей, кавернозная трансформация ВВ б) врожденный стеноз или атрезия ВВ или ее ветвей в) сдавление ВВ или ее ветвей рубцами, опухолями, инфильтратами 2. Внутрипеченочная блокада портального кровобращения: а) циррозы печени различной формы (портальный, постнекротический, билиарный, смешанный) б) опухоли печени (сосудистые, паразитарные, железистые) в) фиброз печени (портальный, рубцовый, после травмы, локальных воспалительных процессов) 3. Надпеченочная блокада портального кровообращения а) цирроз Пика сердечного происхождения б) болезнь Киари (эндофлебит печеночных вен) в) синдром Бадда-Киари (тромбоз нижней полой вены на уровне печеночных вен, стеноз или облитерация ее выше печеночных вен, сдавление опухолью, рубцами) 4. Смешанная форма блокады ПК а) ЦП в сочетании с тромбозом ВВ (первично ЦП, тромбоз ВВ как осложнение) б) тромбоз ВВ с ЦП (портальный ЦП как следствие тромбоза ВВ) в) ЦП с синдромом Бадда-Киари. По клиническому проявлению и состоянию порто-печенного кровообращения различают три стадии течения ПГ (М.Д.Пациора,1974): 1) компенсированная (начальная стадия – умеренное повышение ПД, компенсированное внутрипеченочное кровообращение, спленомегалия с гиперпленизмом или без него) 2) 2) субкомпенсированная (высокое ПД, спленомегалия, варикозно-расширенные вены пищевода и желудка с кровотечением и без кровотечений из них, выраженные нарушения в порто-печеночном кровообращении, спленомегалия с гиперпленизмом или без него) 3) декомпенсированная (спленомегалия, варикозно-расширенные вены пищевода и желудка с кровотечением и без кровотечения, асцит, выраженные нарушения в порто-печеночноми центральном кровообращении, спленомегалия с гиперпленизмом или без него). Варикозное расширение вен пищевода и желудка может быть эссенциальным, что встречается редко, при блокаде путей венозной крови на почве опухолевого поражения щитовидной и вилочковой железы. Отток крови из вен пищевода осуществляется двумя путями. В систему верхней полой вены направляется через непарную, полунепарную и щитовидные вены; из нижнего отдела пищевода при наличии анастомозов с венами желудка происходит отток в воротную вену через коронарную вену желудка. При высоком портальном давлении возникает ретроградный ток крови из портальной системы через вены пищевода в систему верхней полой вены, то есть образуется порто-кавальный анастомоз с последующим расширением вен, входящих в его состав.
В возникновении варикозного расширения пищевода имеет значение и анатомическая особенность:
• магистральный тип строения • рыхлость окружающей ткани • отсутствие клапанов •наличие анастомозов между венозными сосудами пищевода и желудка с портальной системой Если нет анастомозов между венами пищевода и желудка, то высокое портальное давление не отражается на венах пищевода, поэтому в одних случаях при синдроме ПГ появляется ВРВП, а других - при прочих равных условиях - расширения вен не происходит. ВРВП при ПГ зависит не от локализации блока (внутрипеченочный или внепеченочный), а от наличия при этом связи вен пищевода с венами желудка и их анатомических особенностей. Механизм ВРВЖ тот же, что и вен пищевода, т.е. ток крови из венечной вены желудка, направляясь в вены пищевода, при наличии анастомозов между ними, встречает препятствие на месте перехода последних в систему верхней полой вены, что и приводит к варикозному расширению вен пищевода и желудка. При этом варикозному расширению подвергаются только те ветви венечной вены подслизистого слоя желудка, которые анастомозируют с венами пищевода. Чем обширнее связь, тем больше расширенных вен.
Спленомегалия Причины спленомегалии: • общность природы клеточного состава ретикулоэндотелиальных элементов печени и селезенки • следствие гиперплазии и гипертрофии ретикулоэндотелиальных элементов, как результат воспалительного процесса (при малярии, бруцеллезе), а в других случаях как результат функциональных изменений (гемолитическая анемия)
• переполнение селезенки кровью. В норме вмещает 30,0 – 50,0 мл крови, а увеличенная 150-500,0 мл и больше. Однако, при ПГ понятие "конгестивная" (застойная) спленомегалия не отражает истинного патогенеза спленомегалии. При ПГ происходят значительные изменения в сосудистой системе печени, селезенки. При ЦП артериальный кровоток печени снижен за счет сужения артериального русла печени, а кровоток в сторону селезенки резко усилен. Спленомегалия играет роль "пульсаторного тарана", принимающего участие в компенсации внутрипеченочного кровообращения. Спленомегалия при ПГ - не следствие застоя крови, а результат функциональной гипертрофии органа, участвующего в компенсации печеночного кровотока. Гиперспленизм - цитопения (анемия, лейкопения, тромбоцитопения) при циррозе печени встречается значительно чаще, чем при внепеченочной портальной гипертензии. В развитии этого синдрома придается значение патологическому влиянию селезенки, повышенному депонированию клеток крови в увеличенной селезенке, печеночной недостаточности, укорочению продолжительности жизни тромбоцитов, вегетированию в них вируса болезни Боткина, имеют значение аутоиммунные механизмы Асцитический синдром – появление и накопление жидкости в брюшной полости. Причины – повышение портального давления, порто-лимфатическая гипертензия, гипо-, диспротеинемия, активация течения цирротического процесса в печени, печеночная недостаточность (нарушение синтеза мелкодисперсных белков, замедление скорости распада гормонов – удерживающих жидкость), снижение сократительной способности миокарда, нарушение функции почек.
Методы исследования при ПГ Наиболее ценные методы исследования, позволяющие выявитьПГ, формы ее - рентгенологическое исследование пищевода, желудка, 12п.к., селезенки, печени, эндоскопическое исследование пищевода, желудка, ангиографическое исследование ВВ и ее ветвей, чревного ствола и ее ветвей, верхней и нижней полой вены, исследование функционального состояния печени и внутренних органов. Пункция селезенки может быть применена с целью исключения других заболеваний, сопровождающихся спленомегалией. Специфические изменения в цитограмме селезенки обнаруживают при туберкулезном поражении ее, болезни Гоше, опухолях селезенки, миелолейкозе. Основным методом диагностики флебэктазии пищевода является рентгенологическое и эндоскопическое исследования. Эти методы позволяют выявить наличие, распространенность, степень увеличения ВРВП, кардиального отдела желудка.
4-х степенная классификация К. - J. Paquet,1983 (рис. 14,15) 1. Единичные эктазии вен (рентгенологически не определяются) 2. Единичные хорошо отграниченные стволы вен, преимущественно в нижней трети пищевода, которые при инсуффляции остаются отчётливо выраженными. Нет сужения просвета пищевода. Нет истончения эпителия на венах 3. Отчётливое сужение просвета пищевода стволами ВРВ, расположенными в нижней и средней трети пищевода, которые частично уменьшаются только при сильной инсуффляции воздуха. На верхушках ВРВ выявляются единичные красные маркеры или ангиоэктазии 4. Просвет пищевода полностью выполнен варикозными узлами, даже при максимальной инсуффляции воздуха. Эпителий над венами истончён. На верхушках вариксов определяются множественные эрозии и/или ангиоэктазии
N. Soehendra, К. Binmoeller (1997) предложена трехстепенная классификация BPB, в которой авторы обращают внимание на различия данной патологии в пищеводе и желудке.
BPB пищевода: I степень - диаметр вен не превышает 5 мм, вытянутые, располагаются только в нижней трети пищевода; II степень - BPB диаметром от 5 до 10 мм, извитые, распространяются в средней трети пищевода III степень - размер вен более 10 мм, напряжённые, с тонкой стенкой, расположены вплотную друг к другу, на поверхности вен "красные маркёры".
BPB желудка: I степень - диаметр вен не более 5 мм, едва различимы над слизистой желудка II степень - BPB размером от 5 до 10 мм, солитарно- полипоидного характера III степень - вены диаметром более 10 мм, представляют обширный конгломерат узлов, тонкостенные, полипоидного характера.
Правила для описания и регистрации эндоскопических признаков BPB пищевода и желудка (Япония, 1991): 1. Локализация - эта характеристика требует определения распространённости BPB вдоль пищевода, а при выявлении вен желудка, оценивается их расположение относительно кардии. • нижняя треть пищевода - Li • средняя треть - Lm • верхняя треть - Ls • BPB желудка - Lg • располагающиеся в кардии - Lg-с • отдалённые от кардии - Lg-f 2. Форма (вид и размер) - данным показателем оценивается внешний вид и размер ВРВ, при этом обнаруживают: • отсутствие вен - FO • короткие, малого калибра ВРВ - Fl • умеренно расширенные, извитые ВРВ - F2 • значительно расширенные, узловатые ВРВ - F3 3. Цвет - этой категорией отражается толщина стенки ВРВ. Синий цвет указывает на значительное её истончение. • белый - Cw; • синий - Cb. 4. "Красные маркёры" стенки - среди них выделяют: • пятна "красной вишни" - CRS • гематоцистные пятна - НСS
• телеангиэктазии - ТЕ 5. Признаки кровотечения - при остром кровотечении требуется установить его интенсивность, а в случае спонтанного гемостаза оценить характер тромбав период кровотечения: • струйное • в виде просачивания после достижения гемостаза • красный тромб • белый тромб 6. Изменения слизистой пищевода - они могут быть как проявлением рефлюксной болезни, нередко сочетающейся с заболеваниями, протекающими с синдромом портальной гипертензии, так и следствием лечебного эндоскопического воздействия. • эрозия - Е • язва - U • рубец - S Спленопортометрия, спленопортография: портальное русло проходимо и расширены вены (СВ 15-20 мм; ВВ 20-28 мм). Селезеночная вена имеет дополнительные изгибы, угол между ВВ и позвоночным столбом уменьшен. Внутрипеченочный сосудистый рисунок обеднен в виде "метелки", а печень выглядит, как "осеннее дерево", уменьшена в размерах. Сосудистые изменения в печени зависят от выраженности цирротического процесса в печени. На спленопортограммах при внепеченочной ПГ картина портального русла зависит от уровня блокады портального кровообращения. По рентгенологическим, ангиографическим и клиническим данным выделяются следующие варианты ВПГ: • подпеченочный блок • изолированный тромбоз • "двойной блок" – изолированный тромбоз СВ и подпеченочный блок • тотальный тромбоз портальной системы
•венозной фазы (возвратная спленопорто-, или мезентерикопортограмма) • паренхиматозной фазы ангиографии
Показания к артериографии: 1 - для уточнения формы ПГ, когда другие методы не вносят ясности, а спленопортография противопоказана из-за геморрагического синдрома 2 - для выяснения состояния артериального бассейна гепатолиенальной зоны, что необходимо для решения вопроса о показаниях и выборе метода операции 3 - у ранее оперированных больных с рецидивами кровотечении из вен пищевода, для выяснения проходимости спленопортального русла и уточнения тактики повторного оперативного вмешательства. Основным признаком цирроза печени является сужение печеночной артерии и обеднение внутриорганного сосудистого рисунка с одновременным расширением чревного ствола и селезеночной артерии (рис. 16, 17).
Противопоказания для ангиографических исследований – непереносимость йодистых препаратов, печеночная недостаточность, постгеморрагическая анемия.
В 1957 году Шобингер предложил костометрию, костоазигографию, которая опосредованно отражает давление в портальной системе. Метод усовершенствован и широко применяется профессором Андреевым Г.Н. В диагностике ПГ применяются радиоизотопные методы исследования, сканирование печени, неинванзивные методы – ультразвуковое исследование и компьютерная томография печени. Для морфологической верификации диагноза необходимо использование пункционной биопсии печени с последующим гистологическим исследованием. ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ ПГ Началом хирургического лечения ПГ являются 80 - 90-е годы XIX века, когда в основу оперативного вмешательства была взята идея декомпрессии портальной системы, т.е. создания новых путей оттока крови из системы воротной вены. Для решения этой задачи почти одновременно были предложены 2 типа операций: 1-й - оментопариетопексия, т.е. подшивание большого сальника к передней брюшной стенке, автором которой, согласно данным литературы, является S. Talma (1898) 2-й - сосудистый портокавальный анастомоз (ПКА), предложенный Н.В. Экком (1877). Все операции условно делятся на 6 групп: 1 - направленные на отведение асцитической жидкости 2 - направленные на создание новых путей оттока крови из портальной системы (органные (рис.18,19,20), сосудистые анастомозы) 3 - направленные на уменьшение притока крови в портальную систему (перевязка, окклюзия артерии) 4 - направленные на разобщение вен пищевода, желудка с венами портальной системы: азиго-портальное разобщение 5 - направленные на усиление регенерации печени и внутрипеченочного артериального кровообращения 6- аллотрансплантация печени.
Схемы органных операций
Рис. 20. Оменторенопексия. Способ П.А.Герцена. Окутывание нижнего полюса почки сальником и подшивание его к капсуле почки
Сравнительно простая техника вышеуказанных операций способствовала их широкому распространению в клинической практике. При этом подавляющая часть хирургов совмещала их со спленэктомией или перевязкой селезеночной артерии, мотивируя такую комбинацию тремя обстоятельствами: 1) уменьшением притока крови в портальную систему, а следовательно, и снижен ием портального давления 2) улучшением артериального кровообращения печени вследствие перераспределения потока крови в системе чревной артерии, что должно было улучшить функцию цирротической печени 3) коррекцией гиперспленизма, часто сопутствующего спленомегалии.
Начиная с 1980 г. изменилось отношение к спленэктомии как самостоятельной операции и резко сужены показания к ней. В настоящее время показания спленэктомии ограничены наличием 3 ситуаций: 1) сегментарная портальная гипертензия, когда основным проявлением болезни являются профузные кровотечения из ВРВ желудка в результате непроходимости селезеночной вены 2) артериовенозная фистула между селезеночной артерией и селезеночной веной, т.е. когда причиной ПГ является нагрузка объемом крови 3) инфантилизм у подростков, имеющих ЦП, когда удаление селезенки больших размеров ведет к нормализации физических параметров организма. При наличии ВРВ пищевода и желудка спленэктомия должна быть дополнена их прошиванием. Гиперспленизм, т.е. нарушение в составе периферической крови, в настоящее время, не рассматривается как настоятельное показание к спленэктомии, ибо повышение числа тромбоцитов и лейкоцитов после удаления селезенки совершенно не влияет на течение ПГ, а в ряде случаев ухудшает прогноз болезни. Для устранения гипоксии организма, имеющей место при портальной гипертензии, обусловленной ЦП, некотрые авторы предлагали длительную интестинальную оксигенацию (Усов Д.)
Хирургическое лечение ПГ в Республике Казахстан – это прежде всего лечение ЦП и его осложнений. Одним из осложнений ЦП является асцитический синдром. Для устранения асцитического синдрома продолжают применять парацентез с эксфузией асцитической жидкости (рис.21), наружную и внутреннюю реинфузию, полостные операции предусматривающие поступление жидкости в клетчаточные пространства (способ Кальба-Оппеля-Шалимова; метод Гагушина), наложение лимфо-венозного анастомоза, перевязка общей печеночной артерии (Rienchof). Асцитическая жидкость является продуктом лимфо и плазмопотери содержит в себе необходимые для организма ингредиенты в сбалансированном состоянии.
Рис. 21. Места прокола передней брюшной стенки при асците Наружная аутореинфузия предполагает раздельный забор АЖ и введение в венозное русло. В Республиканском Центре ПГ разработан и применяется закрытый способ аутореинфузии АЖ с помощью аппарата Вискубенко и роликового насоса. Денвер и соавторы предложили однонаправленный клапан, который двумя раструбами соединяется с силиконированными трубками. Одна из трубок находится в брюшной полости, а вторая вводится во вторую яремную вену, а клапан имплантируется в прямую мышцу живота. За счет градиента давления (5 – 10 мм вод.ст.) жидкость поступает из брюшной полости в правые отделы сердца. Альтернативой полостным операциям типа Кальба-Оппеля-Шалимова для перемещения и всасывания АЖ является эндоскопическая асциткорригирующая операция, предложенная Андреевым Г.Н. Кровотечение из варикозно-расширенных вен пищевода и желудка
В патогенезе кровотечений первостепенное значение имеет гемодинамический фактор – высокое портальное давление. Пусковым механизмом в возникновении кровотечения является гипертонический криз в портальной системе, вызванный внешними или внутренними факторами. Кислотно-пептический фактор не является ведущим в механизме кровотечения, но при наличии рефлюкс – эзофагита или эрозивного гастрита он может вызвать изъязвление участка слизистой над сосудом, привести к аррозии сосуда и, способствовать возникновению кровотечения. Нарушения в свертывающейся системе крови обуславливают массивность и продолжительность кровотечения. Лечение кровотечений начинается с консервативных методов. Оно предусматривает применение зонда Блейкмора (1950) – трехпросветный пищеводный зонд с двумя баллонами вводится через нос в полость желудка (рис.22). В желудочный баллон нагнетается 50 – 70 см3 воздуха, зонд подтягивается до упора в области кардии желудка, фиксируется, на трубку накладывается зажим. Раздувание пищеводного баллона начинается с 30 –40 см3 и через каждые 3 – 5 мин добавляется по 10 – 15 см3, доводится от 80 до 150 см3 в зависимости от состояния пищевода, его дилатации и переносимости компрессии баллона на органы средостения.
Рис.22. Зонд Сенгстейкена-Блэйкмора
Для снижения портального давления применяется питуитрин в дозе 20 ЕД на 200 мл 5% раствора глюкозы внутривенно в течение 20 минут, через 40 – 60 минут повторно в количестве 5 – 10 ЕД. Противопоказания к применению питуитрина – гипертоническая болезнь, общий атеросклероз, стенокардия, коронарокар-диосклероз, тиреотоксикоз, бронхиальная
|
|||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-14; просмотров: 495; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.46.129 (0.012 с.) |