Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Биологические свойства возбудителя чумыСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Возбудитель чумы относится к семейству Enterobacteriaceae, роду Yersinia, виду pestis. В качестве внутривидовой классификации самой признанной за рубежом считается классификация Р. Девинья, которая, учитывая принципы формирования разновидностей в исторические эпохи и некоторые биохимические свойства штаммов, делит вид на 3 биовара: antiqua (древний), mediаevalis (средневековый) и orientalis (восточный) (табл.21). Таблица 21 Внутривидовая классификация Yersinia pestis (R. Devignat)
В нашей стране принята единая систематическая схема подвидовых категорий, наименование которых отражает конкретные географические территории. В основу схемы положены результаты изучения штаммов, выделенных на данных территориях, методами геносистематики и нумерической таксономии. Она учитывает степень фенотипического сходства, а так же различия по содержанию ГЦ-пар в ДНК и др. Согласно этой схеме вид Y. pestis делится на 5 подвидов: Y.pestisssp. pestis (основной), Y. pestisssp. caucasica (кавказский), Y. Pestis ssp.altaica (алтайский), Y. Pestis ssp. hissarica (гиссарский) и Y. Pestis ssp. ulegeica (улэгейский) (табл.22). Таблица 22 Таксономические признаки, характеризующие различные подвиды Y. Pestis
Примечание: «+» -наличие признака; «-» -отсутствие признака; «±» - наличие признака не у всех штаммов; «+/-» -чувствительны к пестицину штаммов основного и алтайского подвидов и нечувствительны к пестицину штаммов собственного подвида. Y. pestis -полиморфная овоидная грамотрицательная палочка, длиной 1-2 мкм, толщиной 0,3-0,7 мкм, с закругленными концами и утолщенной серединой. В мазках с плотной питательной среды палочки могут быть удлиненными, нитевидными; описаны также фильтрующиеся формы. При затяжном заболевании в мазках из бубона и органов больного возбудитель чумы может принимать форму шаров различной величины и теней. В мазках-отпечатках из тканей и органов, а также в мазках из бульонных культур окрашивается биполярно (более интенсивно на концах клетки). Биполярность ярче выявляется при окраске метиленовой синькой Леффлера. Возбудитель чумы не имеет жгутиков и спор. Капсулу образует в организме теплокровных животных и людей, кровяном и сывороточном агаре при температуре 37 °С. Чумной микроб – облигатный паразит с факультативным анаэробным типом дыхания, относится к природным ауксотрофам. Помимо источника энергии нуждается в дополнительных факторах роста – аминокислотах и витаминах. Для роста при 28 °С необходимы фенилаланин, валин, метионин, изолейцин и глицин или треонин; при 37 °С - биотин, тиамин, глютаминовая кислота и пантотенат. Штаммы из разных очагов чумы, как правило, имеют неодинаковые потребности в факторах роста, что находит отражение в схеме внутривидовой таксономии чумного микроба. Для культивирования возбудителя требуются питательные среды с глубоким расщеплением белка. Лучшими по качеству являются среды, приготовленные из ферментативных гидролизатов кровяных сгустков (не требуют добавления стимуляторов и рост наблюдается при посеве 10-100 микробных клеток) и казеина, перевара Хоттингера, кислотного гидролизата рыбокостной муки. Самые распространенные среды для изучения чумного микроба: бульон и агар Хоттингера, Мартена, казеиново-дрожжевой агар (питательный агар для выращивания чумного микроба, сухой), дезоксихолатно-цитратный агар. Оптимальные условия выращивания: температура 28-30 °С и pH 7,0-7,2, но возбудитель способен расти на питательных средах в температурном диапазоне от 2 до 45 °С и показателях pH среды от 5,8 до 8,0. Чумной микроб на плотных питательных средах имеет характерную морфологию роста. При посеве бактериологической петлей через 24-48 часов инкубации представляет собой бурый «тяж» в начале штриха и отдельные шероховатые колонии в конце. Морфология колоний под микроскопом является одним из основных диагностических признаков возбудителя чумы. Через 12 ч инкубации появляются микроколонии в виде нежных прозрачных образований чаще треугольной или прямоугольной формы, напоминающих битое стекло (рис.23).
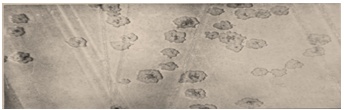
Рис.23. «битое стекло» (12-24 ч) Через 18-24ч микроколонии сливаются в плоские прозрачные образования с фестончатыми краями - «кружевные платочки» (рис.24).
Рис.24. «кружевные платочки» (18-24 ч)
В дальнейшем (24-48ч) «кружевные платочки» превращаются в зрелые колонии. Типичные зрелые колонии имеют бурый зернистый центр с постепенно уплощающейся прозрачной периферической зоной с фестончатыми краями. На скошенном агаре возбудитель чумы растет в виде сочного, серовато-белого налета, хорошо фиксированного на среде. На жидкой питательной среде (МПБ, бульон Хоттингера и др.) образует хлопьевидный или порошковидный, легко распадающийся при встряхивании осадок, в совершенно прозрачном бульоне и нежную пленку на поверхности. Бактерии чумы растут в R-форме, которая является вирулентной. Однако они относительно легко могут диссоциировать под влиянием ряда факторов (например, под действием фага) и через О-форму переходить в S-авирулентную форму. Возбудитель чумы имеет признаки, характерные для представителей семейства Enterobacteriaceae. Он оксидазо-отрицателен и каталазо-положителен; проявляет выраженную ферментативную активность по отношению к различным моно-, ди-, трисахаридам и спиртам; расщепляет на 1-3 сутки глюкозу, маннозу, маннит, мальтозу, эскулин, до кислоты без газа; не ферментирует лактозу, сахарозу, сорбит, инозит, дульцит, мочевину. Отношение к глицерину, салицину, арабинозе, рамнозе и мелибиозе - вариабельное. Не образует индол, сероводород, ацетилметилкарбинол. Дает положительную реакцию с метиловым красным. Протеолитические свойства выражены слабо: не разжижает желатин и не свертывает молоко (табл. 23). Таблица 23 Основные ферментативные свойства возбудителей чумы
Примечание: «+» - расщепление; «-»-отсутствие расщепления; «±» - возможны варианты расщепления.
Важным свойством чумного микроба является его способность к денитрификации, т.е. восстановлению нитратов в нитриты. Эта окислительно-восстановительная реакция служит стойкой генетической меткой, используемой во всех схемах внутривидовой классификации штаммов чумного микроба. Чумной микроб (кроме штаммов, выделенных от полевок на Закавказском нагорье), в отличие от псевдотуберкулезного микроба, синтезирует ферменты патогенности - фибринолизин и плазмокоагулазу. Фибринолизин обладает способностью локально растворять сгустки фибрина и фибриногена крови в очагах воспаления. Плазмокоагулаза обусловливает свертываемость плазмы крови кролика, морской свинки и человека. Фибринолизин-коагулазная система обеспечивает возбудителю чумы высокую инвазивную способность и генерализацию чумной инфекции. Большинство штаммов чумного микроба продуцируют в окружающую среду антибиотикоподобное вещество (бактериоцин), который получил название пестицин 1(Р1). Он представляет собой видоспецифический термолабильный мономерный белок. Р1 участвует в гидролизе муреинлипопротеина клеточной стенки чувствительных к нему клеток, превращая их в нежизнеспособные сферопласты. Он подавляет рост штаммов Y. Pseudotuberсulosis I серовара (по Талю) и некоторых штаммов Y. pestis, циркулирующих в природных очагах чумы Закавказского нагорья, Горного Алтая, на Гиссарском хребте, в Таджикистане, и т.д., что связано с наличием в их составе 3,6-ди-деоксид-В-рибогексозы, которая выполняет роль рецептора для Р1. Способность к продукции пестицина 1, фибринолизина и плазмокоагулазы является видовым признаком штаммов Y. pestis и играет важную роль в таксономии и дифференциальной диагностике чумы. Исключение составляют штаммы кавказского подвида, которые выделяются от полевок в Закавказском нагорье и Горном Дагестане. Они не только не продуцируют Р1, но и проявляют к нему чувствительность. Пестицин-фибринолизин-плазмокоагулаза кодируются одной низкомолекулярной плазмидой - pPst. Эти признаки сцеплены друг с другом и потеря одного из них сопровождается потерей двух других. В настоящее время методами иммунохимического анализа в чумном микробе обнаружено до 90 иммунохимически активных компонентов, среди которых многие являются общими с Y. pseudotuberсulosis, E. coli, Schigella и эритроцитами человека О-группы. И только некоторые из них, как капсульный антиген (фракция I, FI), являются специфическими для возбудителя чумы. FI-основой компонент, связанный с капсулой, представляет собой чистый белок. Наиболее интенсивно синтез FI происходит при 37 °С выращивания in vitro и организме животных (in vivo). При более низких температурах культивирования капсульный антиген у микроорганизма не обнаруживается. В организме членистоногих (блох) FI не выявляется. Фракция I является основным иммуногеном и обладает строгой специфичностью, хотя в природе описаны штаммы, не синтезирующие этот белок. Геном возбудителя чумы состоит из хромосомы размером 4,65 т.п.н. и трех плазмид-пестиногенности (pPst), кальцийзависимости (рСаd), фракции I и «мышиного токсина» (pFra), имеющих молекулярные массы соответственно 6, 47 и 61-65 мегадальтон. pPst кодирует продукцию пестицина I, устойчивость к нему, синтез фибринолизина и плазмокоагулазы. Наличие этой плазмиды повышает вирулентность возбудителя чумы в опытах при подкожном заражении морских свинок и белых мышей. рСаd определяет характер роста клеток при 37 °С в зависимости от наличия в среде ионов кальция, а также отвечает за синтез антигенов V, W и других поверхностных белков. pFra ответственна за продукцию фракции I и синтез «мышиного» токсина. Возбудитель чумы относится к группе полипатогенных бактерий с высокой инвазивностью, но с относительно невысокой токсичностью. К ферментам патогенности относятся гиалуронидаза, фибринолизин, коагулаза, нейраминидаза, каталаза и др. Характерными признаками вирулентных штаммов возбудителя чумы являются: наличие капсулы, V- W- и рН6-антигенов, способность синтезировать пурины, образование пигментированных колоний на среде с гемином, пестициногенность, неспособность расти на средах при 37 °С в отсутствии ионов кальция. Дифференциальная диагностика культуры чумного микроба от большинства видов патогенных бактерий и банальной микрофлоры, как правило, особого труда не составляет. Если культуру чумного микроба невозможно дифференцировать от палочки Фридлендера, кишечной палочки, сальмонелл и других представителей кишечной группы бактерий при микроскопии мазков, так как они практически ничем не отличаются, то по морфологии колоний на агаре и характеру роста на жидких питательных средах это сделать, возможно. Исключением является возбудитель псевдотуберкулеза в R- и OR- формах, который по морфологии микроба в мазках, а так же культуральным свойствам часто просто невозможно отличить от возбудителя чумы. В таблице 24 представлена дифференциальная диагностика. Таблица 24 Дифференциация возбудителей чумы и псевдотуберкулеза
Примечание:*- типичныевирулентные штаммы. ** - 17-25% штаммов Y. Pseudotuberculosis лизируются чумным фагом Покровской. *** - свежевыделенные штаммы чумного микроба могут ферментировать мочевину. **** - способность синтезировать капсульный антиген (F1) отсутствует у штаммов возбудителя чумы, выделяемых во Вьетнаме (в том числе и от людей), а также – от грызунов в некоторых Среднеазиатских природных очагах чумы. ПРАКТИЧЕСКИЕ ЗАНЯТИЯ Занятие 1. Биологические свойства Y. pestis и Y. pseudotuberculosis · Изучение характера роста культуры на скошенном агаре. · Изучение морфологии микробов в мазках, приготовленных из агаровой культуры, и в мазках-отпечатках органов грызунов, павших от чумы. Окрашивание мазков по Граму и синькой Леффлера. Постановка пробы с 3 % КОН. · Посев каждой культуры на 3 чашки питательного агара (ПА), 2 чашки агара с генцианвиолетом, в пробирки с 0,3 % питательным агаром, средами Гисса с глюкозой, лактозой, сахарозой, глицерином, рамнозой, арабинозой, маннитом, мальтозой, со средой Кристенсена, цветной дифференциальной средой (ЦДС), в питательный бульон (ПБ), ПБ с KN03, в пробирки со скошенным питательным агаром. · Определение пестициногенной активности (приложение). · Посев культуры возбудителя чумы и возбудителя псевдотуберкулеза на чашку 1,5 % питательного агара с генцианвиолетом бляшками диаметром 0,5-1,0. Примечания: - посев на ПА поместить при 28 °С, 37 °С и при комнатной температуре; - посевы на агаре с генцианвиолетом - при 28 °С и при комнатной температуре; - посев на 0,3% ПА - в шкаф при комнатной температуре; Занятие 2. Биологические свойства Y. pestis и Y. pseudotuberculosis · Изучение морфологию формирующихся колоний на ПА, ПА с генцианвиолетом. · Изучение морфологии роста культур в бульоне. · Приготовление мазков из агаровой и бульонной культур, окрашивание по Граму и синькой Леффлера. · Определение подвижности на 0,3 % ПА. · Изучение ферментации углеводов и спиртов на средах Гисса, уреазной активности на среде Кристенсена и ЦДС (приложение). · Изучение фаголизабельности. · Постановка пробы на чувствительность к бактериофагам Л-413С, Покровской, псевдотуберкулезному методом «стерильного пятна». · Постановка пробы на чувствительность к бактериофагам Л-413С, Покровской, псевдотуберкулезному двухслойным методом (приложение). · Постановка пробы на чувствительность к бактериофагу Покровской методом дифференциального рабочего титра (приложение). · Постановка пробы на чувствительность к бактериофагу Л-413С ускоренным методом. · Посев культуры в пробирки со скошенным питательным агаром. Занятие 3. Биологические свойства Y. pestis и Y. pseudotuberculosis
Примечание: инкубирование посевов с кровью на ПА при 37 °С. Занятие 4. Биологические свойства Y. pestis и Y. pseudotuberculosis
Рост на среде Джексона-Берроуза На поверхность среды с гемином или ДАС нанести 0,1 мл взвеси односуточной агаровой культуры, содержащей 5х103 м.к./мл, и распределить шпателем по поверхности агара. Посевы инкубировать 4-5 сут. при 28 °С. Вирулентные бактерии чумы вырастают в виде бурых колоний на среде с гемином, темно-красных или темно-синих на ДАС (Psb)+. Бактерии, утратившие вирулентность, образуют бесцветные колонии (Psb)-. Рост на среде Хигучи-Смита и питательной среде для определения потребности чумного микроба в ионах кальция сухой (ВМ) Для исследования на среде Хигучи-Смита и ВМ из односуточной агаровой культуры готовят взвеси, содержащие 103 или 2х103м.к./мл. Из каждого разведения по 0,1 мл высевают на чашки со средой. Посевы инкубируют при 37 °С. Через 48 ч отмечают колонии I порядка (бактерии, независимые от ионов кальция, авирулентные). Через 24 ч дополнительной инкубации при той же температуре регистрируют колонии II порядка, состоящие из авирулентных иммуногенных клеток. Затем посевы помещают при 28 °С и подсчитывают вновь появившиеся колонии, состоящие из вирулентных клеток. В качестве контроля 100 или 200 м.к. высевают на агаровые пластины с 1 % дефибринированной крови барана или кролика при использовании среды Хигучи-Смита или питательный агар для выращивания чумного микроба-при работе со средой ВМ.
Примечание: инкубация посевов на среде ВМ и контроля - при 37 °С, на среде Джексона-Берроуза - при 28°С. Занятие 5. Биологические свойства Y. pestis и Y. pseudotuberculosis
Занятие 6. Биологические свойства Y. pestis
· Выявление ДНК (pFra и pPst) Y.pestis методом полимеразной цепной реакции. · Подготовка пробы - микробной взвеси 104 м.к./мл. · Постановка ПЦР: ГенПест тест-система предназначена для выявления ДНК возбудителя чумы в исследуемом материале методом ПЦР. Для детекции Y. pestis подобрана система, состоящая из двух пар праймеров, выбранных на основе двух собственных плазмид чумного микроба pFra и pPst. Первая пара праймеров, соответствующих нуклеотидной последовательности гена pla (плазмида pPst), обеспечивает амплификацию фрагмента 478 п.н., вторая пара праймеров F21-F22, комплементарных участку гена caf (плазмида pFra), амплифицирует фрагмент - 295 п.н. В состав тест - системы входят следующие компоненты: деионизованная вода,10 х буфер, дНТФ, plaY 1 – праймер, plaY 2 – праймер, F 21 - праймер, F 22 – праймер, фермент Taq - полимераза, контрольная ДНК, масло вазелиновое. Набор хранится при температуре -20°С. Срок хранения не более 6 месяцев. Объектом для исследования может быть клинический материал, объекты внешней среды, органы животных, а также клеточные взвеси при идентификации выделенных культур. При работе с клиническим материалом и загрязненными объектами внешней среды необходим предварительный этап подготовки проб (выделение ДНК). Подготовку проб осуществляют с помощью поставляемого отдельно набора и прилагаемой к нему инструкции. При работе с микробными взвесями (109 м.к./мл) возможна их обработка мертиолатом натрия (0,01 %) с последующим прогреванием при 56 °С в течение 30 мин для обеззараживания. Разведения чистых культур из 109 м.к./мл до 104~ 106 м.к./мл следует готовить на бидистиллированной воде, поскольку хлорид натрия, входящий в состав физиологического раствора, является ингибитором ПЦР. Для проведения ПЦР готовят необходимое количество 0,6 мл микропробирок, соответствующее числу исследуемых проб, а также еще три пробирки - для приготовления реакционной смеси, положительного и отрицательного контролей. Затем извлекают тест-систему из морозильной камеры, размораживают содержимое пробирок (для этого лучше использовать ледяную баню). После транспортировки или длительного хранения пробирки центрифугируют на микроцентрифуге 20 сек (для осаждения капель со стенок) и тщательно перемешивают на вортексе. После этого готовят реакционную смесь в специально предназначенной для этого микропробирке из расчета на одну пробу: деионизованной воды - 5,8 мкл, 10х буфера – 2,5 мкл, дНТФ - 2,5 мкл праймеров - по 1 мкл каждого и фермента Taq - полимеразы - 0,2 мкл. Фермент в реакционную смесь вносят в последнюю очередь и оставляют его вместе с наконечником в микропробирке. Затем в этот наконечник вставляют дозатор, настроенный на 15 мкл, тщательно перемешивают реакционную смесь не только круговыми движениями наконечника, но и поступательными движениями поршня дозатора (пипетированием). По окончании перемешивания добавляют по 15 мкл реакционной смеси в каждую микропробирку, включая контроли, после чего раскапывают минеральное масло. Минеральное масло вносят по одной капле из 1 мл наконечника микродозатора для предотвращения испарения реакционной смеси при термоциклировании. После этого в пробирку, обозначенную как отрицательный контроль, вносят 10 мкл деионизованной воды, а в пробирку, обозначенную как положительный контроль, - 10 мкл контрольной ДНК (контрольную ДНК необходимо вносить специально предназначенным для этого микродозатором!). Пробы в объеме 10 мкл вносят (также предназначенным для этого микродозатором) под минеральное масло. По мере заполнения пробирки закрывают, нумеруют, помещают в амплификатор и проводят термоциклирование по следующей матричной программе: 94°------------3 мин х 1 цикл 94°-----------40 сек! 58°-----------40 сек! 35 циклов 72°-----------40 сек! 72°------------3 мин х 1 цикл 10°-----------хранение Учет результатов. Продукты, полученные в ПЦР, анализируют методом электрофореза в 1,5–2 % агарозе с добавлением бромистого этидия. Агарозу готовят на 1х ТАЕ буфере, который готовят из 50-кратного, путем разведения в 50 раз (состав 1 литра 50- кратного ТАЕ буфера: 242 г триса, ледяная уксусная кислота - 57 мл, 0,5 М раствор ЭДТА - 100 мл, бромистый этидий - 0,5 мкг/мл, рН 8,0). Доведенную до кипения и охлажденную до 50 °С агарозу заливают в специальную ванночку, устанавливают гребенку и оставляют застывать при комнатной температуре. После полимеризации осторожно извлекают гребенку и переносят гель в камеру для проведения электрофореза. Затем к амплификату добавляют 4-5 мкл смеси, состоящей из 0,25 % бромфенолового синего и 25 % фиколла-400, приготовленной на дистиллированной воде, перемешивают при помощи того же наконечника и вносят в карманы геля. По окончании камеру подключают к источнику тока и задают напряжение 10-15 в/см. Электрофоретическое разделение продолжают в течение 25-35 мин до прохождения лидирующего красителя около 2/3 длины трека (рекомендуемая длина трека - 4 см), после чего извлекают гель из камеры и помещают на стекло трансиллюминатора с УФ излучением 310 нм. Внимание! С гелем агарозы следует работать в перчатках, поскольку бромистый этидий является мутагеном. Оценка результатов ПЦР: 1. Положительный контроль - выявляются две специфичных полосы размером 478 п.н. и 295 п.н. 2. Отрицательный контроль: полосы на уровне положительного контроля должны отсутствовать, наличие полос свидетельствует о контаминации тест-системы. 3. Анализируемые пробы: наличие одной или двух полос строго на уровне положительного контроля указывает на присутствие ДНК данного возбудителя. 4. Наличие полос, располагающихся выше или ниже контрольных, является неспецифичным ответом и во внимание не принимается. 5. Полученные результаты можно документировать с помощью видеосистемы или фотографированием геля с использованием оранжевого или интерференциального (594 им) светофильтра. Чувствительность метода – не менее 1000 геномов Y. pestis в 1 мл. Занятие 7. Биологические свойства Y. pestis и Y. pseudotuberculosis
Занятие 8. Биологические свойства Y. pestis
Занятие 9. Биологические свойства Y. pestis
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-30; просмотров: 1390; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.163.23 (0.012 с.) |