Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Иммуносерологические методы диагностики инфекционных болезнейСодержание книги
Поиск на нашем сайте
По данному разделу освещаются современные понятия об антигенах, антителах, характеризуются агглютинационные, преципитационные, твердофазные иммунохимические, иммунохроматографические, иммунофлуоресцентные и др. методы диагностики. На практических занятиях отрабатываются навыки проведения обеззараживания объектов, взятых для исследования; методические приемы постановки комплекса серологических реакций, наиболее часто используемых в лабораториях; правила оценки и учета полученных результатов. Серологические методы исследования в настоящее время широко применяются в лабораторной диагностике целого ряда заболеваний различной этиологии. Они позволяют фиксировать наличие антигенсодержащего материала, не прибегая к изоляции патогена. В отличие от бактериологического и биологического методов, достоверность которых вытекает из факта выделения возбудителя, серологические тесты представляют доказательства присутствия в исследуемом материале искомого агента на основе специфического взаимодействия антиген-антитело (АГ-АТ). Важным преимуществом этих методов является возможность индикации не только корпускулярных, но и субкорпускулярных и растворимых АГ, а также специфических АТ. Теоретические основы взаимодействия антигена с антителом Антигены В иммунологических методах участвуют два специфических комплементарных по отношению друг к другу компонента: антиген и соответствующее ему антитело. Они составляют одну специфическую систему типа «ключ-замок». АГ - это вещества различного происхождения, несущие признаки генетической чужеродности и вызывающие развитие специфических иммунных реакций (гуморальных, клеточных, состояние иммунологической толерантности, индуцирование иммунной памяти). Свойства АГ определяются комплексом признаков: иммуногенность, антигенность, специфичность, чужеродность. Чужеродность. АГ вызывает иммунный ответ, т.е. образование АТ только в тех случаях, когда он чужероден. К собственным АГ организм толерантен. Антигенность - способность АГ избирательно реагировать со специфичными к нему AT или АГ-распознающими рецепторами лимфоцитов. Антигенностью обладают микроорганизмы и их токсины, паразиты. Синтез АТ могут индуцировать яды белковой природы (змеиный), эритроциты, яичный альбумин, белки, сложные полисахариды (ПС), липополисахариды (ЛПС), полипептиды, комплексные соединения белков с липидами, полисахаридами, некоторые искусственные высокополимерные соединения. Иммуногенность - способность индуцировать иммунный ответ. При анализе генетического контроля иммунного ответа выявлены линии мышей и морских свинок, одни из которых отвечают на определенный АГ, а другие остаются к нему ареактивными. Иными словами, АГ в качестве иммуногена проявляется тогда, когда иммунная система конкретного организма способна к адекватному ответу. Иммуногенность АГ повышается по мере увеличения размера и полимерности молекул этого АГ. Низкополимерный АГ может вызывать не только более слабый, но и качественно иной иммунный ответ, чем АГ, обладающий тем же составом, но более высоким уровнем полимерности. Повышение иммуногенности АГ-ов с возрастанием полимерности их молекул имеет верхний предел. При дальнейшем возрастании полимерности молекулы АГ приобретают способность вызывать специфическую иммунодепрессию или толерантность. Иммунологическая толерантность – это состояние организма, при котором последний не способен отвечать продукцией АТ на введение АГ. Специфичность - структурные особенности, отличающие один АГ от другого. АГ делятся на 2 группы: - полноценные (полные) - иммуногенные, всегда проявляющие антигенные свойства; неполноценные (гаптены) – неимунногенные. Способностью вызывать развитие иммунного ответа и определять его специфичность обладает фрагмент молекулы АГ - антигенная детерминанта (эпитоп). Антигенная детерминанта – небольшой участок молекулы АГ, образующий пространственную конфигурацию за счет остатков молекул аминокислот, углеводов или липидов, который и является фактическим местом присоединения молекулы АТ. 1 молекула АГ может содержать несколько структурно отличающихся антигенных детерминант, что обусловливает поливалентность АГ. Валентность АГ-енной молекулы определяется числом однородных детерминант, способных соединиться с активным центром АТ одной и той же специфичности. Молекулы гаптенов моновалентны. По валентности АГ можно судить о его молекулярной массе.В среднем валентность белковых АГ составляет от 5 до 15. В ответ на большинство поливалентных антигенов АТ образуются к каждой детерминанте. Комплементарность АГ-детерминанты к АТ у специфического АГ выше, чем у перекрестно реагирующего. В основе взаимодействия перекрестно-реагирующих АГ с АТ лежит структурное подобие или полное сходство с детерминантами специфического АГ. Моноклональные AT специфически распознают только одну АГ-детерминанту и связываются с ней. Поликлональные AT, как правило, распознают несколько антигенных детерминант в составе АГ. По химическому строению, основным иммунологическим свойствам, а также по методам их изучения детерминанты можно условно подразделить на 3 больших группы: 1) Гаптены [от греч. hapto, прикрепляться] (неполные АГ) - это вещества с низкой молекулярной массой, способные вступать во взаимодействие с АТ, но не вызывающие их образование. При увеличении размера гаптенов (при конъюгировании с белками), они приобретают свойства полноценных АГ. Полугаптены - неорганические вещества (йод или хром), присоединение которых к молекуле белка меняет его иммуногенные свойства. Образующиеся AT специфичны к йоду или хрому, то есть к детерминантам на поверхности полного АГ, но не к белку-носителю. Проантигены - гаптены, способные присоединяться к белкам организма и сенсибилизировать его как аутоантигены. Например, метаболиты грибов пенициллов или продукты распада пенициллинов могут связывать белки и вызывать развитие к ним иммунных реакций. 2) Олигосахаридные детерминанты входят в состав гликолипидов (АГ клеточных стенок бактерий и главные АГ групп крови) и гликопротеинов (резус-фактор). Основные АГ-нные детерминанты полисахаридов представляют собой короткие олигосахариды (1-6 остатков сахара). Специфические свойства АГ-ой детерминанты полисахарида определяются последовательностью входящих в ее состав сахаров и способом их соединения друг с другом. 3) Пептиды -АГ-енные детерминанты белковой природы состоят из аминокислотных остатков, расположенных в пространстве определенным образом. Их делят на концевые и конформационные. Специфичность 1-ых определяется, главным образом, составом короткой концевой пептидной цепочки. 2-ые находятся в середине молекулы и их специфичность определяется ее третичной структурой. Соединение АГ-ой детерминанты с активным центром АТ обеспечивается различными типами химического взаимодействия молекул: ван-дер-ваальсовыми силами, полярным взаимодействием молекул, образованием водородных связей и гидрофобным взаимодействием. Прочность такого соединения выше для тех детерминант, в составе которых находятся радикалы, приобретающие в водном растворе сильный «+» или «–» заряд. Большая часть АГ способна запускать иммунные реакции, выступая в последующем в качестве мишени, в отношении которой эти реакции реализуются. Суперантигены – АГ, способные непосредственно, без предварительной обработки АГ-представляющими клетками взаимодействовать с молекулами МНС (главного комплекса гистосовместимости). При этом распознавание АГ теряет строгую избирательность, вовлекаются большие группы Т-клеток. Их активация сопровождается избыточной продукцией различных медиаторов иммунного ответа, что может привести к развитию аутоиммунных реакций (например, АГ микоплазм, стрептококков, кампилобактеров и т.д.). Особую группу составляют АГ, способные подавлять иммунные реакции с развитием специфической неспособности отвечать на них. Это состояние известно как иммунная толерантность. Благодаря генетическому разнообразию индивидуумов, вещество-иммуноген для одного из них может быть толерогеном для другого. Действуя как иммуноген при парентеральном введении (например, внутримышечно), то же вещество может быть толерогеном при введении другим путём (например, пероральном). В роли АГ выступают белки, полисахариды, нуклеиновые кислоты; эти соединения могут образовывать комбинации между собой или с липидами. Липиды неиммуногенны, что определяется недостаточной жёсткостью структуры этих молекул и преимущественно линейной конфигурацией. Наибольшей иммуногенностью обладают белковые АГ. Чем дальше от человека в эволюционном отношении отстоят организмы, тем большую иммуногенность проявляют их белки. АГ подразделяются на а) экзогенные – поступают извне, подвергаются эндоцитозу и расщеплению в АГ- представляющих клетках, б) эндогенные – продукты собственных клеток организма (белки, синтезируемые вирусинфицированными клетками хозяина и аномальные белки опухолевых клеток). Молекулярная масса АГ имеет существенное значение. Вещества с массой более 5-10 кД - сильные иммуногены. Исключение - нуклеиновые кислоты, обладающие большой молекулярной массой, но слабой (по сравнению с белками) иммуногенностью. Растворимость. Нерастворимые белки (например, кератины) не могут находиться в коллоидной фазе и не вызывают развития иммунных реакций. АГ по специфичности делятся на 10 типов: 1. Видовая специфичность – особи одного вида отличаются от особей другого вида (АГ мыши отличаются от АГ кролика). 2. Групповая специфичность (индивидуальная) - различия среди особей одного вида организмов. Аллоантигены (изоантигены) - АГ конкретного индивидуума, обладающие иммуногенностью по отношению к другим представителям этого вида, но не к организму-донору трансплантата. Яркий пример изоантигенов - групповые Аг крови, присутствующие на мембранах эритроцитов и других клеток. Поскольку человек обладает естественными AT к групповым Аг крови, последние приобретают свойства сильных трансплантационных Аг. Поэтому перед трансплантацией и гемотрансфузией необходимо определить группы крови донора и реципиента. 3. Типоспецифичность – относится только к микробам. Так пневмококки по полисахаридным АГ делятся на 4 типа, каждый из которых обладает своими особенностями. 4. Гетероспецифичность – обусловлена АГ, общими для представителей разных видов (сходство отдельных структурных компонентов органов и тканей человека с антигенами возбудителей чумы, бруцеллеза, холеры). 5. Органоидная специфичность – обусловлена органоидами клетки (ядро, митохондрии и т.д.). 6. Функциональная специфичность – связанна с функцией данной молекулы (общие АГ тканей печени человека и животного за счет их функции). 7. Стадиоспецифичность – введена в связи с развитием иммунологии эмбриогенеза. 8. Гаптеноспецифичность – любой гаптен может обеспечивать свою специфичность. 9. Патологическая специфичность – обеспечена специфичностью патологически измененных тканей (ожоговые, лучевые, раковые). 10. АГ-енная специфичность ДНК Антигены бактерий. Большинство возбудителей инфекционных заболеваний человека, их структуры и токсины - полноценные АГ, вызывающие развитие иммунных реакций. В основе классификации АГ бактерий лежит их локализация (жгутиковый, капсульный АГ и т.д.), биологическая функция (гемолизин, энтеротоксин) или метод обнаружения (преципитиноген, агглютиноген). Н-АГ - жгутиковые - входят в состав бактериальных жгутиков, представляют собой белок флагеллин, разрушающийся при нагревании, после обработки фенолом сохраняющий свои АГ-енные свойства. О-АГ -соматический - связан с ЛПС клеточной стенки, термостабилен, сохраняется при кипячении в течение 1-2 ч, не разрушается после обработки формалином и этанолом. К-АГ - капсульные располагаются более поверхностно, чем О-АГ, тесно связаны с ЛПС клеточной стенки и капсулой. У некоторых возбудителей имеется термолабильный Vi-AГ (АГ вирулентности), выявление которого имеет важное значение для серотипирования бактерий. Поверхностные эндоАГ (жгутиковый, капсульный, соматический) характеризуются большей антигенностью, чем внутриклеточные (цитоплазматических мембран, цитоплазмы, рибосом, НК). Для возбудителей отдельных инфекций предложены АГ-енные схемы - классификация видов бактерий по АГ-енной структуре. Первая АГ-енная классификация бактерий была разработана Уайтом. В 1934 г. Кауфман предложил использовать ее для классификации бактерий рода Salmonella. В настоящее время она значительно дополнена. Сейчас существуют АГ-енные классификации для бактерий родов Salmonella, Shigella, Citrobacter, Escherichia, Arizona и др. АГ-енные схемы используются для сопоставления с набором уже известных серотипов бактерий, выделенных в различных микробиологических учреждениях мира. Антигенные схемы предполагают описание отдельных АГ бактерий в виде формул, характеризующих определенные серотипы. АГ бактерий обозначают цифрами или буквами. Комбинации АГ, обозначенные в виде АГ-енной формулы, характеризуют биохимически определенный вид серологически. Осуществляется постоянный контроль и дополнение существующих АГ-енных схем. Антигенность бактерий – одно из основных свойств. У разных возбудителей она оказывает неодинаковое влияние на возникновение, течение и исход инфекционного заболевания. Изучение АГ-енной структуры бактерий и продуктов их жизнедеятельности необходимо для создания эффективных слабореактогенных вакцин, для изучения патогенеза заболеваний и совершенствования методов лабораторной диагностики. Особую группу бактериальных АГ составляют протективные АГ [от лат. protectio, защита] - термолабильные белки, иммунизация которыми защищает лабораторных животных от гибели после заражения летальными дозами патогенных микроорганизмов. В настоящее время подобные АГ выделены у возбудителей сибирской язвы, чумы, бруцеллёза, туляремии и коклюша. Нередко протективные АГ используют для изготовления вакцин. АГ-нная изменчивость бактерий в настоящее время подвергается серьезному научному исследованию. В результате внешних воздействий у бактерий могут наблюдаться АГ-вариации или АГ-модуляции - изменение, частичная или полная потеря АГ. Качественные и количественные изменения АГ у определенных видов могут привести к изменению серотипа. Различают Н-О-вариации (потеря Н-АГ и переход к чистой О-форме), О-вариации (потеря или количественное изменение компонентов этого комплекса), S-R-вариации переход из гладкой в шероховатую форму), V-W-изменение формы (количественное изменение содержания V-АГ). АГ-енная изменчивость усложняет серологическую диагностику заболеваний. АГ-енные модуляции это исчезновение поверхностных АГ под влиянием АТ. АГ-енные модуляции – обратимый феномен: при удалении АТ АГ микроорганизмом экспрессируются вновь. АГ вирусов. Заражённые вирусами клетки начинают экспрессировать вирусспецифические АГ. Вирусные АГ могут быть структурными и неструктурными. Первые представлены веществами, кодируемыми нуклеиновыми кислотами, а также клеточными метаболитами (липиды, углеводы), захватываемыми вирионами при почковании. Неструктурные АГ не входят в состав вирионов, а образуются в инфицированных клетках на различных этапах репродукции вирусов. У вирусов выделяют ядерные (сердцевинные), капсидные и суперкапсидные АГ. У пара- и ортомиксовирусов имеются также поверхностные V-AГ- гемагглютинин и нейраминидаза. Антитела Антитела (АТ) – это белки, относящиеся к тому или иному классу иммуноглобулинов (Ig), которые вырабатываются клетками лимфоидных органов после стимуляции АГ, поступающими в организм (при естественных инфекциях, вакцинации, действии ксенобиотиков) или образующимися эндогенно. Как правило, АТ специфически взаимодействуют с комплементарным АГ. Однако существуют АТ, взаимодействующие с АГ-детерминантами, общими для различных АГ. Такие AT известны как перекрёстно реагирующие, или гетероспецифичные. AT существуют в миллионах разновидностей и каждая молекула имеет уникальный участок связывания АГ-детерминанты. Практически АТ могут быть получены к любому АГ. В большинстве случаев АТ представлены сывороточными гликопротеинами, мигрирующими в составе медленной фракции γ- глобулинов при электрофорезе белков сыворотки. Поэтому для обозначения сывороточной фракции АТ иногда применяют устаревший термин «γ- глобулины». В соответствии с международной классификацией, ныне совокупность сывороточных белков, обладающих свойствами АТ, называютIg. AT образуют одну из основных фракций белов крови, составляя 20 % массы общего белка плазмы. AT устойчивы к действию слабых кислот и щелочей, а также к нагреванию до 60 °С. Существует 5 классов Ig: IgG, IgM, IgA, IgE, IgD,различающихся по молекулярной массе, содержанию углеводов, составу полипептидных цепей, коэффициентам седиментации и др. характеристикам. Структурная единица AT - мономер - молекула цилиндрической формы, состоящая из 2-х идентичных тяжелых (H-heavy) и 2-х идентичных легких (L-light) аминокислотных цепей, соединенных дисульфидными S-S- связями) (рис. 17).
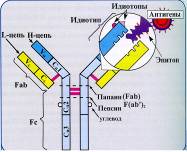
Рис. 17. Строение молекулы IgG
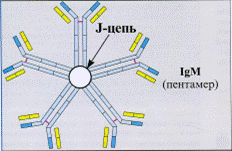
Молекулярная масса легких цепей составляет около 23 кД, и они состоят примерно из 214-220 аминокислотных остатков. Молекулярная масса тяжелых цепей варьирует в пределах 50-73 кД. При обработке папаином молекула Ig распадается на 3 фрагмента. Два из них – одинаковые, состоят из легкой цепи и половины тяжелой цепи и обладают способностью соединяться с АГ. Эти два фрагмента обозначают как F(ab)1 и F(ab)2, т.е. фрагменты, связывающие АГ (от англ. antigen binding). Установлено, что Fab-фрагменты определяют АТ-ельную специфичность Ig. Fab-фрагменты AT взаимодействуют с антигенными детерминантами (принцип «ключ-замок»). Связывание АГ с AT нековалентно и обратимо. Третий фрагмент с мол. массой около 55 кД состоит из двух половин Н-цепей. В связи с постоянством аминокислотного состава, его обозначили как Fc – фрагмент (от англ. constant- постоянный). Fc – фрагмент не обладает способностью связывать АГ, но определяет ряд других важных видов биологической активности, необходимых для полного проявления всех функций АТ. С Fc – фрагментом связана способность АТ проходить через плаценту, усиливать фагоцитоз, нейтрализовать вирусы, связывать комплемент. Fc- фрагмент взаимодействует со своим рецептором в мембране различных типов клеток (макрофаг, нейтрофил, тучная клетка). В зависимости от структуры H-цепей выделяют 5 классов (изотипов) АТ: IgA, IgD, IgE, IgG и IgM), отличающихся физическими, функциональными, химическими и антигенными свойствами. Значительную помощь для постановки более обоснованного диагноза оказывает определение не только суммарного титра, но и класса Ig. IgM – пентамер из 5 субъединиц, соединенных дисульфидными связями, имеет 10 АГ-связывающих участков, молекулярная масса 900000 Д (рис. 18), составляет около 10 % антител сыворотки крови.
. Рис.18. Строение молекулы IgM
В сыворотке здорового человека могут также циркулировать мономерные и 2-х валентные IgM (в высоких титрах их выявляют при макроглобулинемии Вальденстрема). IgM - филогенетически наиболее древний Ig, что находит отражение в особенностях этого Ig (прежде всего его относительная неспецифичность). IgM – наиболее ранний класс АТ, обнаруживаемый при первичном попадании АГ в организм, выявление IgM указывает на наличие острого инфекционного процесса. Синтез других классов АТ при первичном контакте с конкретным АГ начинается позднее; несмотря на это, образование IgM к некоторым АГ (например, жгутиковым АГ бактерий) осуществляется постоянно. IgM – основной класс АТ, синтезируемых у новорожденных и младенцев. Пик их образования приходится на 4-5 сутки с последующим снижением титра. Период полужизни IgM составляет 5,1 дня. Fс – фрагмент IgM может участвовать в классическом пути активации комплемента. Молекулы IgM опсонизируют, агглютинируют, преципитируют и лизируют содержащие АГ структуры. В отличие от прочих Ig синтез Ig M мало подвержен действию иммунодепрессантов. После первичного контакта с АГ синтез Ig М обычно сменяется образованием более дифференцированных IgG. IgG составляет около 75 % антител сыворотки крови. Имеется 4 подкласса – IgG 1, IgG 2, IgG 3, IgG 4. Мономер, имеет 2 эпитоп-связывающих участка. Maксимальные титры IgG при первичном ответе наблюдают на 6-8 сутки. Обнаружение высоких титров IgG к АГ конкретного возбудителя указывает на то, что организм находится в стадии реконвалесценции или конкретное заболевание перенесено недавно, а также на обострение хронического заболевания. В большом количестве IgG синтезируются при вторичном иммунном ответе.IgG – основной класс АТ, защищающий организм от бактерий, вирусов и токсинов. Период полужизни IgG составляет 7-23 дня в зависимости от подкласса. IgG непосредственно участвуют в реакциях нейтрализации, а также усиливают фагоцитоз, действуя как опсонины и связывая рецепторы Fс – фрагмента в мембране фагоцитирующих клеток, в результате чего фагоциты поглощают и лизируют микроорганизмы. Fс – фрагмент IgG может участвовать в классическом пути активации комплемента. Особенностью IgG является высокая скорость связывания с АГ. Фракция IgG вызывает преципитацию растворимых АГ, а также агглютинацию и даже лизис (в присутствии комплемента) корпускулярных АГ. Только IgG беременной женщины форсируют плацентарный барьер путем опосредованного рецепторами эндоцитоза. Транспорт IgG через плаценту обеспечивает формирование пассивного иммунитета у плода. IgА (мол.масса 170 тыс. Да) (составляют 15-20 % всех Ig) секретируются поверхностью эпителиев, присутствуют в слюне, слезах, молоке, выделяются на поверхность слизистых оболочек, где взаимодействуют с АГ, усиливая защитные свойства слизистых оболочек пищеварительного тракта, дыхательных, половых и мочевыводящих путей. В сыворотке крови IgА циркулирует в виде мономеров, а в секретируемых Ig преобладают 4-х- валентные димеры, имеющие секреторный компонент, который защищает антитело от разрушения ферментами. Период полужизни Ig А составляет 5,8 дня. IgЕ (м.м. 180 тыс. Да) составляют 0,002 % АТ сыворотки крови. Мономер, имеет два эпитопсвязывающих участка. Участвуют в противопаразитарном иммунитете и в ответе на аллергены. Fав фрагменты молекулы IgЕ специфически взаимодействуют с АГ, попавшим в организм. Сформированный иммунный комплекс взаимодействует с рецепторами Fc- фрагментов IgЕ, встроенных в клеточную мембрану базофила или тучной клетки. Это взаимодействие является сигналом для экзоцитоза гистамина, других биологически активных веществ и развертывания острой аллергической реакции. Защитные потенции Ig Е направлены преимущественно против гельминтов. Синтез IgЕ увеличивается при паразитарных инвазиях, IgЕ – моноклональной миеломе. Период полужизни IgЕ составляет 2,3 дня. IgD – составляют около 0,2 % АТ сыворотки крови. Мономер, имеет два эпитопсвязывающих участка. Биологическая роль этих Ig не установлена. IgD обнаружен на поверхности развивающихся В-лимфоцитов, контролируя их активацию и супрессию. Увеличение содержания IgD достигает максимума к 10 годам жизни, некоторое увеличение титров находят у беременных, у больных бронхиальной астмой, системной красной волчанкой и лиц с иммунодефицитами. Период полужизни IgD составляет 2,8 дня. Важными характеристиками АТ являются: аффинность – прочность связывания АТ с АГ, которая зависит от пространственного соответствия реагирующих поверхностей, соотношения концентраций связанных и свободных АГ и AT, электростатических, гидрофобных воздействий и сил Ван дер Ваальса. Аффинитет – мера специфичностиАТ. Авидность – интегральная характеристика силы связи (прочности) между АГ и АТ, учитывающая взаимодействие всех активных центров АТ со всеми эпитопами АГ. Это свойство АТ, определяет степень их сродства к АГ и реакцию формирования комплекса АГ-АТ. Авидность зависит как от аффинности, так и от числа активных центров на молекуле АТ. Авидность возрастает при избытке АГ, т.к. молекула АТ может формировать множественные связи с АГ. Валентность – равна числу активных (АГ-связывающих) центров АТ. Ig разных классов бывают 2-х валентными (IgG) (такие АТ известны как полные АТ), или поливалентными (IgM). Это свойство АТ выявляется при взаимодействии их с АГ: связываясь с АГ-енными детерминантами, IgG и IgM вызывают их видимую агрегацию. Мономерные же молекулы IgA, хотя и имеют два активных центра, не осаждают АГ, т.к. их активные центры настолько сближены, что IgA не может выполнять роль связующего мостика. Наряду с двухвалентными, в организме существуют также неполные АТ. Такие АТ называют еще моновалентными или блокирующими. Эти Ig отличаются наличием на молекуле 1-ого активного специфического участка. Соединяясь с АГ, они не могут агрегировать частицы в крупные конгломераты, а лишь блокируют их. Это не значит, что второй активный центр молекулы отсутствует, он просто экранирован различными структурами, либо обладает низкой авидностью. Для выявления неполных АТ существуют специальные реакции – проба Кумбса, блокирующая проба и др. «Нормальные» АТ (синоним – природные АТ) – АТ, появление которых не связано с иммунизацией или инфекцией. Таких АТ два рода: 1-ые направлены против определенных изоантигенов. 2-ые направлены против антигенов, не относящихся к изоантигенам. Например, в сыворотке крови в небольших титрах обнаруживаются АТ против бактерий кишечной группы, многих кокков, некоторых чужеродных клеток. В крови человека и животных обнаруживают АТ, которые могут реагировать с различными АГ (эритроцитами, бактериями и т.д.), несмотря на то, что организм не подвергался иммунизации этими АГ. Не исключено, что часть нормальных АТ является обычными иммунными АТ, выработанными на инфекционный агент, проникший в небольшой дозе и вызвавший латентное заболевание. Возникновение нормальных АТ может быть обусловлено попаданием АГ с пищей. Важной характеристикой АТ является специфичность. Специфичность АТ определяется по их способности отличать АГ, против которого они были получены (гомологичный АГ), от любого другого АГ. Иммунологический перекрест – это способность АТ взаимодействовать со сходными АГ, отличными от гомологичного. В большинстве случаев перекрестнореагирующие АТ имеют к данным АГ более низкую аффинность, чем к гомологичному. Однако могут быть исключения. Это явление называется гетероклитичностью, а АТ, обладающие большим аффинитетом к гетерологичному АГ, называются гетероклитичными. В последнее время предлагается концепция полиспецифичности, заключающаяся в том, что каждое АТ в действительности может с высокой аффинностью связываться с множеством совершенно разных АГ. Перекрестно-реагирующие или гетероспецифичные Ig – это АТ, взаимодействующие с АГ-детерминантами, общими для различных АГ. Взаимодействие АТ с АГ носит специфический характер. Продуктами этой реакции являются иммунные агрегаты (комплексы АГ=АТ), которые могут образовывать преципитат в случае растворимого АГ, или агглютинат - в случае корпускулярного АГ. Реакции АГ=АТ in vitro имеют большое диагностическое значение, т.к. благодаря своей специфичности они позволяют количественно и качественно обнаруживать АГ или АТ. Существующие серологические и иммунохимические методы дают возможность определять любые антигены, используя моноспецифические сыворотки. Специфичность – способность АГ или АТ реагировать только с гомологичным АТ или АГ, соответственно. Чем выше специфичность, тем меньше регистрируется ложно+ и ложно - результатов. Чувствительность – возможность определения минимальных количеств АГ или АТ. В серологических реакциях участвуют АТ, принадлежащие, главным образом, к Ig классов G и M.
|
||||
|
Последнее изменение этой страницы: 2016-12-30; просмотров: 1338; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.49.90 (0.011 с.) |