
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Энтропия термодинамической машины совершающий необратимый циклСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
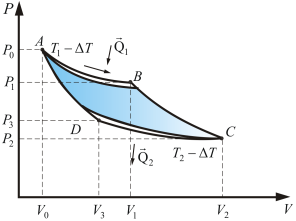
Предположим для простоты, что необратимость цикла обусловлена тем, что теплообмен между рабочим телом и источником теплоты (считаем холодильник тоже «источником», только отрицательной температуры) происходит при конечных разностях температур, т.е. нагреватель, отдавая тепло, охлаждается на ∆T, а холодильник нагревается на ΔТ. Любой процесс, не удовлетворяющий условию обратимости, мы называем необратимым процессом. Примером необратимого процесса является процесс торможения тела под действием сил трения. При этом скорость тела уменьшается, и оно останавливается. Энергия механического движения тела расходуется на увеличение энергии хаотического движения частиц тела и окружающей среды. Происходит диссипация энергии. Для продолжения движения необходим компенсирующий процесс охлаждения тела и среды. В нашем случае тепловых машин, нагреватель и холодильник – не идеальны, они не обладают бесконечной теплоёмкостью и в процессе работы получают или отдают добавочную температуру ΔТ. На рисунке 5.6 изображен один из таких необратимых циклов.
Как видно из рисунка, площадь внутри фигуры ABCD уменьшилась из-за потерь, значит уменьшилась полезная работа цикла и КПД. Для обратимого цикла Карно
Для необратимого цикла
Таким образом, КПД всякого реального теплового двигателя из-за трения и неизбежных тепловых потерь гораздо меньше КПД цикла Карно. Т.е. всегда Холодильная машина Холодильная машина – это машина, работающая по обратному циклу Карно (рис. 5.4). То есть если проводить цикл в обратном направлении, тепло будет забираться у холодильника и передаваться нагревателю (за счет работы внешних сил). Обратный цикл Карно можно рассмотреть на примере рис. 5.5. При изотермическом сжатии В–А, от газа отводится количество теплоты Q1 при Т1. В процессе изотермического расширения D–С к газу подводится количество теплоты Q2. В этом цикле
Если рабочее тело совершает обратный цикл, то при этом можно переносить энергию в форме тепла от холодного тела к горячему за счет совершения внешними силами работы.
Для холодильных машин, работающих по циклу Карно
Аддитивность. Аддитивность (лат. additivus — прибавляемый) — свойство величин, состоящее в том, что значение величины, соответствующее целому объекту, равно сумме значений величин, соответствующих его частям, в некотором классе возможных разбиений объекта на части. Например, аддитивность объёма означает, что объём целого тела равен сумме объёмов составляющих его частей. Вопрос 51 Второй закон термодинамики
Вопрос 51
К П Д тепловой машины. Коэффицие́нт поле́зного де́йствия (КПД) — характеристика эффективности системы (устройства, машины) в отношении преобразования или передачи энергии. Определяется отношением полезно использованной энергии к суммарному количеству энергии, полученному системой; обозначается обычно η («эта»)[1]. КПД является безразмерной величинойи часто измеряется в процентах.
Цикл Карно Французский инженер Сади Карно предложил идеальный цикл, который даёт максимальное КПД т.е.
Вычислим КПД цикла Карно для идеального газа. При изотермическом процессе внутренняя энергия идеального газа остаётся постоянной. Поэтому количество полученной газом теплоты
где Количество отдаваемой холодильнику теплоты
Для того чтобы цикл был замкнутым, состояние 1 и 4 должны лежать на одной и той же адиабате. Отсюда вытекает условие
Аналогично для состояний 2 и 3 должно вытекать условие
Разделив одно соотношение на другое, приходим к условию замкнутости цикла
Теперь подставляя
В результате получим формулу для КПД цикла Карно:
где Вернёмся к соотношению (2), которое имеет место в случае обратимого цикла Карно. В общем случае при возможности необратимого цикла Карно это соотношение примет вид:
Преобразуем (3) следующим образом:
В результате получим
Для обратимого цикла Карно: для необратимого цикла Карно: Для произвольного обратимого цикла:
для произвольного необратимого цикла:
|
|||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-10; просмотров: 564; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.117.45 (0.009 с.) |



 – этот вывод справедлив независимо от причин необратимости циклического процесса.
– этот вывод справедлив независимо от причин необратимости циклического процесса. ,
,  и работа, совершаемая над газом, отрицательна, т.е.
и работа, совершаемая над газом, отрицательна, т.е.
 .
.
 .
Чем больше N1, тем больше вероятность данного макросостояния, т.е. тем большее время система будет находиться в этом состоянии. Эволюция системы происходит в направлении от маловероятных состояний к более вероятным. Т.к. механическое движение - это упорядоченное движение, а тепловое - хаотическое, то механическая энергия переходит в тепловую. При теплообмене состояние, в котором одно тело имеет более высокую температуру (молекулы имеют более высокую среднюю кинетическую энергию), менее вероятно, чем состояние, в котором температуры равны. Поэтому процесс теплообмена происходит в сторону выравнивания температур.
Энтропия - мера беспорядка. S - энтропия.
Уравнение Больцмана:
.
Чем больше N1, тем больше вероятность данного макросостояния, т.е. тем большее время система будет находиться в этом состоянии. Эволюция системы происходит в направлении от маловероятных состояний к более вероятным. Т.к. механическое движение - это упорядоченное движение, а тепловое - хаотическое, то механическая энергия переходит в тепловую. При теплообмене состояние, в котором одно тело имеет более высокую температуру (молекулы имеют более высокую среднюю кинетическую энергию), менее вероятно, чем состояние, в котором температуры равны. Поэтому процесс теплообмена происходит в сторону выравнивания температур.
Энтропия - мера беспорядка. S - энтропия.
Уравнение Больцмана: 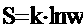 где k - постоянная Больцмана. Это уравнение раскрывает статистический смысл законов термодинамики. Величина энтропии во всех необратимых процессах увеличивается. С этой точки зрения жизнь - это постоянная борьба за уменьшение энтропии. Энтропия связана с информацией, т.к. информация приводит к порядку (много будешь знать - скоро состаришься).
где k - постоянная Больцмана. Это уравнение раскрывает статистический смысл законов термодинамики. Величина энтропии во всех необратимых процессах увеличивается. С этой точки зрения жизнь - это постоянная борьба за уменьшение энтропии. Энтропия связана с информацией, т.к. информация приводит к порядку (много будешь знать - скоро состаришься).
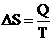 ,
где S- энтропия. Т.е. изменение энтропии равно количеству теплоты, переданному в процессе, к температуре, при которой происходил этот процесс.
В этом смысле адиабатный процесс - это изоэнтропийный процесс.
Из первого закона термодинамики:
,
где S- энтропия. Т.е. изменение энтропии равно количеству теплоты, переданному в процессе, к температуре, при которой происходил этот процесс.
В этом смысле адиабатный процесс - это изоэнтропийный процесс.
Из первого закона термодинамики:
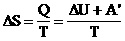 - основное уравнение термодинамики.
Из теоремы Карно следует:
- основное уравнение термодинамики.
Из теоремы Карно следует:  .
Следовательно:
.
Следовательно: 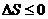

 . Этот цикл состоит из двух изотерм и двух адиабат и носит название цикла Карно.
. Этот цикл состоит из двух изотерм и двух адиабат и носит название цикла Карно. - изотермическое расширение при
- изотермическое расширение при  ,
,  - адиабатическое расширение,
- адиабатическое расширение, 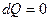 ,
, 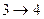 - изотермическое сжатие при
- изотермическое сжатие при 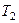 ,
, 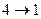 - изотермическое сжатие,
- изотермическое сжатие, 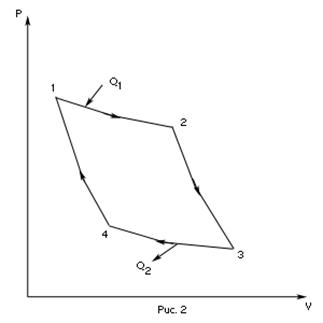
 равно работе
равно работе  , совершаемой газом при переходе из состояния 1 в состояние 2 (рис. 2). Эта работа равна
, совершаемой газом при переходе из состояния 1 в состояние 2 (рис. 2). Эта работа равна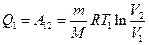 ,
,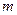 – масса идеального газа в тепловой машине.
– масса идеального газа в тепловой машине.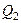 равно работе
равно работе 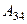 , затраченной на сжатие газа при переходе его из состояния 3 в состояние 4. Эта работа равна
, затраченной на сжатие газа при переходе его из состояния 3 в состояние 4. Эта работа равна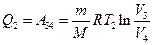 .
.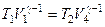 .
. .
. .
.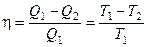 . (2)
. (2)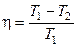 ,
, . (3)
. (3)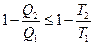 ,
, 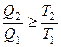 , или
, или 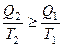
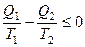 .
.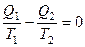 ,
,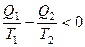 .
.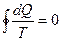 ,
,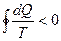 .
.


