
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Агрегатные состояния веществаСодержание книги
Поиск на нашем сайте
Агрега́тное состоя́ние вещества (лат. aggrego 'присоединяю') — состояние одного и того же вещества в определённом интервалетемператур и давлений, характеризующееся определёнными, неизменными в пределах указанных интервалов, качественными свойствами:
Вопрос 43 Термодинамические параметры. Основные понятия. Моделью материального тела является совокупность атомов и молекул, свойства; законы взаимодействия, движения которых известны. Существует два раздела физики: термодинамика и статическая физика - они изучают закономерности процессов в макротелах, состоящих из атомов и молекул. Они изучают тепловые свойства макротел. Метод термодинамики -- феноменологический(учитывает превращение энергии без учёта природы исследуемых явлений, связанных с молекулярно-кинетической структурой вещества). Метод статической физики -- исследование системы, состоящей из атомов и молекул путём задания уравнений, описывающих поведение совокупности частиц, и с помощью вероятностного метода определяется поведение макросистемы. Классическая термодинамика, основоположником которой является Томсон, Клаузиус, изучает равновесные системы и процессы в таких системах. Неравновесная термодинамика. Она ещё развивается и изучает неравновесные системы. Основоположниками молекулярно - кинетической теории являются Клаузис, Больцман, Максвелл. Создателем статической физики является Гиббс. В основе статической физики был положен метод Гиббса для равновесных системы. Термодинамические системы и термодинамические параметры. С точки зрения квантовой механики термодинамическая система - это макросистема, включающая огромные количества частиц, чаще атомов. Рассмотрим в качестве частиц мельчайшие частицы, нейтронный газ, фотонный, электронный газы. С точки зрения классической теории термодинамическая система, которая находится в состоянии термодинамического равновесия, любая термодинамическая система характеризуется набором термодинамических параметров: объём, температура, давление, энтальпия и т.д. Система находится в состоянии термодинамического равновесия, если термодинамические параметры не зависят от времени. При этом в системе отсутствуют любые потоки(тепловые, частиц и др.). Термодинамическая система не равновесна, когда некоторые параметры определяются внешним условием и не постоянны во времени. Параметры, описывающие состояние термодинамической системы, называется термодинамическими параметрами. Термодинамические системы характеризуются определённым числом независимых термодинамических параметров, которые принимают любое значение. Число независимых параметров зависит от характера термодинамической системы, т.е. выбор параметров произволен, но число их определено для данной системы. Для идеального одноатомного газа таких параметров будет три - P, V, T. Равновесное состояние газа, заключённого в сосуд состояние будет определяется двумя параметрами (непример T и V), все остальные будут как функции от этих параметров. Все термодинамические параметры разделяются на внутренние и внешние. Внутренние параметры определяются физическими объектами системы. Внешние параметры определяются физическими объектами не входящими в состав системы. Одна и та же величина, в зависимости от различных условий может быть как внутренней, так и внешней. Пример
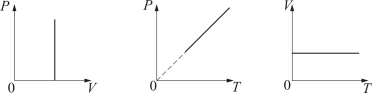
Рисунок 5.1 Во-вторых, параметры делятся на экстенсивные (аддитивные) и интенсивные. Экстенсивные - при объединении систем с различными параметрами результирующее значение параметра равно сумме параметров. Интенсивные - не обладают свойством аддитивности. Пример: давление и температура. Вопрос 43.2 Уравнение состояния тела Уравне́ние состоя́ния — уравнение, связывающее между собой термодинамические (макроскопические) параметры системы, такие, как температура, давление, объём, химический потенциал и др. Уравнение состояния можно написать всегда, когда можно применять термодинамическое описание явлений. При этом реальные уравнения состояний реальных веществ могут быть крайне сложными. Уравнение состояния системы не содержится в постулатах термодинамики и не может быть выведено из неё. Оно должно быть взято со стороны (из опыта или из модели, созданной в рамках статистической физики). Термодинамика же не рассматривает вопросы внутреннего устройства вещества. Вопрос 44 Законы идеальных газов Изопроцессы идеального газа – процессы, при которых один из параметров остаётся неизменным. 1. Изохорический процесс. Закон Шарля. V = const. Изохорическим процессом называется процесс, протекающий при постоянном объёме V. Поведение газа при этом изохорическом процессе подчиняется закону Шарля: При постоянном объёме и неизменных значениях массы газа и его молярной массы, отношение давления газа к его абсолютной температуре остаётся постоянным: P/Т = const. График изохорического процесса на РV -диаграмме называется изохорой. Полезно знать график изохорического процесса на РТ - и VT -диаграммах (рис. 1.6). Уравнение изохоры:
Если температура газа выражена в градусах Цельсия, то уравнение изохорического процесса записывается в виде
где Р0 – давление при 0 °С, α - температурный коэффициент давления газа равный 1/273 град-1. График такой зависимости на Рt -диаграмме имеет вид, показанный на рисунке 1.7.
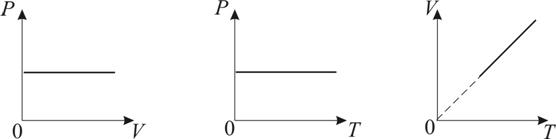
2. Изобарический процесс. Закон Гей-Люссака. Р = const. Изобарическим процессом называется процесс, протекающий при постоянном давлении Р. Поведение газа при изобарическом процессе подчиняется закону Гей-Люссака: При постоянном давлении и неизменных значениях массы и газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным: V/T = const. График изобарического процесса на VT -диаграмме называется изобарой. Полезно знать графики изобарического процесса на РV - и РT -диаграммах (рис. 1.8).
Уравнение изобары:
Если температура газа выражена в градусах Цельсия, то уравнение изобарического процесса записывается в виде
где α =1/273 град -1- температурный коэффициент объёмного расширения. График такой зависимости на Vt диаграмме имеет вид, показанный на рисунке 1.9.
3. Изотермический процесс. Закон Бойля – Мариотта. T = const. Изотермическим процессом называется процесс, протекающий при постоянной температуре Т. Поведение идеального газа при изотермическом процессе подчиняется закону Бойля – Мариотта: При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const. График изотермического процесса на РV -диаграмме называется изотермой. Полезно знать графики изотермического процесса на VT - и РT -диаграммах (рис. 1.10).
Уравнение изотермы:
4. Адиабатический процесс (изоэнтропийный): Адиабатический процесс – термодинамический процесс, происходящий без теплообмена с окружающей средой. 5. Политропический процесс. Процесс, при котором теплоёмкость газа остаётся постоянной. Политропический процесс – общий случай всех перечисленных выше процессов. 6. Закон Авогадро. При одинаковых давлениях и одинаковых температурах, в равных объёмах различных идеальных газов содержится одинаковое число молекул. В одном моле различных веществ содержится NA =6,02·1023 молекул (число Авогадро). 7. Закон Дальтона. Давление смеси идеальных газов равно сумме парциальных давлений Р, входящих в неё газов:
Парциальное давление Pn – давление, которое оказывал бы данный газ, если бы он один занимал весь объем. При
8. Объединённый газовый закон (Закон Клапейрона). В соответствии с законами Бойля – Мариотта (1.4.5) и Гей-Люссака (1.4.3) можно сделать заключение, что для данной массы газа
Вопрос 45
|
||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-10; просмотров: 387; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.130.228 (0.011 с.) |





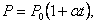
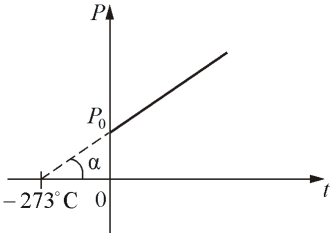
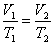 .
.
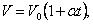
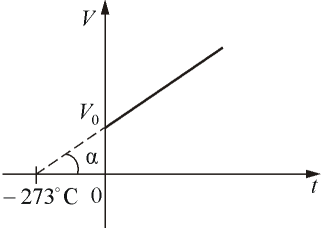

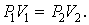
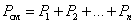
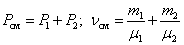 , давление смеси газов:
, давление смеси газов:




